蒲公英根活性组分体外抗菌及抗炎作用
2022-01-24马艳妮魏悦李智宁王志尧景炳年宁二娟杨锐范毅
马艳妮,魏悦,李智宁,王志尧,景炳年,宁二娟,杨锐,范毅*
1(河南省科学院,河南 郑州,450002) 2(河南省纳普生物技术有限公司,河南 郑州,450002) 3(成都理工大学 材料与化学化工学院,四川 成都,610059)
蒲公英,菊科植物蒲公英 (TaraxacummongolicumHand.-Mazz.)、碱地蒲公英 (TaraxacumborealisinenseKitam.)或同属数种植物的干燥全草,性味苦、甘、寒,归肝、胃经,具有清热解毒、消肿散结、利尿通淋之功效,用于治疗疔疮肿毒、乳痈、凜病、目赤、咽痛、肺痈、肠痈、湿热黄疸和热淋涩痛等[1]。蒲公英不仅含有碳水化合物、蛋白质、脂肪、氨基酸、维生素、磷、铁、钙等营养成分[2],同时含有挥发油[3]、多糖[4]、有机酸[5]、黄酮[6]、生物碱[7]等活性成分,具有降糖[8-9]、抗菌[10-11]、抗炎[12-14]、抗氧化[15-16]、抗肿瘤[17-18]、调节肠道微生态[19]等多种生物学活性,是我国传统医学和现代医学均证实的药食同源物品之一。近年来,蒲公英也被逐渐用于饮品[20-21]、保健品[22]、兽医用[23]等方面,因此,蒲公英具有巨大的市场开发潜力。蒲公英根,作为蒲公英药用部位的一部分,其多糖含量相对较高[24],具有良好的抗氧化活性[25],但是目前鲜少有明确的报道。本研究以河南市售蒲公英根为研究对象,通过乙醇提取、大孔树脂柱分离与体外抗菌抗炎活性评价相结合,研究了蒲公英根的抗菌和抗炎活性组分。
1 材料与方法
1.1 材料与试剂
蒲公英根购于河南郑州药材市场,经河南中医药大学董诚明教授鉴定为菊科植物蒲公英(Taraxacummongolicum)的干燥根,标本存放于河南省科学院天然产物重点实验室;标准菌株(大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC 29213、肺炎链球菌ATCC 49619、化脓性链球菌ATCC19615、鼠伤寒沙门氏菌ATCC 13311),南京便诊生物科技有限公司;临床菌株(鸡大肠杆菌CVCC 1555、鸡金黄色葡萄球菌CVCC 548、鸡白痢沙门氏菌CVCC 1887、牛无乳链球菌CVCC 540),中国兽医药品监察所;小鼠巨噬细胞RAW264.7,成都理工大学提供;1640培养基,美国Hyclone公司;青霉素-链霉素,上海碧云天生物技术有限公司;胎牛血清,新西兰Newzerum公司;CCK-8试剂盒,大连美仑生物技术有限公司;ELISA试剂盒,北京达科为生物技术有限公司;培养细胞总RNA提取试剂盒,成都福际生物技术有限公司;逆转录试剂盒,南京诺唯赞生物科技有限公司;脂多糖(lipopolysaccharides,LPS),美国Sigma公司;D101大孔树脂,天津市光复精细化工研究院;蒲公英颗粒(批号18013702),江西心诚药业有限公司;胰蛋白胨,上海宝录生物科技有限公司;牛肉浸膏,北京双旋微生物培养基制品厂;亚硝酸钠、硝酸铝、氢氧化钠、95%乙醇、氢氧化钠滴定液、硫酸等均为分析纯。
1.2 仪器与设备
ME204型分析天平,美国Mettler公司;TU-1810紫外分光光度计,北京普析通用仪器有限责任公司;wi93008麦氏比浊仪,东西仪(北京)科技有限公司;Countstar细胞计数仪,上海睿钰生物科技有限公司;Nanodrop2000核酸检测仪、CO2培养箱,美国Thermo公司;酶标仪、q-PCR仪、Gel DocTMXR+with Image LabTMsoftware凝胶成像系统,美国Bio-Rad公司;DHP-9082电热恒温培养箱,上海红华仪器有限公司。
1.3 实验方法
1.3.1 蒲公英根提取与分离
称取蒲公英根2份,每份200 g,分别用体积分数70%乙醇回流提取3次,每次1 h,料液比分别为1∶12、1∶10和1∶10(g∶mL),趁热抽滤,合并滤液并浓缩至无醇味,加蒸馏水稀释,离心取上清液。称取D101大孔树脂2份,每份400 g,用95%乙醇浸泡过夜后分别装柱,用95%乙醇洗涤、蒸馏水冲至无醇味。将2份上清液分别上样,其中一个树脂柱(1)用蒸馏水、30%乙醇、70%乙醇依次洗脱,另一个树脂柱(2)用蒸馏水、70%乙醇依次洗脱,洗脱液分别收集并浓缩至干,冷藏备用。
1.3.2 总黄酮质量分数测定
总黄酮质量分数按照参照文献[26]方法测定。芦丁对照品的线性回归方程为Y=0.008 4X+0.165 9,r=0.999 0。
1.3.3 多糖质量分数测定
多糖质量分数按照硫酸-蒽酮方法测定[1]。葡萄糖线性回归方程为Y=0.042 3X+0.024 8,r=0.999 1。
1.3.4 体外抗菌活性测定
1.3.4.1 菌悬液的制备
从活化的固体平板上挑取单菌落接种至液体培养基中,37 ℃培养16~18 h后,用培养基稀释成浓度为106~108CFU/mL的菌悬液,备用。
1.3.4.2 最小抑菌浓度的测定
利用倍半稀释法[26-27]测定各样品的最小抑菌浓度(minimum inhibitory concentration,MIC)。先将各样品制成初始质量浓度为250 mg/mL的水溶液,阳性药物蒲公英颗粒制成初始质量浓度为500 mg/mL的水溶液,再分别用液体培养基依次倍半稀释,共稀释7个浓度。在96孔板各孔中加入100 μL供试菌液和100 μL待测溶液,每种测试菌液分别设置阴性对照(加入100 μL供试菌液和100 μL液体培养基)和空白对照(加200 μL液体培养基),于37 ℃培养18~20 h,各待测组澄清的孔所对应的最小检测质量浓度即为其MIC。
1.3.4.3 最小杀菌浓度的测定
MIC实验结束后,分别从澄清的各孔中取出少量液样涂布于固体培养基上,37 ℃培养18~24 h,完全没有细菌生长的各待测组所对应的最小检测质量浓度即为其最小杀菌浓度(minimum bactericidal concentration,MBC)[26-27]。
1.3.5 体外抗炎活性的测定
1.3.5.1 细胞复苏与传代
将冻存的小鼠巨噬细胞RAW264.7细胞于37 ℃下快速消融,然后转至已预热的2 mL含体积分数10%胎牛血清、1%青霉素-链霉素的1640培养液中,轻轻吹匀、800 r/min离心3 min,弃去上清液,再加新培养液吹匀后取适量转至细胞培养皿中,在37 ℃、体积分数5% CO2细胞培养箱中培养。
当培养皿中细胞密度达到80%~90%时,弃去培养基,用胰酶轻轻消化后加入新培养液轻轻吹打,直至细胞完全吹落,800 r/min离心3 min、弃上清液,重新加入新培养液,轻轻吹匀后取适量细胞悬液加入培养皿中,轻轻振匀后于细胞培养箱中培养。经过2~3代传代可用于正常实验操作。
1.3.5.2 药物浓度筛选
将处于对数生长期的RAW264.7细胞重悬后稀释至5×104个/mL,向96孔板内每孔加入100 μL细胞悬液,培养24 h,每孔再加入含不同浓度药物的培养液100 μL,每组设5个重复,继续培养24 h之后对各实验组进行CCK-8细胞毒性检测。在450 nm波长下测定各孔的吸光值(A),以只含培养液的孔为调零孔,以含细胞、不含药物的孔为空白对照孔,以含不同浓度药物的孔为测试孔,记录结果并计算细胞存活率。存活率计算如公式(1)所示:

(1)
1.3.5.3 抗炎活性测定
向6孔板内每孔加入处于对数生长期的细胞悬液2~3 mL,每孔3×105个细胞,每组设3个重复,培养24 h之后,弃去原培养液,每孔加入含不同药物与1 μg/mL LPS的培养液2~3 mL,设置对照组及模型组,继续培养24 h后先收集上清液,再用生理盐水清洗每孔2次,再加入0.5 mL细胞裂解液收集细胞,于-80 ℃保存备用[28-29]。
根据ELISA试剂盒说明书检测细胞上清液中炎症因子IL-1β、IL-6和TNF-α的浓度;根据培养细胞总RNA提取试剂盒说明书提取RAW264.7细胞的RNA,再参照逆转录试剂盒说明书进行逆转录。Q-PCR引物合成由擎科生物公司完成,添加适量引物与模板,按照Bio-rad SsoAdvancedTMUniversal SYBR® Green Supermix说明书进行q-PCR实验。
1.4 数据处理
2 结果与分析
2.1 提取分离结果与分析
蒲公英根醇提物经大孔树脂柱层析、依次用蒸馏水、30%乙醇、70%乙醇洗脱(即柱1)后所得的3个组分依次标记为PGYG1-D0、PGYG1-D30和PGYG1-D70;醇提物经大孔吸附树脂柱层析、依次用蒸馏水、70%乙醇洗脱(即柱2)后所得的2个组分依次标记为PGYG2-D0和PGYG2-D70,结果见表1。大孔吸附树脂柱分离后水洗脱部位的得率较高,可达16%以上,而且该部位多糖质量分数相对较高,接近6%;乙醇洗脱部位(PGYG1-D30、PGYG1-D70和PGYG2-D70)得率较低,尤其是当乙醇梯度洗脱时,各部分得率更低,不超过1%;而且,乙醇洗脱部位的总黄酮质量分数相对较高,能达到45%以上。
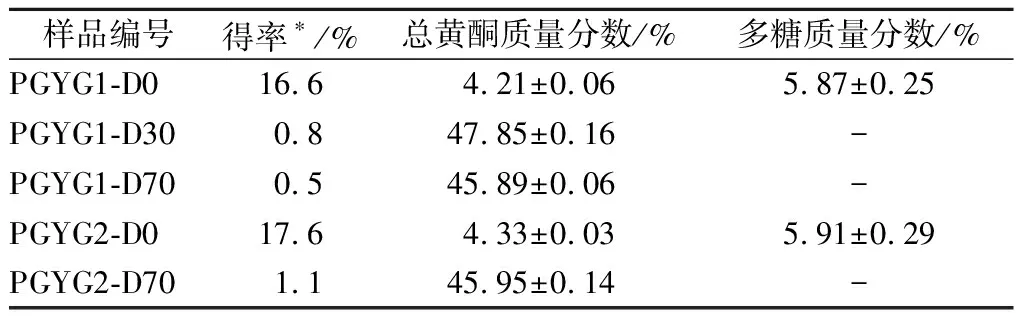
表1 蒲公英根各组分的得率与总黄酮、多糖质量分数Table 1 Yields and mass fractions of different components from dandelion root
2.2 体外抑菌检测结果与分析
2.2.1 MIC检测结果与分析
5种待测样品对9种供试菌(人、畜禽病原菌)的MIC检测结果见表2。5种待测样品对9种供试菌的抑菌效果均比阳性药物蒲公英颗粒的抑菌效果好,而且乙醇洗脱部位的抑菌效果普遍比水洗脱部位抑菌效果好(MIC值小),而且洗脱部位极性越小,抑菌效果越好。综合考虑各洗脱相的得率、工艺和活性,可以发现提取后用水和70%乙醇依次洗脱的工艺不仅简单,而且所得的乙醇洗脱组分(PGYG2-D70)得率高、抗菌效果好,9种供试菌中8种供试菌MIC可达1.95 mg/mL。
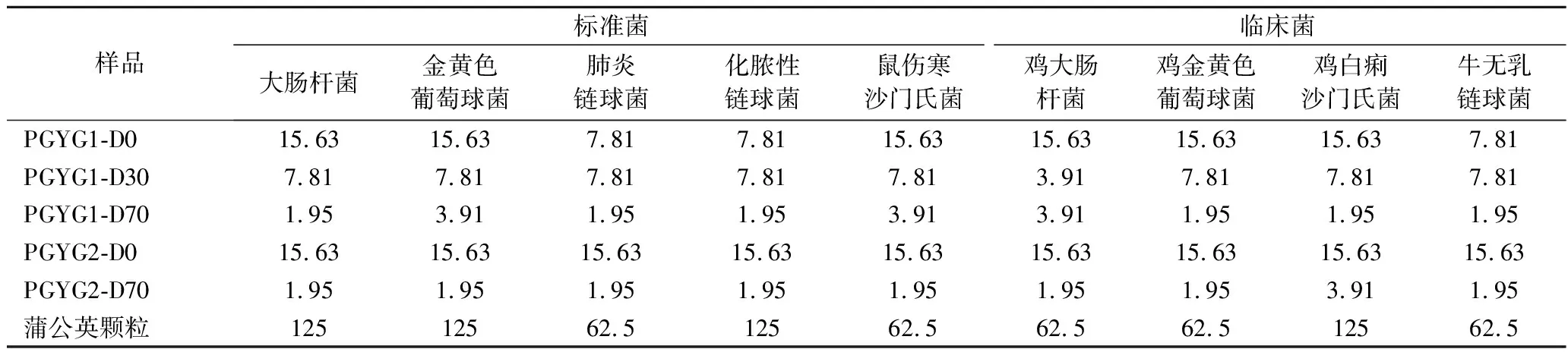
表2 蒲公英根各组分对9种供试菌的MIC检测结果 单位:mg/mL
2.2.2 MBC检测结果与分析
5种待测样品对9种供试菌的MBC检测结果见表3。乙醇洗脱部位对9种供试菌的杀菌效果普遍比水洗脱部位和阳性药物蒲公英颗粒的杀菌效果好(MBC值小)。其中,水洗脱后用70%乙醇洗脱所得部位的杀菌效果最好,MBC均为31.25 mg/mL,因此可以将该部位作为蒲公英根的抗菌活性组分。
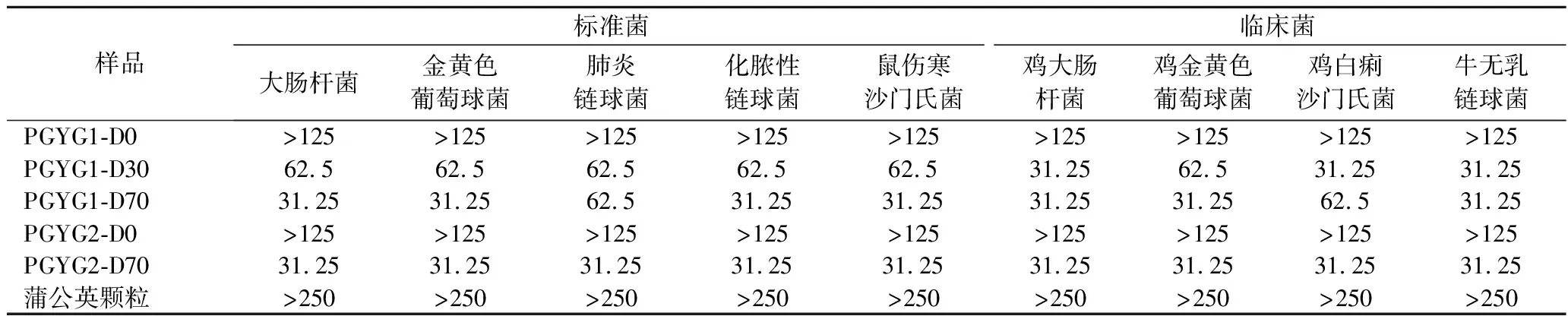
表3 蒲公英根各组分对9种供试菌的MBC检测结果 单位:mg/mL
2.3 体外抗炎检测结果与分析
2.3.1 测试浓度筛选结果与分析
参考抗菌活性结果,选取水和70%乙醇依次洗脱的2个部位(即PGYG2-D0和PGYG2-D70)作为抗炎活性评价的考察对象。分别设置不同质量浓度(0.25、0.5、1、2、4 mg/mL)同时处理小鼠巨噬细胞RAW 264.7,24 h后检测各组细胞的生长情况,如图1所示。2个组分在0.25 mg/mL时对巨噬细胞RAW 264.7的生长无影响,所以选择该浓度作为处理浓度,考察2个组分对巨噬细胞RAW264.7炎症模型的作用情况。
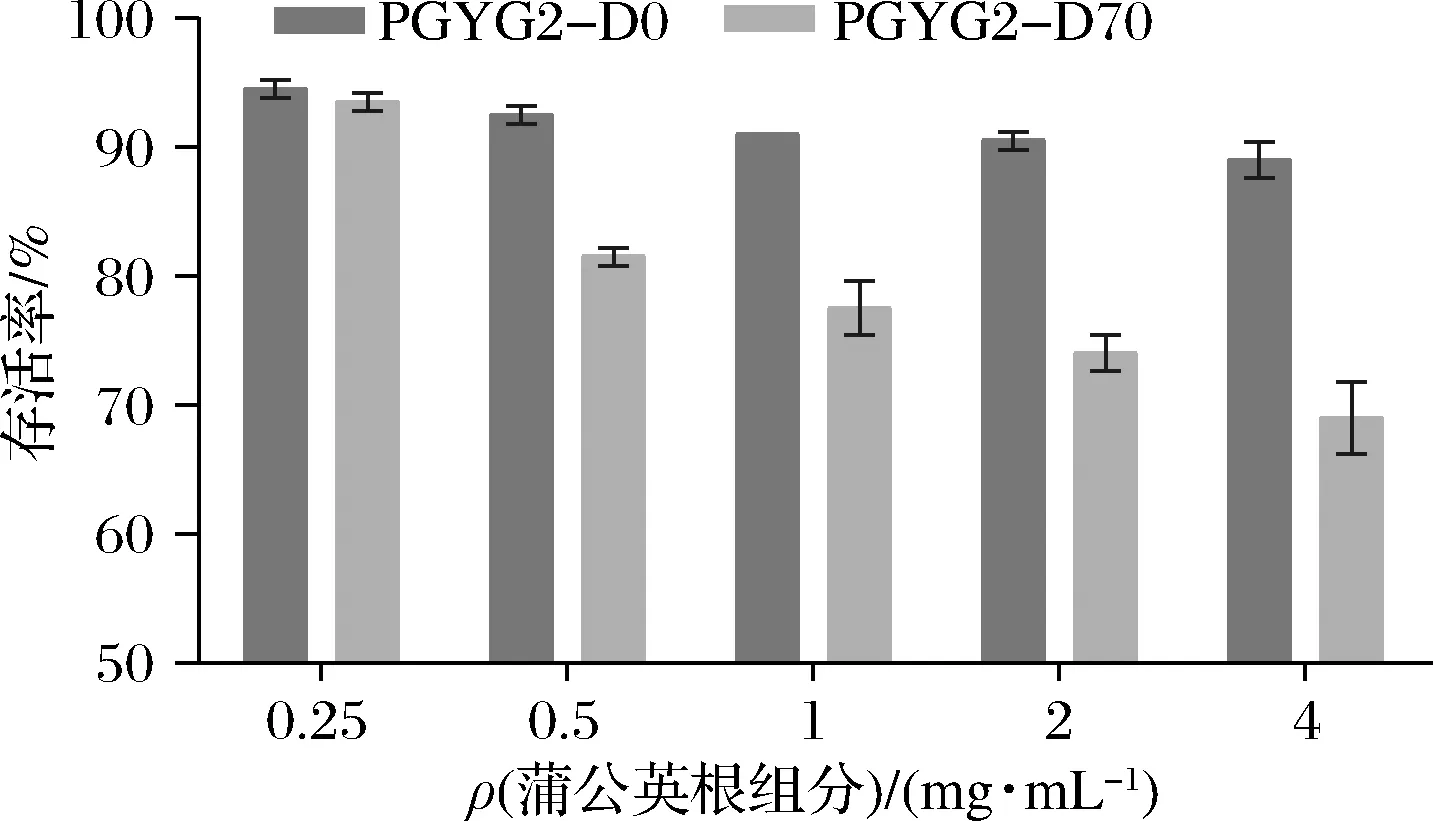
图1 不同质量浓度蒲公英根组分对细胞RAW264.7存活率的影响Fig.1 Survival rate of RAW264.7 cells treated by the components from dandelion root at different concentrations
2.3.2 炎症因子浓度检测结果与分析
蒲公英根2个待测组分对巨噬细胞RAW264.7的炎症因子IL-6、IL-1β和TNF-α浓度的影响见图2。相对于模型组而言,蒲公英根2个待测组分对炎症因子IL-6、IL-1β和TNF-α的分泌均有显著性抑制作用(P<0.05),而且,PGYG2-D70组分的抑制作用比PGYG2-D0的抑制作用更为显著(P<0.05)。
2.3.3 炎症因子转录水平结果与分析
2个待测组分对巨噬细胞RAW264.7的炎症因子IL-6、IL-1β和TNF-α转录水平的影响见图3。相对于模型组而言,2个待测组分对炎症因子IL-6和TNF-α的转录水平均有显著性抑制作用(P<0.05),而且这2个组分之间对IL-6的转录水平抑制存在显著性差异(P<0.05);PGYG2-D70对炎症因子IL-1β的转录水平有显著性抑制作用(P<0.05)。因此,也可以将70%乙醇洗脱部位作为蒲公英根的抗炎活性组分。
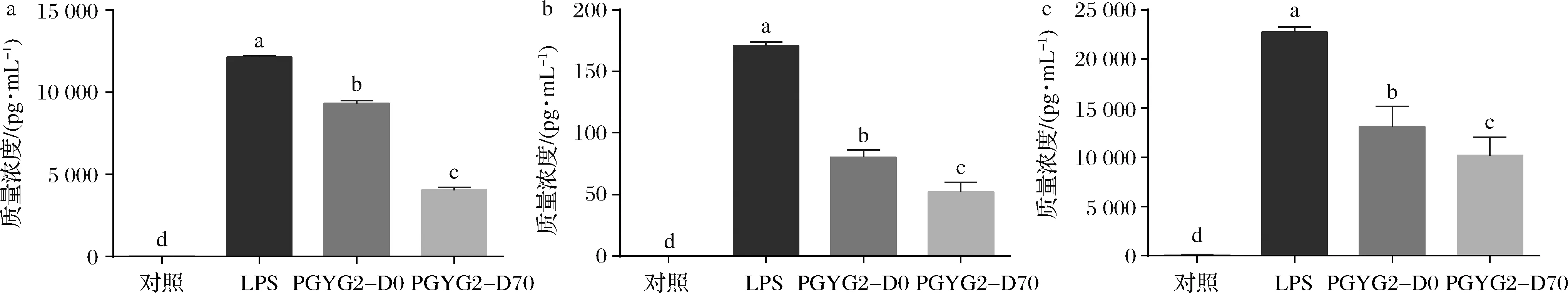
a-IL-6;b-IL-1β;c-TNF-α图2 蒲公英根不同组分对RAW264.7炎症因子浓度的影响Fig.2 Concentrations of inflammatory cytokines treated by different components from dandelion root 注:不同小写字母代表差异显著(P<0.05),(下同)
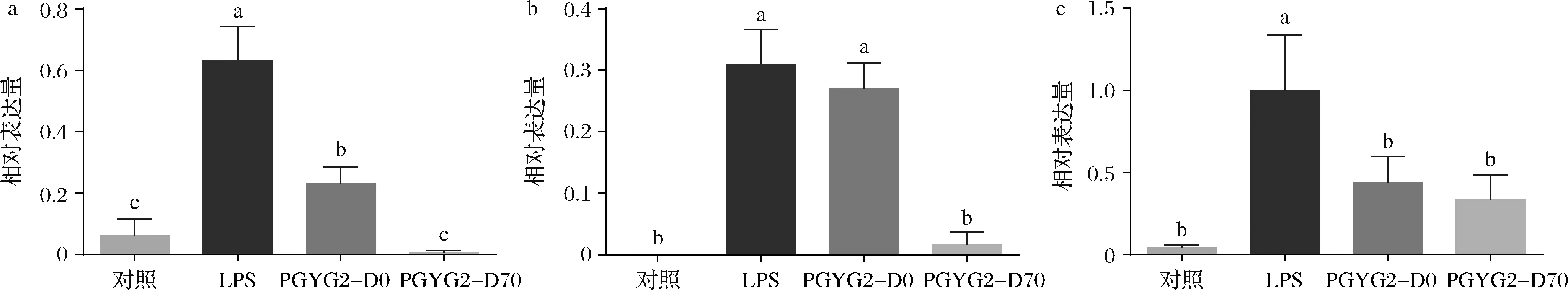
a-IL-6;b-IL-1β;c-TNF-α图3 蒲公英根不同组分对RAW264.7炎症因子转录水平的影响Fig.3 Transcription levels of inflammatory cytokines treated by different components from dandelion root
3 结论
本研究在对蒲公英根进行醇提的基础上,通过大孔吸附树脂柱分离和活性评价得到了蒲公英根的高效抗菌抗炎活性组分。最终建立的提取分离工艺为:70%乙醇回流提取后,用D101大孔吸附树脂进行柱分离,水洗脱之后的70%乙醇洗脱部位为蒲公英根的抗菌抗炎活性组分。该组分对9种人、畜禽常见病原菌具有显著的抑菌和杀菌作用,MIC和MBC分别可达1.95和31.25 mg/mL;对LPS诱导的小鼠巨噬细胞RAW264.7炎症模型的炎症因子IL-6、IL-1β和TNF-α的浓度和转录水平均有显著抑制作用。从初步的成分分析可以发现,该组分黄酮含量相对较高,这也为蒲公英根的进一步分离纯化、生物活性及其机制研究以及开发具有潜力的功能性食品、药品等提供了依据。
