Linc00941高表达通过激活TGF-β1/SMAD信号通路促进胃癌的恶性生长
2022-01-22郑桂丽王振国
董 敏,郑桂丽,王振国,仲 晨
(1.中国人民解放军联勤保障部队第960医院 肿瘤科,山东 济南 250000;2.武警特色医学中心 医研部,天津 300162)
胃癌(GC)是临床最常见的一种肿瘤,其发病率和死亡率很高,是世界上癌症死亡的第二大原因[1]。根据世界卫生组织(WHO)的报告,每年确诊的新病例超过95万例,其中约90%处于晚期,大多数患者仅在GC的晚期才被诊断出,而且即使行根治性切除术,患者仍有很高的转移风险[2]。尽管GC的临床治疗取得了一些进展,但由于GC的高复发率,其5年生存率仍低于25%[3]。因此,在GC中寻找可靠的生物标记物对于GC的早期诊断和临床治疗具有重要的意义。长非编码RNA(lncRNA)是功能性非编码RNA分子,长度超过200个核苷酸,并且没有蛋白质编码能力。LncRNA曾经被认为是基因组的“沉默物质”,但是近年来的积累研究表明,哺乳动物中存在大量的lncRNA,通过多种生物途径的表观遗传、转录和转录后水平,在调控基因表达中起着重要的作用[4]。有研究表明lncRNA在分化的组织或特定类型的癌症中独特表达,还有研究表明 lncRNA与肿瘤的发生、侵袭、转移和患者的预后相关[5]。越来越多的证据表明, lncRNA的异常表达与GC的癌变和进展密切相关,其中Linc00941被认为在胃癌、肺癌、结肠癌等组织中过表达[6-7]。然而Linc00941在胃癌中的作用机制仍有待进一步研究。
1 材料与方法
1.1 标本来源及分组 肿瘤标本来源于2016年5月至2019年5月我院手术的91例胃癌患者;纳入标准:初次诊断胃癌并于我院行手术治疗且病理诊断为胃癌者,年龄28~68岁,ASA Ⅰ或Ⅱ级,BMI 18~30 kg/m2,无心血管疾患,肝肾功能正常,未接受化疗;排除标准:合并其他肿瘤者,合并其他脏器严重病变者,不能配合临床实验者;其中高分化和中分化设为低度恶性组(LGC group,n=31),低分化设为高度恶性组(HGC group,n=60),正常对照(Control group,n=91)取癌旁距离肿瘤>5cm的正常胃黏膜组织;为评估Linc00941与患者无瘤生存的影响,根据Linc00941表达水平将患者分为Linc00941低表达组(LLGC group,n=45)和Linc00941高表达组(HLGC group,n=46)。所有患者排除合并严重脏器损害者,术前均未行化疗或放疗,术后均有完整的病理诊断。本研究获得我院伦理委员会批准(审批号:201604001),所有患者或家属均签署知情同意书。
1.2 试剂和材料 胃癌细胞系HS-746T购自上海中科院细胞库;Linc00941 Inhibitor、Linc00941-NC及RT-PCR引物由赛默飞公司合成;RNA提取试剂盒( R0036)购自碧云天生物科技(北京)有限公司,RT-qPCR试剂盒(QR0100)、MTT(TOX1)、Trizol(T9424)及去RNA酶试剂购自sigma公司;TGF-β1 (ab142139)、SMAD4(ab95455)和GAPDH(ab8245)抗体购自Abcam 公司; Tranwell小室、细胞培养板及计数板购自美国康宁公司;DMEM培养基、胎牛血清、胰酶购自Gibco公司。
1.3 细胞培养及转染 实验分为对照组(Sham group)、阴性对照组(NC group)和Linc00941抑制组(Inhibit group)。转染AAVrh.10 siRNA和AAVrh.10 Negative进入HS-746T细胞。根据细胞的密度进行换液或者传代。每次传代时,加入2.5μg/mL嘌呤霉素继续筛选稳定的细胞株。24h后将细胞一部分用于后续的RT-qPCR、Transwell等实验。
1.4 实时定量PCR 按照使用说明,使用TRIZOL试剂从肿瘤组织中获取总mRNA,按照靶基因Linc00941正向5'-ACCACTACACTCAGCCAAATAC-3',反向5'-GGCTATCAACTGTCTCCTTTAGAC-3'特异性引物的序列,使用RT-qPCR RT试剂盒分析Linc00941表达量,数据以GAPDH为内参,采用2-ΔΔCt法分析。
1.5 Western blot 分别破碎肿瘤组织和细胞提取蛋白质,蛋白分离转膜后封闭, 4°C条件下分别与一抗TGF-β1(1∶10 000)、SMAD4(1∶10 000)和GAPDH(1∶10 000)孵育过夜。洗膜后与山羊抗兔二抗(1∶2 000)在室温下孵育1 h。使用ECL试剂盒检测条带,以GAPDH为内参,使用ImageJ 1.42q软件程序分析图像。
1.6 MTT增殖试验 取对数生长期细胞悬液约100 μL ,37 ℃、5% CO2条件下,在具有完全培养基的96 孔板中培养至约2×105/孔。用20 μL 的MTT处理后,相同条件下继续培养4 h,加150 μL DMSO终止反应,用酶标仪测定各孔在490 nm 处的吸光值。
1.7 Transwell实验 利用无血清DMEM培养基重悬,取对数生长期各组细胞悬液200 μL(约1×104/mL)加入Transwell小室中,培养24 h后,结晶紫染色薄膜下层细胞后,置于显微镜下计数拍照。
2 结果
2.1 Linc00941表达水平与胃癌的关系 与正常对照组相比,高度恶性组和低度恶性组的Linc00941表达水平明显升高(P<0.001),差异均具有统计学意义,且高度恶性组的Linc00941表达水平明显高于低度恶性组(P<0.001,见图1 A);按照胃癌病理分级分3级,2级和3级Linc00941 mRNA表达水平明显高于1级(P=0.029,P<0.001),且3级组Linc00941 mRNA表达水平明显高于2级组(P<0.001,见图1B);Linc00941表达水平与胃癌病理分级正相关(r=0.602,P<0.001,见图1C)。
2.2 胃癌组织中TGF-β1、SMAD4表达水平及其与Linc00941的关系 与对照组相比,低度恶性组和高度恶性组TGF-β1、SMAD4蛋白表达水平均明显升高[低度恶性组(P<0.001),高度恶性组(P<0.001)],差异具有统计学意义,且HGC组表达水平高于LGC组(P=0.035,P<0.001)(见图2A、B)。在低度恶性组、高度恶性组和所有患者组中Linc00941 mRNA值与TGF-β1、SMAD4值均呈正相关,差异具有统计学意义(P<0.05,见表1)。
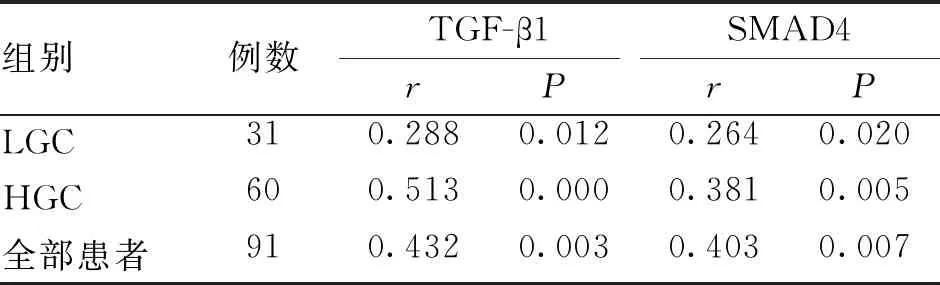
表1 Linc00941与TGF-β1/SMAD4相关性
2.3 患者临床资料 91例患者中男性46例,女性45例,平均年龄为31~72岁,中位数65岁,随访时间为27~63个月。Lauren分型:肠型54例,弥漫型37例;肿瘤浸润肌层28例,浸润浆膜及浆膜外层63例;高分化5例,中分化26例,低分化60例,51例有淋巴结转移,40例无淋巴结转移,TNM分期Ⅰ期20例、Ⅱ期33例、Ⅲ期30例、Ⅳ期8例。按照Linc00941的表达情况将患者分为低表达组(45例)和高表达组(46例),两组患者性别、年龄没有差异,具有可比性。两组患者肿瘤的Lauren分型、浸润程度比较没有差异(P>0.05);两组患者肿瘤的分化程度、淋巴转移、TNM分期之间存在明显差异,具有统计学意义(P<0.05,见表2)。

表2 胃癌组织中Linc00941表达与临床病理特征
2.4 Linc00941表达水平与总生存期的影响 根据Linc00941表达水平将胃癌患者分为Linc00941低表达组(LLGC组,n=45)和Linc00941高表达组(HLGC组,n=46), Linc00941高表达组生存率低于Linc00941低表达组,差异具有统计学意义(P=0.016,见图1)。
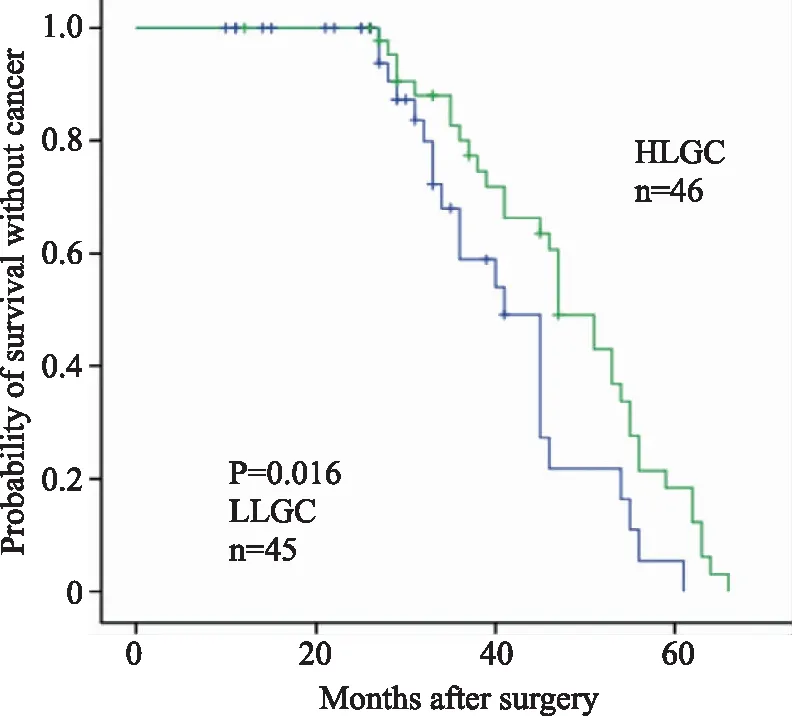
图3 Linc00941表达与胃癌患者预后生存关系
2.5 Linc00941沉默抑制HS-746T细胞增殖和侵袭 MTT实验结果显示,沉默48 h对照组与阴性对照组细胞增值率没有差异(P=0.506),Linc00941抑制组细胞增值率明显低于其他两组(P=0.002,P=0.047,见图4A)。Transwell实验结果显示,对照组(157±12)组和阴性对照组(149±18)相比穿膜细胞数没有差别(P=0.386),而Linc00941沉默阴性对照组的HS-746T穿膜细胞数(67±5)较其他两组明显降低(P<0.001,见图4B)。
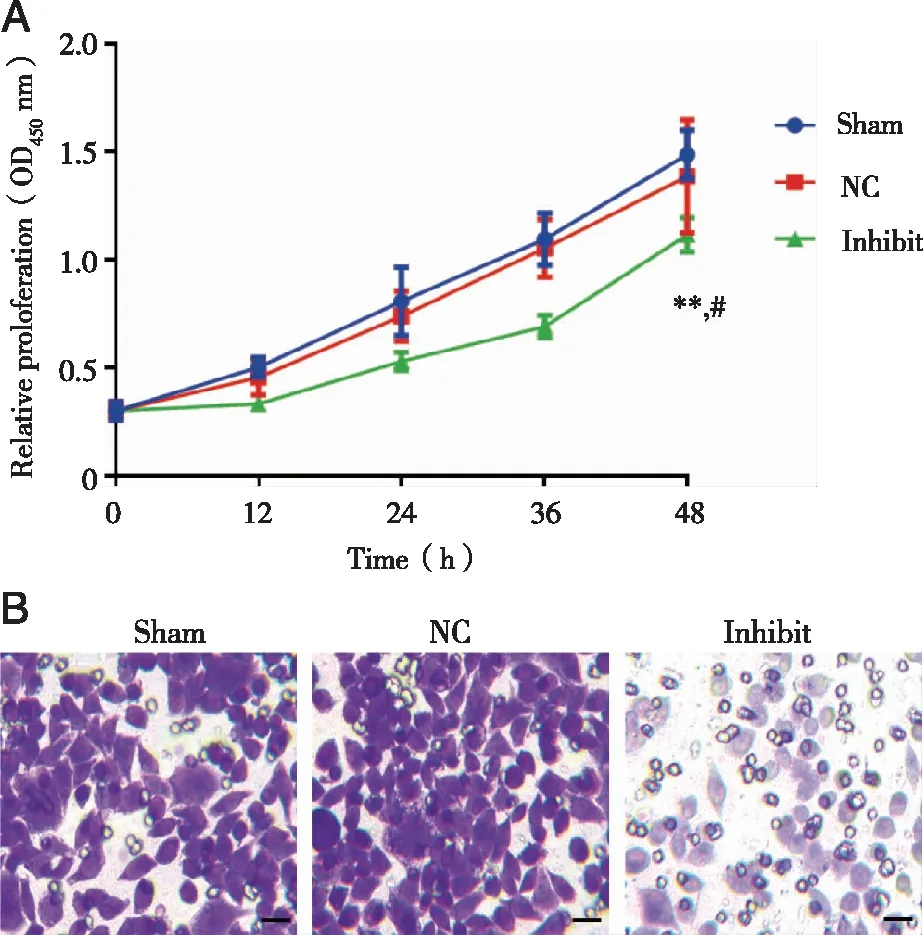
A:MTT实验各组细胞增殖率;B:Transwell实验各组细胞穿膜数,紫色标记细胞核;放大倍数均为400倍;**:与Sham组相比, P<0.01,#:与NC组相比,P<0.05。
2.6 Linc00941沉默抑制TGF-β1、SMAD4表达 与对照组相比, 阴性对照组的Linc00941 mRNA没有显著差别(P=0.566),与对照组和阴性对照组相比,Inhibit组的Linc00941 mRNA表达水平均明显下降(P<0.001,见图 5A)。与 Linc00941抑制组相比,阴性对照组的TGF-β1、SMAD4蛋白表达没有显著差别(P=0.937,P=0.818),与对照组和阴性对照组相比, Linc00941抑制组TGF-β1、SMAD4蛋白表达水平均明显下降[TGF-β1(P=0.017,P=0.049),SMAD4(P=0.015,P=0.012)](见图 5B、C)。
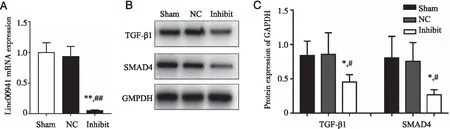
*:与Sham组相比, P<0.05; **:与Sham组相比,P<0.01;#:与NC组相比,P<0.05;##:与NC组相比,P<0.01。
3 讨论
LncRNA是当前非编码RNA研究热点,几乎参与所有的表观遗传调控,约占人类全部基因的98%[4]。越来越多的证据表明,LncRNA在各种人类疾病和癌症中起着至关重要的作用[8]。胃癌作为高发病率和高死亡率的肿瘤类型之一,寻找新的可靠的生物标志物对其诊断和治疗具有重要意义。有研究发现Linc00941被认为是肺腺癌、结肠癌、甲状腺癌的候选生物标志物[6-7,9]。Bhan等[8]在Cancer RNA-Seq Nexus数据库中发现Linc00941的表达水平在胃癌组织的大多数阶段也显著上调。Luo等[10]通过qRT-PCR确认胃癌与正常胃组织中Linc00941的差异表达。然而仍不清楚Linc00941在胃癌组织中差异表达的机制,为此,本研究结合相关文献展开进一步的探索。
LncRNA通常以RNA-蛋白质相互作用影响基因表达[11]。因此,本研究深入研究可与LINC00941相互作用的蛋白。TGF-β1/SMAD信号通路是EMT的关键调节因子,SMAD4是重要的辅因子,可与活化的SMAD2和SMAD3结合形成调节目标基因转录的寡聚复合物[12-13]。鉴于LINC00941对于SMAD4稳定性很重要,并且LINC00941包含预测的TGF-β1靶向位点(http://www.gene-regulation.com/index2.html),本研究评估了LINC00941在TGF-β1/ SMAD信号通路中的作用。既往的研究表明,EMT与肿瘤转移有关,lncRNAs可以通过影响EMT来调节癌症转移[14-16]。而在肝细胞癌中Linc00941的高表达可显著促进EMT和组织的恶性生长,并且激活TGF-β1相关的信号通路[17]。考虑到EMT对胃癌的恶性进展具有促进作用,本研究分析91例患者胃癌组织与正常胃组织的Linc00941表达水平,以及EMT相关的TGF-β1、SMAD蛋白表达情况。结果表明,胃癌组织的Linc00941表达水平较正常胃组织明显升高,且与肿瘤的恶性度呈正相关,胃癌组织中EMT相关的TGF-β1、SMAD4表达水平均明显升高,与肿瘤的恶性度呈正相关。按照Linc00941表达水平将91例胃癌患者分为Linc00941高表达组(HLGC组)和Linc00941低表达组(LLGC组),根据随访结果发现,HLGC组的预后生存低于LLGC组。此外,本研究还发现Linc00941表达水平与TGF-β1、SMAD4表达水平正相关。
为进一步揭示胃癌细胞中Linc00941对EMT的生物学功能,本研究采用胃癌细胞系HS-746T进行体外实验。结果发现,沉默Linc00941后TGF-β1、SMAD4蛋白表达水平明显下调,MTT和Transwell实验表明HS-746T细胞的增殖和侵袭能力下降。我们的结果进一步证实,LINC00941可以直接结合SMAD4,SMAD4是转移的关键因素,也是TGF-β诱导的EMT不可或缺的效应子[18]。在BC裸鼠模型中,SMAD4沉默显着减弱骨转移并延长生存期[19]。此外,SMAD4可以与SMAD3相互作用,与SNAIL-1形成复合物,该复合物在TGF-β诱导的EMT期间充当BC中Ecadherin启动子的核心抑制剂[20]。这些研究结果表明,LINC00941可能通过影响EMT调控胃癌细胞的增殖和侵袭。然而本研究仍然存在一些局限性,Linc00941对胃癌作用的具体生物学机制仍然需要进一步研究。
总之,通过上述研究发现Linc00941在胃癌中起着重要的致癌作用, TGF-β1/SMAD信号通路的EMT作用可能是Linc00941的作用途径之一。
