微小RNA-146b-5p对甲状腺乳头状癌细胞迁移和侵袭的影响
2022-01-21樊玉霞袁青岭卢秀波
刘 洋,樊玉霞,刘 征,袁青岭,卢秀波
(郑州大学第一附属医院甲状腺外科,河南 郑州 450052)
微小RNA(microRNA,miR)是一类长约22个寡核苷酸的非编码小RNA,通过转录后调控机制参与靶基因的调控[1]。课题组前期研究[2]显示在甲状腺乳头状癌的miR差异表达谱中,miR-146b-5p的表达升高最为显著,本研究旨在探讨miR-146b-5p对甲状腺乳头状癌细胞迁移和侵袭的影响。
1 材料与方法
1.1 细胞及主要试剂人甲状腺乳头状癌TPC-1细胞由本实验室保存;质量分数0.5%胰蛋白酶购自美国Amresco公司;DNA连接酶购自日本Takara 公司;CCK-8试剂盒购自日本同仁公司;胎牛血清购自美国GIBCO公司;Lipofectamine TM 2000转染试剂购自美国invitrogen公司;PCR引物合成由华大基因完成;过表达miR-146b-5p的慢病毒质粒购自生工生物工程(上海)股份有限公司。
1.2 细胞培养细胞冻存管放入37 ℃水浴锅中融化,将细胞悬液转移至15 mL离心管中,加入含体积分数10%胎牛血清的培养基,离心。加入1 mL培养基混匀后转移至培养瓶。对培养的TPC-1细胞进行传代。离心管中加入5滴细胞悬液,再加入5滴台盼蓝染液,混合均匀。吸出少量单细胞悬液滴到准备好的计数板一侧边缘,把细胞计数板移显微镜下计数。
1.3 构建载体建立稳定转染细胞系检测最佳感染复数(multiplicity of infection,MOI):将病毒原液稀释10倍、100倍,将3种不同浓度的病毒液置于3个孔内,加入目的细胞。荧光显微镜下观察3组细胞绿色荧光蛋白(green fluorescent protein,简称GFP)的表达。利用流式细胞仪测定荧光细胞的阳性表达率。确定最佳感染复数及感染条件。用过表达miR-146b-5p的慢病毒质粒和包含空载体的慢病毒质粒分别感染TPC-1细胞96 h,倒置相荧光显微镜下观察2组细胞的GFP表达率。
1.4 PCR检测目的基因提取总RNA,按照逆转录试剂盒说明书操作合成cDNA。合成引物序列hsa-miR-146b-5p:上游CAACCTTGAGAACTGAATTCCATA,下游AAAGGTTGATCTCGTCTCTCTGTC。U6引物:上游 ATTGGAACGATACAGAGAAGATT,下游 GGAACGCTTCACGAATTTG。RT-PCR反应条件为预变性温度95 ℃、1 min,变性温度95 ℃、15 s,60 ℃、20 s,72 ℃、45 s,共40个循环。导出Ct值,采用2-△△Ct表法对数据进行分析。
1.5 划痕实验将细胞分为3组:稳定转染miR-146b-5p的TPC-1细胞(转染组);转染空载体的TPC-1细胞(空载组);未经转染的TPC-1细胞(对照组)。取3个6孔培养板,用记号笔在其背侧均匀划横线,横穿过孔。用胰蛋白酶分别消化3组细胞成单细胞悬液,在每个孔中加入5×105个细胞,过夜。用枪头在培养板上划痕,37 ℃、体积分数5% CO2条件培养箱中培养。在0、48 h分别取样照像。应用软件Image J分析宽度变化。划痕愈合率=(划痕0 h间距-划痕48 h间距)/划痕0 h间距×100%。实验重复3次。
1.6 Transwell小室侵袭实验预冷后将Matrigel基胶稀释,加入到Transwell小室的上室,室温下水化,风干。磷酸盐缓冲液洗涤细胞,加入胰酶消化,离心5 min,磷酸盐缓冲液洗涤3次,吸管吹打。在计数板凹槽处加入细胞悬液显微镜10倍物镜下,计数位于四角大方格内的细胞数,细胞计数计左不计右计上不计下(若观察到细胞聚集成团时,只按照一个细胞计算),细胞密度=细胞悬液的细胞数/毫升原液=(四大格内细胞总数/4)×104。调整细胞浓度为2×105个/mL,小室的上室加入150 μg,下室加入600 μg,每组均设置3个复孔。放入37 ℃恒温孵育箱中。观察Transwell小室细胞情况,培养24、48 h按照分组分别取出小室,用质量分数0.1%结晶紫染色,400倍显微镜下随机采取5个视野统计细胞数,取平均值。实验重复3次。
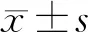
2 结果
2.1 慢病毒载体感染TPC-1细胞的最佳MOI细胞培养48 h,GFP表达强度随着转染TPC-1细胞MOI的增加而增强,当MOI=1、10、100时,miR-146b-5p转染阳性率分别为0.6%、13.1%、78.1%,且3组TPC-1细胞均未见大量异常死亡现象,说明本实验最佳MOI为100。见图1。
2.2 转染效率实验组TPC-1细胞转染效率为0.863±0.022,空载组为0.840±0.017,差异无统计学意义(t=0.779,P=0.438)。见图2。
2.3 miRNA-146b-5p表达转染组TPC-1细胞miR-146b-5p的表达水平为133.949±24.262,空载组为0.901±0.154,对照组为1.047±0.335,总体比较差异有统计学意义(F=90.097,P<0.001)。转染组明显高于空载组和对照组(P均<0.05)。
2.4 细胞划痕试验结果划痕实验48 h,转染组划痕愈合率为65.9%,空载组为29.3%对照组为30.2%,总体比较差异有统计学意义(χ2=36.562,P<0.001)。转染组与空载组和对照组比较差异均有统计学意义(χ2=25.962,P<0.001;χ2=27.449,P<0.001)。见图3。
2.5 Transwell小室侵染实验结果Transwell小室侵染实验显示,转染组48 h后穿膜细胞数为149.667±2.517,空载组为37.667±5.131,对照组为32.667±1.528个,总体比较差异有统计学意义(F=1 125.343,P<0.001)。转染组与空载组和对照组比较差异均有统计学意义(P均<0.05)。见图4。

图1 不同MOI时TPC-1细胞GFP表达情况

图2 转染组和空载组TPC-1细胞转染效率(×100)
A和B为转染组,C和D为空载组,A和C为倒置荧光显微镜,B和D为普通光学显微镜
3 讨论
甲状腺乳头状癌是近年来发病率增长最快的肿瘤,在城市人群中发病率位居第4位。尽管其恶性程度较低,但在2014年国家癌症中心的数据中,我国甲状腺癌平均5 a生存率仅67.5%,局部浸润和远处转移是影响肿瘤患者预后的主要原因,因此对甲状腺乳头状癌侵袭转移的研究已经成为热点[3-4]。
MiR在多种恶性肿瘤的发生、发展起着重要作用[5-6]。人类的miR-146b-5p位于染色体10q24~26区段上,在正常的肺脏、脾脏和胸腺组织中均有表达,有关miR-146b-5p的报道较少,早期的研究多集中在同源的miR-146b上。MiR是通过序列定向的克隆技术结合生物学技术发现的,是最早发现具有自主转录功能的小RNA,是炎症信号通路中重要的节拍器,肿瘤发生的控制器。MiR在不同的肿瘤中起着不同的作用,在乳腺癌[7]、胰腺癌[8]、前列腺癌[9]、恶性黑色素瘤[10]等恶性肿瘤细胞中的表达水平下降,起着抑癌基因的作用;但在弥漫大B细胞淋巴瘤[11]、肾癌[12]中呈高表达,起着癌基因的作用。课题组前期研究[2]发现在甲状腺乳头状癌20个差异性表达的miR中,miR-146b-5p的差异最为显著,且与甲状腺乳头状癌临床分期呈正相关,因此推断miR-146b-5p在甲状腺乳头状癌中起着癌基因作用,且可以促进甲状腺乳头状癌的发展。有研究[13]发现存在淋巴结转移的甲状腺乳头状癌中miR-146b-5p的表达明显升高,这说明了miR-146b-5p可能促进甲状腺乳头状癌的转移。另有研究[14]通过抑制TPC-1细胞中miR-146b-5p的表达,发现TPC-1细胞的侵袭和迁移能力明显降低。
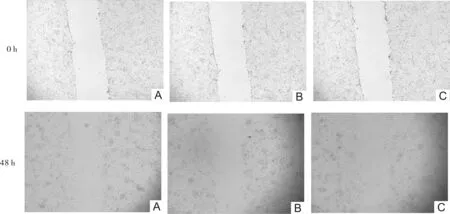
图3 转染组(A)、空载组(B)、对照组(C)TCP-1细胞划痕试验结果(×100)

图4 转染组(A)、空载组(B)、对照组(C)TCP-1细胞Transwell小室侵染实验48 h后结果(×100)
本研究利用稳定转染技术得到了miR-146b-5p稳定过表达TPC-1细胞,进一步采用划痕实验和Transwell小室侵袭实验分别观察转染组、空载组和对照组TPC-1细胞迁移数量和进入下室的细胞数,结果显示,转染组细胞的迁移和侵袭能力明显增强。这表明甲状腺乳头状癌细胞中miR-146b-5p的过表达可以导致肿瘤细胞迁移和侵袭能力的增强,从而引起肿瘤的局部侵犯和远处转移。由此推测抑制miR-146b-5p的表达可以使甲状腺乳头状癌细胞的迁移和侵袭能力减弱,从而降低肿瘤的局部浸润和远处转移风险。
综上所述,miR-146b-5p的过表达可以促进甲状腺乳头状癌细胞的侵袭和迁移,这揭示了甲状腺乳头状癌发展的部分机制,miR-146b-5p有望成为甲状腺乳头状癌基因治疗的新靶点。
