4,4’-二氨基二苯基甲烷对浮萍(Lemna minor L.)毒性作用
2022-01-20柳燕贞罗凤娟梁燕珍梅承芳曾国驱
柳燕贞,罗凤娟,梁燕珍,梅承芳,曾国驱,*
1. 广东省科学院微生物研究所,广东省微生物分析检测中心,广州 510070 2. 华南应用微生物国家重点实验室,广州 510070 3. 广东省菌种保藏与应用重点实验室,广州 510070 4. 广东省微生物应用新技术公共实验室,广州 510070
4,4’-二氨基二苯基甲烷(4,4’-methylenedianiline, MDA;CAS-No. 101-77-9)是一种重要的化工中间体,是合成聚氨基甲酸酯、二异氰酸酯和还氧树脂硬化剂等的重要原料。近年来,MDA的使用范围正在扩大,年产量逐年增加,达400万t·a-1[1]。MDA是欧盟REACH法规中的高关注物质之一,其对生态环境及人类健康的潜在危害越来越受到重视[2-4]。当释放到环境中时,MDA首先分配到水体中,使地表水受到污染,随后再分配到沉积物和土壤隔室中。我们的前期实验和他人的研究结果表明,MDA并不具有生物蓄积性,但土壤孔隙中的MDA能够迅速吸附在植物根部表面,从而对水生生物产生毒害作用[5-6]。
浮萍(LemnaminorL.)属于浮萍科,广泛分布于各种水体中,能够灵敏地反映水体污染状况。利用浮萍的生物学特性将其应用于生态环境修复,取得了显著的成果[7-9]。然而有关MDA对浮萍的毒性作用尚未见报道。本研究以浮萍(LemnaminorL.)作为受试生物,通过检测不同浓度的MDA对浮萍生长、叶绿素含量、光合活性、质膜透性和抗氧化酶活性等的影响,初步探讨MDA对浮萍的毒性作用,以期为MDA的水生态风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:高效液相色谱仪(Agilent 1260,美国),电子天平(XS205DU型,梅特勒-托利多公司,瑞士),紫外可见分光光度计(T6型,北京普析通用仪器有限责任公司,中国),多用途台式高速离心机(Primo R,Thermo Fisher Scientific,美国),人工气候箱(PQX-450B-22H,宁波莱福科技有限公司,中国),手提式pH测试仪(pH 3210,WTW公司,德国),温湿度记录仪(DSR系列,杭州佐格通讯设备有限公司,中国),植物效率分析仪(Handy PEA,Hansatech Instrument Ltd.,英国),便携式多量程电导仪(HI 8733,HACH公司,美国)。
试剂:4,4’-二氨基二苯基甲烷为分析纯,购自美国Sigma公司。其他试剂均为国产分析纯,购自中国广州化学试剂厂。
1.2 受试生物
本次试验选择浮萍(LemnaminorL.)为受试生物。试验植株从广州珠江获得,采集自野外,采集地无明显污染。试验开始前植株已在试验用培养基中培养8周以上。试验开始前7 d,从贮备培养的浮萍中选择足量的浮萍转入新鲜无菌Swedish Standard (SIS)培养基中,并在试验条件下培养7 d。
1.3 MDA对浮萍生长的影响
本试验按照经济合作与发展组织(OECD)化学品测试准则中的浮萍急性毒性试验方法(OECD 221)进行[10]。根据预试验的结果设置6个MDA浓度梯度,各试验浓度间隔系数为3.0,即0(空白对照)、0.6、1.8、5.4、16.2和48.6 mg·L-1。根据MDA在试验体系中的稳定性,选择了半静态的试验方式,每48 h更换一次MDA试验溶液,分别在0、48、96、144和168 h时测定新旧溶液的MDA浓度。取扩大培养后叶片完好、大小相近的3株3叶浮萍,采用灭菌SIS培养基对浮萍漂洗3遍,随机放入装有灭菌SIS培养基的200 mL培养瓶中,每个浓度设置3个重复。将所有培养瓶置于人工气候箱中培养,培养温度为(24±2) ℃,连续供光(光照度在85~135 μE·m-2·s-1)。试验期间,每天随机调整试验瓶的摆放位置,以减少由于光照不同导致的植物生长差异。
1.4 浮萍生长参数及各项生理指标的测定
试验期间MDA浓度采用Agilent 1260高效液相色谱仪进行测定(色谱柱:BDS HYPERSIL C18,100 mm×2.1 mm,2.4 μm),柱温40 ℃;流动相10 mmol·L-1磷酸二氢钠-乙腈(V∶V=55∶45),流速0.5 mL·min-1;进样量2.0 μL;检测器DAD;检测波长210 nm)。浮萍的生长参数包括浮萍的形态变化、叶状体数量、相对生长率、干质量和叶面积的测定。各项生理指标包括叶绿素含量、光系统Ⅱ(PSⅡ)最大光化学效应(Fv/Fm)、质膜透性、超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的测定。浮萍干质量采用60 ℃烘干恒重法(前后2次质量相差≤0.4 mg)进行测定。浮萍叶面积采用软件Image J将影像数字化以得到浮萍的叶面积。
1.5 叶绿素含量的测定
叶绿素含量的测定采用丙酮提取法[11]。
1.6 叶绿素荧光参数测定
将浮萍进行暗适应30 min,采用植物效率分析仪测定荧光参数。打开调制测量光,测定最小荧光(F0),然后打开饱和脉冲,测定最大荧光(Fm),根据公式Fv/Fm=(Fm-F0)/Fm计算PSⅡ最大光化学效率(Fv/Fm)。
1.7 质膜透性测定
采用电导率法测定浮萍质膜透性[12]。
1.8 SOD、CAT和POD活性测定方法
SOD活性的测定采用氯化硝基四氮唑蓝(NBT)法[13],POD活性的测定采用愈创木酚法[13],CAT活性的测定采用紫外吸收法[14]。
1.9 数据处理
应用软件GraphPad Prism 5.0进行统计学分析,采用单因素方差分析(ANPVA)方法进行各试验组与对照组的显著性差异检验。P<0.05表示有统计学差异。
2 结果(Results)
2.1 MDA对浮萍生长的影响
MDA对浮萍的急性毒性试验结果如图1所示,MDA对浮萍叶片数、叶片生长率、叶片干质量和叶面积均有显著的抑制作用,且抑制程度与MDA的浓度呈正相关。MDA对浮萍叶片生长抑制的7 d半数效应浓度(7 d-EC50)为26.7 mg·L-1,其95%置信限为22.3~32.1 mg·L-1,基于叶片产量抑制的7 d-EC50为0.62 mg·L-1,其95%置信限为0.53~0.74 mg·L-1。基于总叶面积及干质量产量抑制的7 d-EC50均<0.6 mg·L-1。
2.2 MDA对浮萍叶绿素含量及光合活性的影响
植物叶片光合作用产物的积累很大程度上依赖叶绿素的含量。不同浓度MDA处理7 d后,发现浮萍叶绿素含量变化趋势与浮萍叶片干质量的趋势一致,随着MDA浓度的增加,浮萍总叶绿素含量逐渐下降(图2)。叶绿素荧光技术是一种灵敏的探针,可用于检测逆境胁迫对植物的危害程度[15]。PSⅡ最大光化学效率(Fv/Fm)是叶绿素荧光动力学中重要且敏感的荧光参数[16]。采用便捷的植物效率分析仪检测MDA处理对浮萍Fv/Fm的影响。结果如图3所示,随着MDA浓度的增加,Fv/Fm逐渐降低。0.6、1.8、5.4、16.2和48.6 mg·L-1MDA处理的浮萍叶片Fv/Fm值分别是对照组的95.8%、93.5%、87.2%、81.9%和75.2%。
2.3 MDA对浮萍质膜透性的影响
采用不同浓度的MDA处理浮萍7 d,发现MDA能够增加浮萍质膜透性,0.6、1.8、5.4、16.2和48.6 mg·L-1MDA处理的质膜透性分别是对照组的1.26倍、1.44倍、1.79倍、2.19倍和2.82倍(图4(a)),说明MDA对浮萍质膜具有明显的慢性毒性作用。为进一步研究MDA是否对浮萍质膜具有直接毒性作用,将健康植物分别移入含有0.6、1.8、5.4、16.2和48.6 mg·L-1MDA的培养基中,并抽真空10 min以使MDA渗透到植物中,蒸馏水冲洗后,立即用电导仪测定整个植物的质膜渗透率。结果表明,直接毒性实验中测得的质膜透性与慢性毒性实验获得的结果相似(图4(b)),这表明MDA可以直接损伤细胞膜。
2.4 MDA对浮萍抗氧化酶活性的影响
MDA对浮萍SOD活性的影响如图5(a)所示,低浓度MDA处理7 d,浮萍的SOD活性无明显变化。当MDA浓度达到5.4 mg·L-1时,浮萍SOD活性显著增加。MDA对浮萍POD活性的影响如图5(b)所示,MDA浓度依赖地促进浮萍POD的活性。然而,当MDA浓度达到48.6 mg·L-1时,POD的活性显著降低。MDA对浮萍CAT活性的影响如图5(c)所示,低浓度MDA(0.6 mg·L-1)处理,浮萍的CAT活性无明显变化,随着浓度的增加,浮萍CAT活性逐渐上升,当MDA浓度达到16.2 mg·L-1时,浮萍CAT活性达到最高。
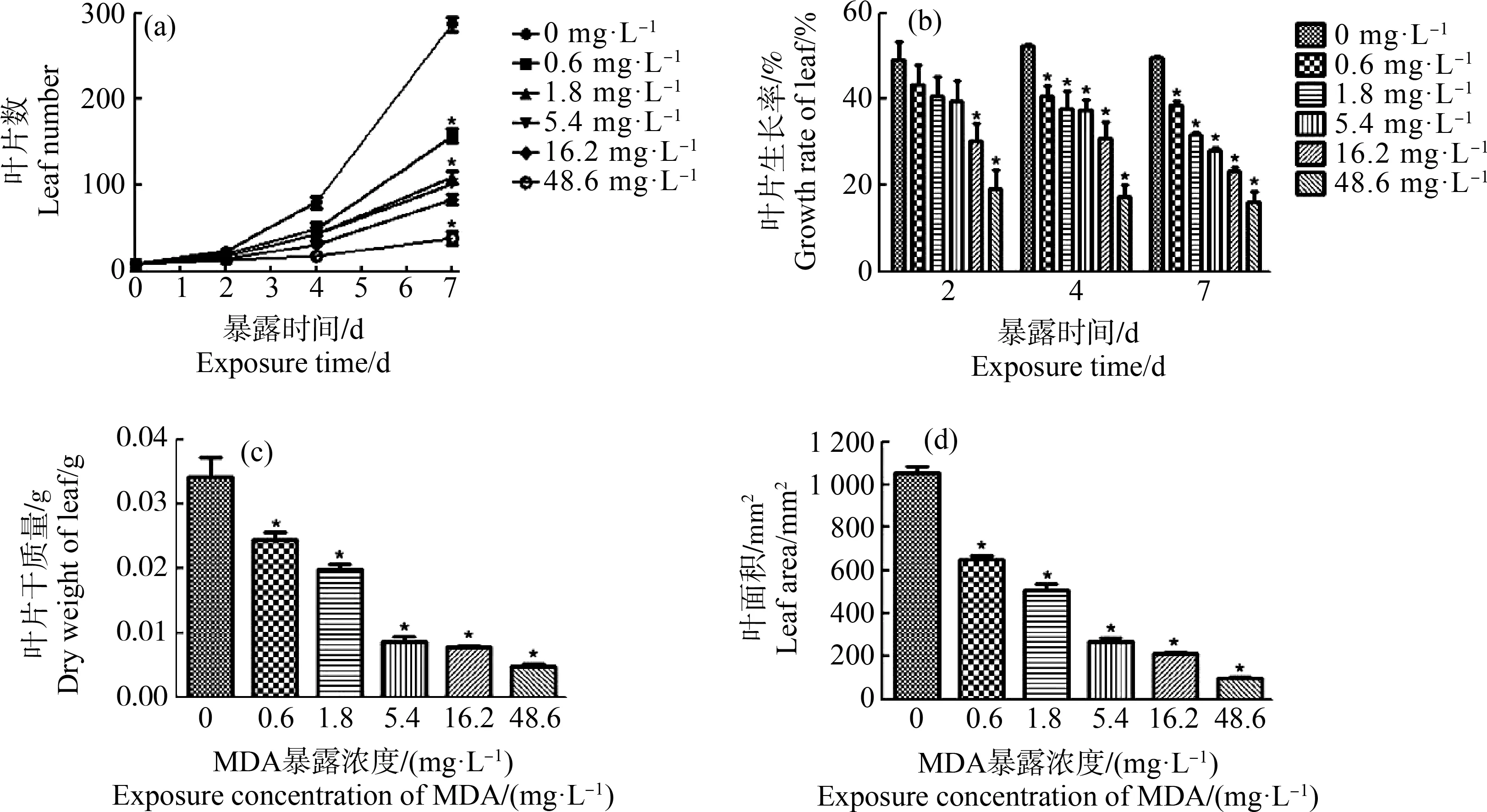
图1 4,4’-二氨基二苯基甲烷(MDA)对浮萍生长的影响注:(a)MDA对浮萍叶片数的抑制作用;(b)MDA对浮萍叶片生长率的抑制作用;(c)MDA对浮萍叶片干质量 的抑制作用;(d)MDA对浮萍叶面积的抑制作用(*P<0.05)。Fig. 1 The effects of 4,4’-methylenedianiline (MDA) on growth of L. minorNote:(a) Inhibitory effect of MDA on leaf number; (b) Inhibitory effect of MDA on leaf growth rate; (c) Inhibitory effect of MDA on leaf dry weigh; (d) Inhibitory effect of MDA on leaf area (*P<0.05).
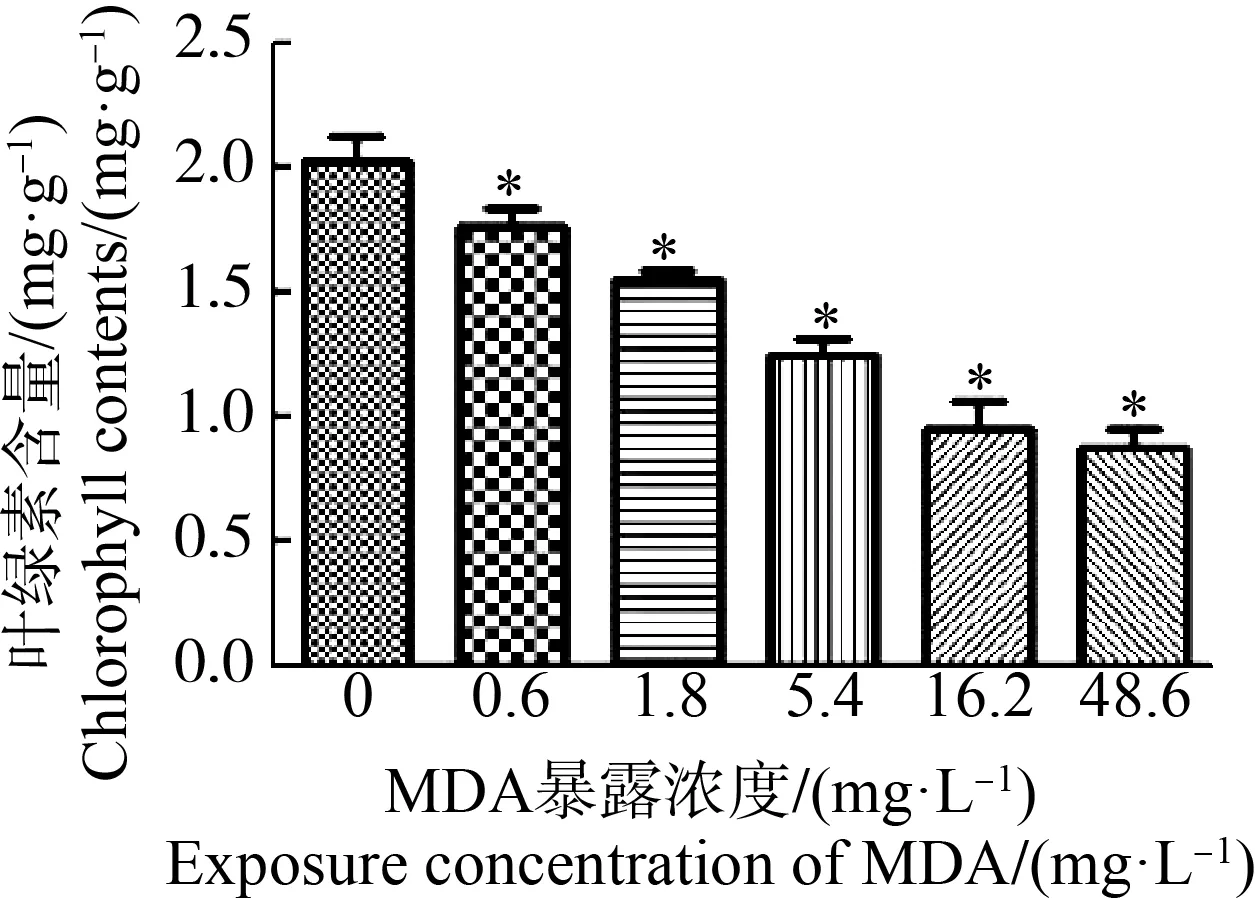
图2 MDA对浮萍叶绿素含量的影响(* P<0.05)Fig. 2 The effects of MDA on chlorophyll contents of L. minor (*P<0.05)
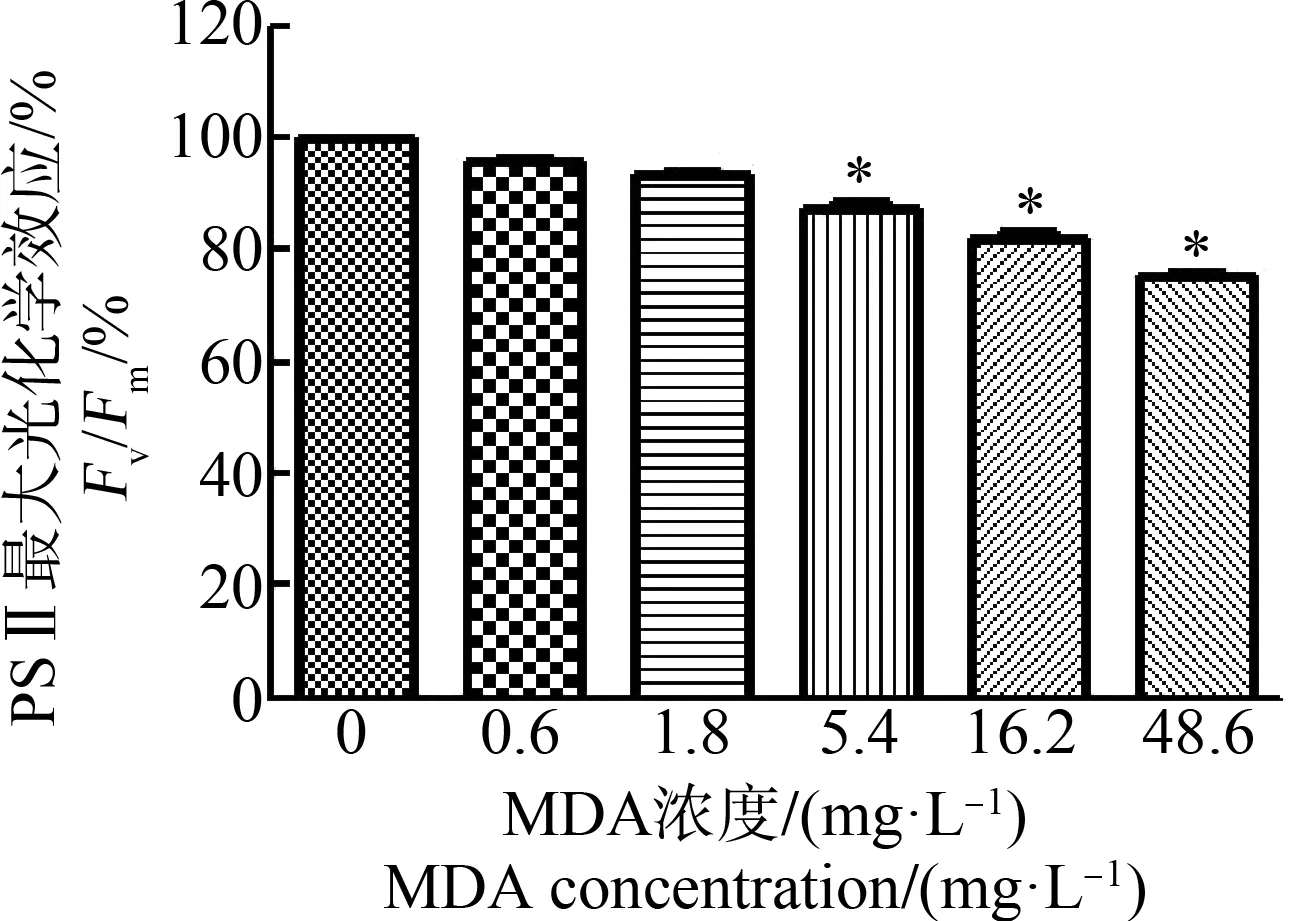
图3 MDA对浮萍PSⅡ最大光化学效率(Fv/Fm) 的影响(*P<0.05)Fig. 3 The effects of MDA on the maximal photochemical efficiency of PSⅡ (Fv/Fm) of L. minor (*P<0.05)
3 讨论(Discussion)
生长抑制是有害物质检测的重要指标。本研究结果表明,虽然由MDA导致的浮萍死亡率不是很明显,但是它对浮萍的叶状体数量、叶片数生长率、叶片干质量和叶面积都有显著的抑制,说明MDA对浮萍生长具有显著性的抑制作用,且呈现剂量效应关系。
叶绿素是植物进行光合作用的主要色素,其含量高低能够反映植物光合作用水平,体现了植株的生长势和抗逆性。叶绿素含量低,光合作用受到抑制使得植物不能正常新陈代谢,进而导致植物鲜重降低[17]。我们发现随着MDA处理浓度的升高,浮萍总叶绿素含量逐渐下降,结果与浮萍叶片干质量的变化趋势一致。Fv/Fm是叶绿素荧光动力学中重要且敏感的荧光参数,可较准确反映植物光合机构的状态,常用于评估光化学反应对环境胁迫的响应[16]。我们发现随MDA处理浓度的升高,Fv/Fm逐渐降低,进一步证实MDA胁迫能够抑制浮萍光合活性。
植物体细胞在正常代谢过程中会产生活性氧(reactive oxygen species, ROS),ROS会对植物细胞的脂类、蛋白质和DNA等产生氧化损伤。植物细胞内存在相应的抗氧化酶系统,如SOD、POD和CAT等能有效地清除ROS,从而维持ROS动态平衡[18]。研究表明,植物的逆境条件会加剧ROS的产生和积累,当环境胁迫引起的ROS增加超出ROS清除系统的能力时,动态平衡就会被打破,引起膜脂质过氧化使得植物细胞结构和功能受到损伤,从而抑制植物生长[19-20]。我们发现低浓度MDA胁迫下,浮萍SOD、POD和CAT酶活性与对照组相近,说明此处理浓度所造成的胁迫尚未超出浮萍细胞内正常的ROS条件范围。但是低浓度MDA胁迫依然能够抑制浮萍叶绿素合成及光合活性,提示MDA可能通过其他的方式对浮萍产生毒性作用。通过测定浮萍质膜透性,我们发现MDA对浮萍质膜具有直接毒性作用,导致质膜透性增加,这可能是低浓度MDA处理导致光合活性降低的主要原因之一。与我们的研究结果相似,Kreslavski等[21]研究发现,多环芳烃(PAHs)对植物的毒性也与其对脂质双层膜的破坏有关。随着MDA浓度的进一步升高,浮萍SOD、CAT和POD酶活性增加,说明MDA处理导致浮萍氧化应激反应,以避免ROS对细胞的进一步损伤。当MDA浓度的达到48.6 mg·L-1时,POD活性显著降低,POD活性降低通常是植物受到严重氧化损伤的标志,说明此MDA浓度对浮萍产生了不可修复的伤害。综上所述,我们认为MDA能够直接损伤质膜,干扰叶绿体功能并抑制光合活性,而氧化损伤是质膜损伤引起的继发性应激,继而引起膜脂质过氧化加剧,质膜损伤,从而进一步抑制浮萍的生长。
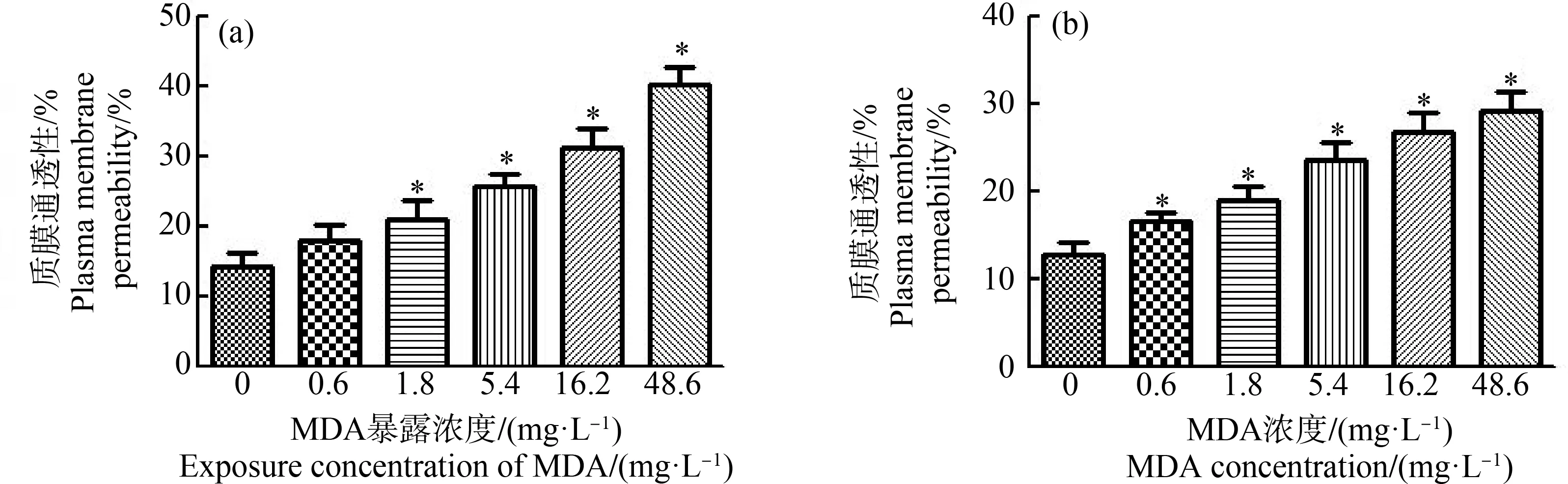
图4 MDA对浮萍质膜透性的影响注:(a)慢性影响;(b)直接影响;*P<0.05。Fig. 4 The effects of MDA on plasma membrane permeability of L. minorNote: (a) chronic effect; (b) direct effect; *P<0.05.
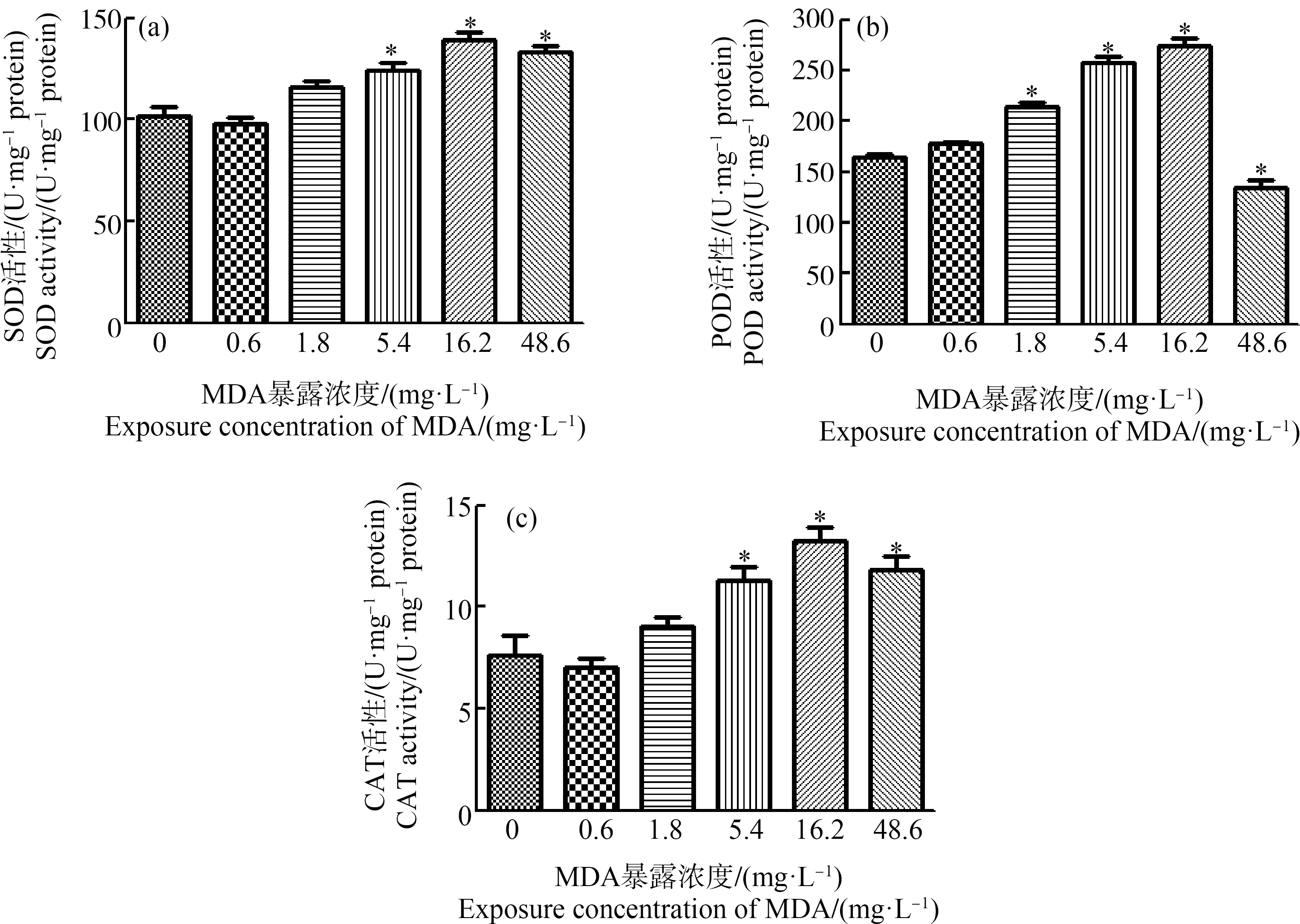
图5 MDA对浮萍抗氧化酶活性的影响注:(a)MDA对浮萍超氧化物歧化酶(SOD)酶活性的影响;(b)MDA对浮萍过氧化物酶(POD)酶活性的影响; (c)MDA对浮萍过氧化氢酶(CAT)酶活性的影响;*P<0.05。Fig. 5 The effects of MDA on antioxidant enzyme activity of L. minorNote: (a) The effects of MDA on superoxide dismutase (SOD) activity; (b) The effects of MDA on peroxidase (POD) activity; (c) The effects of MDA on catalase (CAT) activity; *P<0.05.
