非小细胞肺癌免疫联合及新兴免疫靶点的研究
2022-01-20张浩宇李文新胡志刚宋新宇
张浩宇 李文新 胡志刚 宋新宇
肺癌仍然是世界范围内癌症死亡的主要原因,预后不良。非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌总数的85%~90%,NSCLC一般分为鳞癌、腺癌、大细胞癌3种类型,其治疗方法和预后往往相似,晚期NSCLC的5年总生存率(overall survival, OS)约为13%[1]。随着免疫时代的到来,为NSCLC的治疗带来了重大突破,多项研究显示免疫联合治疗为各种类型的晚期NSCLC患者可带来显著的临床疗效[2],为晚期NSCLC患者生存率提高带来新的转机。近年来,以程序性死亡受体1(programmed death 1, PD-1)、程序性死亡配体-L1(programmed death ligand-1, PD-L1)和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)抑制剂为主的检查点抑制剂是晚期NSCLC治疗的研究热点。2016年美国食药品监督管理局(Food and Drug Administration, FDA)先后批准了PD-1/PD-L1抑制剂单药或联合用于晚期NSCLC患者一线或二线以上治疗[3, 4],成为癌症治疗的另一种选择。此外,其他新型免疫检查点抑制剂也掀起了一股热潮,如淋巴细胞活化基因3(lymphocyte activation gene-3, LAG-3)、T细胞免疫球蛋白和ITIM结构域(T cell immunoglobulin and ITIM domain,TIGIT)、T细胞免疫球蛋白粘蛋白分子-3(T cell immunoglobulin and mucin-domain containing-3,TIM-3)、B和T淋巴细胞衰减因子(B and T cell lymphocyte attenuator,BTLA)等所带来的应用前景。基于晚期NSCLC转移患者和标准治疗后耐药的患者无有效治疗方案的现状,近年来逐步开展了广泛的临床试验和研究,以探索免疫治疗的疗效。因此,本文综述了PD-1/L1/CTLA-4抑制剂联合治疗及新兴免疫靶点的临床研究进展,包括NSCLC的靶向治疗、化疗、放疗和其他免疫治疗等,并以(表1)总结了免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)联合治疗用于晚期NSCLC患者的主要临床试验数据及(表2)阐明了目前最有希望的新兴ICIs 联合PD-1/PD-L1/CTLA-4 ICIs在晚期NSCLC中的Ⅰ/Ⅱ期研究。以帮助临床医生进行更好的选择。
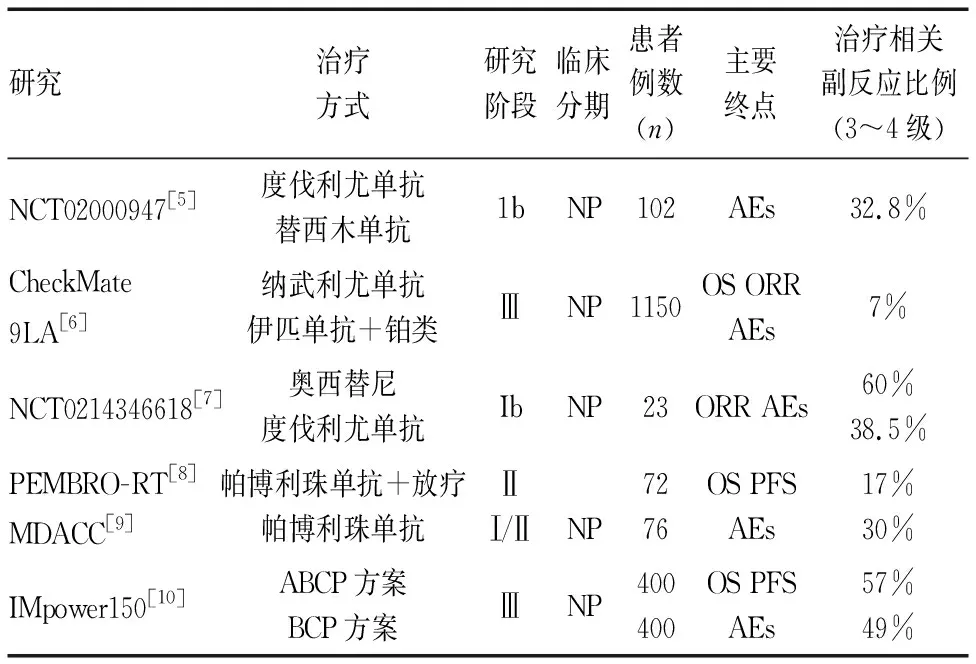
表1 免疫联合治疗用于非小细胞肺癌的临床试验数据
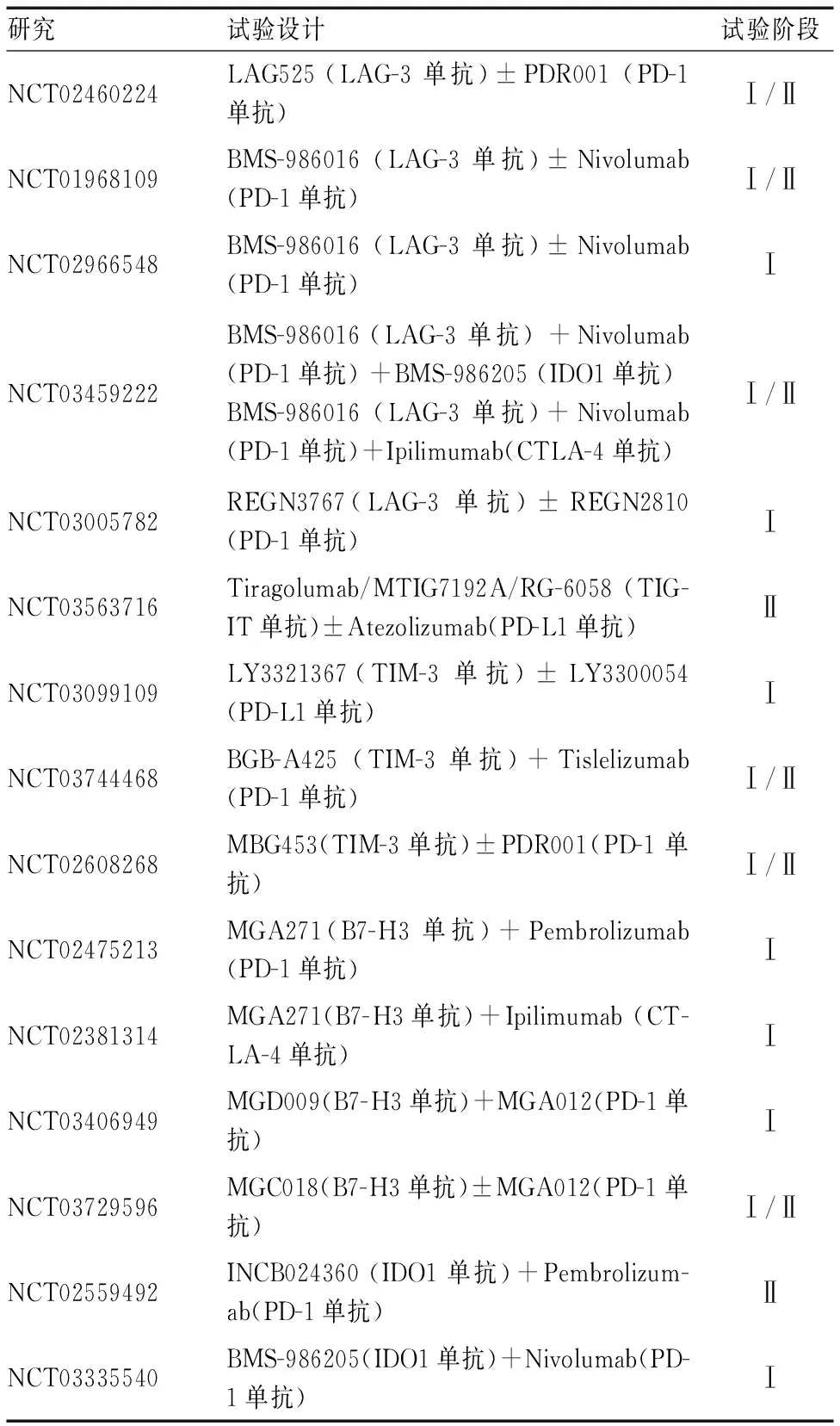
表2 新兴免疫疗法联合PD-1/PD-L1/CTLA-4 ICIs在晚期NSCLC中的Ⅰ/Ⅱ期研究
免疫抑制剂与其他疗法联合用于非小细胞肺癌的晚期治疗
一、免疫治疗联合其他疗法在NSCLC晚期治疗中的研究进展
1 双免疫联合治疗 早期NCT02000947[5]试验就表明了PD-L1抑制剂Durvalumab(度伐利尤单抗)联合抗CTLA-4单抗Tremelimumab(替西木单抗)二线治疗晚期NSCLC有可耐受的安全性与抗肿瘤活性。随后,一项随机开放(NCT02477826[11])Ⅲ期临床试验评估了Nivolumab (纳武利尤单抗)联合Ipilimumab(伊匹单抗)对NSCLC患者的长期益处。1739例NSCLC患者被纳入研究,研究对象既包括PD-L1表达水平为1%或以上的患者,研究结果显示PD-L1表达水平≥1%的患者,Nivolumab联合Ipilimumab较单独化疗的中位总生存期(median overall survival, mOS)更长(17.1个月vs14.9个月),其在客观缓解率(objective response rate, ORR)上也具有优势(35.9%vs30.0%),接受双免疫治疗和单纯化疗后相关的3~4级不良发生率相似(32.8%vs36.0%)。在PD-L1表达水平<1%的患者,Nivolumab联合Ipilimumab在OS、ORR及疾病缓解时间方面也有益处。此外,研究也发现此双免疫联合试验中,抗肿瘤活性与PD-L1表达状态是无关的。
2 免疫联合化疗 早期一项Ⅱ期随机试验[12]评估了单纯化疗或联合PD-1单药治疗晚期鳞状非小细胞肺癌(squamous cell carcinoma, SqNSCLC)患者的疗效,研究证实了免疫联合化疗显著提高了患者的ORR、PFS值,展现了积极的研究结果。此外,随后进行的(CheckMate 9LA[6])试验也探讨了Nivolumab联合Ipilimumab疗法的基础上加化疗是否会进一步提高临床效益。研究被随机分为Nivolumab+Ipilimumab联合2个周期化疗(n=361)或单独4个周期化疗(n=358),中位随访时间为13.2个月,初步结果发现:联合疗法的mOS明显长于单独化疗(15.6个月vs 10.9个月),其中位无进展生存期(median progression-free survival, mPFS)也表现出积极结果(6.8个月vs5个月),并且联合疗法在ORR值上也更具有优势(37.7%vs25.1%)。此研究还观察到随着随访时间的延长,联合疗法获益也会有所改善。接受联合治疗和单纯化疗后相关的3~4级不良发生率分别为7%和9%,最常见的治疗相关不良事件是中性粒细胞减少,并且大多数不良事件多考虑由化疗引起。可见,值得肯定的是PD-1/PD-L1/CTLA-4抑制剂联合标准化疗,无论是在一线还是二线治疗晚期NSCLC的患者均能带来新的希望。
3 免疫联合靶向治疗 一项多臂Ib期试验[7]探讨了奥西替尼联合Durvalumab的安全性,研究入组了23例患者分别接受奥西替尼(80mg)+不同剂量Durvalumab(3 mg/kg(n=10)或10mg/kg(n=13)治疗,初步结果显示ORR均为43%,两组相关3~4级不良发生率分别60%、38.5%,间质性肺病ILD发生率(23%)高于预期结果,该联合治疗方案的毒性是不可接受的,多数病例也因过量毒性而终止,可见,奥西替尼联合Durvalumab安全性还具有挑战性,随后进行的Ⅰ期多中心试验[13]评估Durvalumab和吉非替尼联合治疗晚期NSCLC也因过量毒性而终止,并发现PFS并没有显著增加(mPFS为10.1个月95%CI: 5.5~15.2)。可见,目前Durvalumab联合靶向治疗还无法获得令人满意的结果。Gettinger等[14]进行了Ⅰ期研究评估了Nivolumab联合厄洛替尼治疗晚期EGFR突变型非鳞状非小细胞肺癌NSCLC的疗效,初步结果显示20例经TKI治疗的EGFR突变型NSCLC患者接受Nivolumab+厄洛替尼治疗后24周PFS为48%。ORR为15%(包括1例完全缓解),患者发生与治疗相关的3~4级毒性反应为24%。Nivolumab+厄洛替尼安全性是可耐受的。此外,Pembrolizumab+厄洛替尼/吉非替尼(NCT02039674[15])作为一线治疗EGFR敏感性突变的晚期NSCLC,研究显示接受Pembrolizumab+吉非替尼治疗,因3~4级毒性(71.4%)反应大而终止,而观察到Pembrolizumab+厄洛替尼治疗表现出可耐受的安全性,但此联合并未改善ORR值(41.7%)。因此,值得进一步的研究来评估PD-1抑制剂在EGFR突变的晚期NSCLC患者中的作用。
4 免疫联合放疗 传统放疗与免疫联合治疗以刺激T细胞介导的肿瘤清除,减少受辐射区域以外的疾病负担,并达到“远隔效应”[16]。一项抗PD-1耐药性的肺癌动物模型[17]研究发现放疗能够消除抗PD-1免疫治疗的耐药性。可见,免疫治疗联合放疗在未来是有一定的价值。PEMBRO-RT(Ⅱ期)[8]和MDACC(Ⅰ/Ⅱ期)[9]试验探讨了放疗能否增强晚期NSCLC患者对免疫治疗的反应。研究结果初步显示Pembrolizumab联合放疗较Pembrolizumab单药治疗可显著延长晚期NSCLC患者的中位PFS(9个月vs4.4个月;HR0.67;P=0.045),联合组也显著提高了患者的中位OS(19.2个月vs 8.7个月;HR 0.67;P=0.0004),但并不增加≥3~4级AEs(17% vs 30%)。该研究对总生存期的亚组分析中发现Pembrolizumab联合放疗似乎对男性患者最有利(P=0.020)。这一结果或许为未来免疫治疗联合放疗一线研究的开展提供了方向。此外,最近ETOP NICOLAS Ⅱ期试验[18](n=82)评估了Nivolumab同步放化疗,治疗Ⅲ期NSCLC患者的安全性,中位随访时间为13.4个月。初步结果显示Nivolumab同步放化疗安全性是可以耐受的,最常见的不良事件(AEs)是贫血、疲劳和肺炎。放疗后3个月随访期内,也无≥3级肺炎。基于此积极结果可见PD-1/PD-L1抑制剂联合放疗在肿瘤学领域的治疗上是取得了巨大的进步,并且多种联合治疗方法也正在深入研究中。
5 免疫治疗联合抗血管生成药 血管内皮生长因子(vascu lar endothelial growth factor, VEGF) 通路是肿瘤细胞发生免疫逃避的机制之一,VEGF信号通路与抗肿瘤免疫反应相互影响,VEGF可促进免疫抑制性细胞群体的产生(如Treg种群),阻碍肿瘤抗原的成熟和效应T细胞的功能,并阻碍免疫效应细胞向肿瘤微环境的迁移和浸润[19]。黑色素瘤的动物模型[20]研究发现在分泌粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)的肿瘤细胞疫苗中,增添抗VEGF药物可增加T细胞募集并延长生存期。可见,抗血管生成药联合免疫治疗的协同效应是有潜力的。一项随机、开放标签Ⅲ期临床试验[10](n=800) 探讨了在EGFR敏感性突变的意向治疗人群中接受Atezolizumab +贝伐珠单抗+卡铂+紫杉醇(ABCP) 较贝伐珠单抗+卡铂+紫杉醇(BCP)的疗效,初步结果显示ABCP方案较BCP方案治疗可显著延长晚期NSCLC患者的中位OS(19.8个月vs14.9个月), 且ABCP组比BCP组在mPFS更能得到显著改善(10.2个月vs 6.9个月;HR 0.41),但3~4级治疗相关事件发生在ABCP组与BCP组相似(57% vs 49%P<0.01)。此外,有关免疫抑制剂与抗血管生成药联合用药的研究,还包括Pembrolizumab+雷莫卢单抗(NCT02443324[21])Ia/b期试验也初步确认了联合用药的安全性和良好的抗肿瘤活性。
新兴免疫检查点抑制剂用于非小细胞肺癌的晚期治疗
PD-1/PD-L1和CTLA-4在癌症患者中的应答率差等问题成为免疫治疗的短板,因此,有必要探索其他新兴ICs受体,如 LAG-3、TIGIT、TIM-3、BTLA等所带来的临床价值。有研究表明[22]这些ICs受体与T细胞活化、效应因子功能和增殖等有关,并表现出独特及独立性。可见已成了癌症免疫治疗的另一选择。
一、LAG-3单抗
LAG-3作为免疫治疗令人兴奋的靶点之一,目前,多项Ⅰ期和Ⅱ/Ⅲ期临床试验研究以评估LAG-3单抗或新兴双特异性药物在多种恶性肿瘤中疗效。早期2013年在(NCT01968109[23])试验中评估了LAG-3单抗(Relatlimab)和PD-1单抗(Nivolumab)联合治疗难治性黑色素瘤患者的疗效。初步疗效显示48例患者ORR为12.5%,此外,LAG-3单抗在肿瘤浸润淋巴细胞(TIL)上表达>1%的患者ORR为20%,LAG-3单抗表达<1%的患者ORR为7.1%,但并不清楚LAG-3阳性是否与对Nivolumab反应较差相关,或在疾病进展时LAG3表达增加有关。本研究中出现3~4级治疗相关不良事件仅为9%,与单独使用Nivolumab的发生率相似。而且还发现Nivolumab+Relatlimab联合用药可能比Nivolumab+Ipilimumab联合用药更安全。后Woo等[24]发现在几种小鼠模型中,LAG-3单抗和PD-1抗体联合治疗均可显著改善预后,并且发现两者联合可能有助于克服对PD-1单抗免疫疗法的耐药性。此外,LAG-3单抗(IMP321)联合化疗(紫杉醇)在实体肿瘤的Ⅰ期临床试验(NCT00349934[25])也显示初步疗效。目前LAG-3单抗在晚期NSCLC中正在开展的Ⅰ/Ⅱ期的研究包括BMS-986016+Nivolumab(NCT01968109,NCT02966548,NCT03459222)、TSR-033+PD-1单抗(NCT03250832)、LAG525+ PDR001(NCT02460224)等,对研究结果有所期待。
二、TIGIT单抗
TIGIT作为未来抗癌神药的热门靶点之一,研究成果已在2020年ASCO会议上公布。这是一项Ⅱ期随机对照研究(CITYSCAPE[26])纳入135例曾未经化疗PD-L1阳性的晚期NSCLC患者,接受Tiragolumab(TIGIT单抗)+ atezolizumab(TA组)或安慰剂atezolizumab(PA组)一线治疗后,主要终点为评估患者的ORR和PFS值,初步结果显示:(TA组)明显改善了ORR(31% vs 16%),mPFS也得到提高(5.42个月vs 3.58个月)。更有趣的是,该亚组研究发现在PD-L1 TPS≥50%的人群,TA组似乎在ORR和PFS方面会出现更具有临床意义的改善。此外,安全性数据表明,3级以上治疗相关事件发生在TA组与PA组相似(19.1%vs 14.9%)。目前,国内首个获批的靶向TIGIT的单克隆抗体药物(IBI-939)联合PD-1单抗或PD-L1单抗正在进行,旨在探索联合用药的疗效及能否延缓耐药性的问题。2020年TIGIT单抗在ASCO会议上公布的积极研究数据可谓是迎来了第一波高光时刻。
三、TIM-3单抗
TIM-3作为免疫疗法研究领域中新“战士”之一,最近一项多中心开放研究探索双特异性抗体(LY3415244[27])治疗晚期实体瘤患者的安全性和有效性已展开,并且通过预测抗药性抗体(ADAs)作为新抗体免疫原性风险评估的一部分。目前TIM-3单抗在晚期NSCLC中正在开展的Ⅰ/Ⅱ期的研究包括BGB-A425+Tislelizumab(NCT03744468)、MBG453+PDR001(NCT02608268)、TSR-022 +PD-1单抗(NCT02817633)等。
四、其他ICIs
除了上述三种新的免疫检查点以外,许多其他ICs(如BTLA,VISTA,B7-H3,Siglec-15等)也表现出具有吸引力的一面。BTLA是一种新型CD28超家族成员,通过研究BTLA在I~Ⅲ期NSCLC中的表达及与PD-1/PD-L1的相关性发现BTLA表达也可能作为临床疗效的预测生物标志物[28],BTLA单抗(TAB004/JS004)已被FDA批准进行临床试验,但目前,有关BTLA单抗开放的临床试验少。多种小鼠模型的临床前研究就表明[29],VISTA阻断可改善肿瘤浸润T细胞在TME内的浸润、增殖和效应功能,具有显著的抗肿瘤作用和良好的耐受性。目前多种VISTA单抗(如JNJ-61610588,CA-170,HMBD-002)也开展用于实体肿瘤的Ⅰ期临床试验。早在2001年[30]就发现了B7-H3,又名CD276,Enoblituzuma[31](MGA271)在临床试验中已获得了积极的研究结果,其他针对B7-H3单抗(MGD009,8H9等[32-33])也开展了多项临床研究进一步探索。TIM-3单抗在晚期NSCLC中试验包括MGA271+Pembrolizumab (NCT024752) 、MGA271+Ipilimumab(NCT02381314) 、MGD009/MGC018+MGA012(NCT03406949,NCT03729596)等也正在进行的Ⅰ/Ⅱ期研究。在小鼠模型中偶然发现Siglec-15抑制剂[34]也能抑制肿瘤的生长,正在招募临床试验进一步研究。目前,多种免疫检查点已被选作为新的治疗靶点。可见,如今新型免疫检查点抑制剂,已成功激发了人们的热情。
免疫治疗非小细胞肺癌面临的挑战
免疫治疗为晚期NSCLC患者带来了新纪元,在NSCLC患者的一线、二线甚至三线治疗中均显示出疗效。然而,由于某些尚未解决的挑战会使免疫治疗临床应用受限,因此,仍有些问题亟待解决。
一、目前能够预测免疫治疗疗效的特定生物标志物较少。PD-L1的表达已被证明与PD-1/PD-L1封锁治疗NSCLC的疗效相关[35]但是这种关联在不同的ICIs之间却不同,如:有研究[36]观察到无论PD-L1表达如何,Nivolumab对鳞状NSCLC和Durvalumab对NSCLC的OS均有改善,而且PD-L1的表达水平,在使用不同检测抗体的免疫组化检测中也是有异质性。因此,有必要研究更多的预测因子综合反映ICIs治疗的临床反应潜力。
二、患者无论从免疫单药治疗还是联合治疗,能否避免治疗相关不良事件(TRAEs)仍然是难以预测的。多项研究对免疫治疗的安全性进行评估,但研究都会出现3~4级治疗相关事件发生,甚至有些研究会因TRAEs的发生以失败告终。因此,TRAEs仍然是PD-1/PD-L1/CTLA-4抑制剂治疗的重大挑战,未来能预测或减少严重的TRAEs的发生,是研究的方向。
三、如何为晚期NSCLC患者选择最佳联合治疗方案,仍值得深入探索。目前,多种ICIs联合治疗已被证明在提高应答率方面具有巨大潜力,但仍需要进一步的研究来确定这些联合药物的最佳使用顺序,以提高联合治疗的准确性。
总 结
近年,ICIs联合治疗在癌症临床应用方面的发展迅速,ICIs不断被批准作为晚期NSCLC的二线和一线治疗方案,为晚期NSCLC的治疗提供了更多的选择。新兴免疫治疗也可能在未来的癌症临床实践领域带来新曙光。然而,免疫治疗仍处于起步阶段,许多挑战值得探索。因此,结合正在进行的临床试验,还需要进行更多的回顾性或前瞻性研究,以证实疗效与安全性,探索生物标志物的测定,以达到最优化的治疗。
