拟南芥肌动蛋白相关蛋白基因AtARP5和AtARP6共同参与DNA复制
2022-01-18安增选樊天谊
吴 迪,安增选,樊天谊,朱 炎
(1. 复旦大学 生命科学学院 植物科学研究所,上海 200438; 2. 复旦大学 遗传工程国家重点实验室,上海 200438)
肌动蛋白相关蛋白(Actin-Related Proteins, ARPs)在蛋白一级结构序列上与传统的肌动蛋白(Actin)有17%~60%的同源性,存在于所有的真核生物中,是一大类高度保守的蛋白家族[1].ARPs和Actin都具有肌动蛋白折叠(Actin-fold)的核苷酸结合口袋.根据与Actin序列的相似性,ARPs被进而分成多个亚家族.以酵母为例,与Actin相似性最高的命名为ARP1,ARP10的相似性最低[2].不同亚家族的ARPs具有结构和功能上的多样性,并且有不同的亚细胞定位.酵母和其他物种中同源的ARP1~ARP3以及ARP10定位在细胞质中,而ARP4~ARP9则定位在细胞核中[3],并且与Actin一起在许多染色质重塑复合物和组蛋白乙酰转移酶复合物中被发现[4].
ARP5是酵母和人类INO80复合物中特有的亚基,在INO80染色质重塑功能上发挥着重要的功能.当发生DNA双链断裂(DSB)时,人类ARP5同源基因突变的细胞株系呈现细胞增长缓慢和组蛋白γ-H2A.X磷酸化累积受损的表型.酵母ARP5对于INO80染色质重塑因子富集到DSB位点启动同源重组修复,以及DSB修复完成后被停滞的复制叉重新启动等过程起到不可或缺的作用[5].拟南芥ARP5定位在细胞核中,ARP5的功能缺失突变体相对于野生型植物对基因毒试剂的处理更为敏感[6].
ARP6是所有已知SWR1复合物中特有的亚基,通常认为ARP6与另一亚基Swc6形成保守模块,调控与组蛋白变异体H2A.Z的相互作用[7].含有ARP6在内的SWR1染色质重塑复合物参与组蛋白变异体H2A.Z掺入染色质,调控基因转录、异染色质形成与维持、染色质稳定性以及DNA损伤修复等过程.拟南芥ARP6同源基因在植物各个器官中都有表达.arp6功能缺失突变体呈现多种发育上的表型,长短日照下都呈现早花的表型,植株整体呈现矮小丛生的表型[8].
我们之前的工作报道了拟南芥染色质重塑因子AtINO80和AtARP5形成蛋白复合物[9].由于AtINO80和PIE1功能缺失突变体杂交形成的双突变体植物致死,而AtINO80和AtARP6功能缺失突变体杂交形成的双突变体植物在植物生长和育性上也有着非常明显的缺陷,不适合后续的遗传分析.因此,我们构建了AtARP5和AtARP6功能缺失突变体的双突变体植物atarp5-2atarp6-1.我们在之前的研究中报道了AtARP5和AtARP6共同参与维持植物基因组的稳定[9].然而,两者在植物生长发育中的功能互作并没有完全揭示.这里,我们发现,两个ARP蛋白共同参与了植物细胞大小以及植物细胞核倍性的调控.转录水平分析显示,特定细胞周期相关基因在双突变体植物atarp5-2atarp6-1中被协同上调.我们证实了两个ARP蛋白共同结合DNA解旋酶RVB1,暗示了两者可能存在的分子层面的协同机制.
1 材料与方法
1.1 材料
拟南芥Arabidopsisthaliana野生型WT为Col-0种子;突变体材料为:atarp5-2(GK_386F02);atarp6-1(Garlic_599_G03);双突变体atarp5-2atarp6-1通过杂交分离获得[9].大肠杆菌菌株:E.coliTOP10(用于克隆构建);E.coliRosetta DE3(用于原核表达蛋白).农杆菌菌株:A.tumefaciensGV3101(用于BiFC实验中的植物转化).克隆构建载体: pET-28a(用于构建His-tag融合蛋白),pGEX-4T-1(用于构建GST-tag融合蛋白),pXY-105/pXY-106(用于BiFC实验).RNA抽提试剂TRIzol(Ambion公司),反转录试剂盒(Promega公司),克隆用DNA限制性内切酶、T4DNA连接酶、pMD19-T载体等(TaKaRa公司),高保真KOD酶(Toyobo公司),质粒提取试剂盒、胶回收试剂盒等(Axygen公司).
1.2 方法
1.2.1 微分干涉相差显微镜观测植物细胞
叶片透明液: 8 g水合氯醛,1 mL甘油,2 mL水,充分混匀溶解.取植物叶片浸没于叶片透明液中,在65 ℃孵育1~3 h,直至叶片呈透明.将透明处理后的叶片置于载玻片上,通过微分干涉相差显微镜(Zeiss Imager.A2)下观察并拍照.照片用Image J进行细胞大小的分析,相应数据导入Excel中进行分析.
1.2.2 流式细胞分析
收取萌发后25 d的拟南芥相应叶片,用刀片切碎释放细胞核.过滤后离心.重悬至溶液(1×MgSO4buffer、6.5 mmol/L DTT、0.1 mg/mL Propidium iodide、1 μg/mL RNase)中,37 ℃放置15 min.上流式细胞仪(BD Calibur)分析.
1.2.3 转录水平分析
收取12 d大小的植物幼苗作为材料,抽提RNA.使用Ambion公司的TRIzol试剂抽提RNA,并用Promega公司的反转录试剂盒进行反转录.检测引物的序列参考文献[10].
1.2.4 原核蛋白表达以及Pull-down实验
通过反转录和高保真酶,从野生型拟南芥幼苗中获取RVB1,AtARP5和AtARP6的全长cDNA.测序后,将相应CDS克隆至pET-28a和pGEX-4T-1中,获得His-RVB1和GST-AtARP5、GST-AtARP6的表达克隆.后通过诱导表达,利用镍柱和GSH亲和柱纯化.Pull-down实验,先将纯化好的GST-AtARP5、GST-AtARP6以及GST-NRP1(用于负对照实验)偶联到GSH亲和柱,充分洗脱后,将His-RVB1与相应亲和柱混匀,再用1×PBS溶液充分洗脱.最后加1×SDS loading buffer煮beads溶解,走SDS-PAGE胶上样.
1.2.5 双分子荧光互补实验(Bimolecular Fluorescent Complimentary, BiFC)
种植一个月左右的烟草,待其长出4~10片幼嫩叶片时即可使用.pXY105载体用于构建cYFP在N端的融合蛋白;pXY106载体用于构建nYFP在N端的融合蛋白.转化至农杆菌A.tumefaciensGV3101后,挑选单克隆.转化后的农杆菌过夜培养后,用BiFC重悬液(10 mmol/L MgCl2,100 μmol/L乙酰丁香酮,1 mmol/L MES-KOH,pH 5.6)至合适OD600浓度(0.5左右),用注射器推射至烟草幼嫩叶片的背面,直至整个烟草叶片浸湿,避光培养2 d后,用激光共聚焦显微镜观察并拍摄.
2 结 果
2.1 AtARP5和AtARP6同时功能缺失导致植物叶片细胞面积减小
我们在之前的工作中报道了atarp5-2atarp6-1双突变体的植物在幼苗时期的表型.相对于野生型WT和各自的单突变体,双突变体的植物幼苗叶片面积变小,真叶叶片上卷.我们继续在土壤中培养植物,发现这样的生长抑制一直出现在植物的整个营养生长阶段(图1(a)).由于植物叶片面积减小,我们想观测是否叶肉细胞面积同样减小.我们对萌发后25 d拟南芥的第一对真叶进行了透明液处理,并利用微分干涉相差显微镜(DIC)进行了观察(图1(b)),用Image J软件对拍摄的叶肉栅栏细胞面积进行了定量统计.与野生型(~2 460 μm2)相比,atarp5-2栅栏细胞的平均面积(~2 226 μm2)降低程度并不大,而atarp6-1(~1 822 μm2)的降低程度较为明显.但atarp5-2atarp6-1双突变体(~1 259 μm2)则有着显著性的下降程度(图1(c)).我们对采集的数据进行了频率分析.所有植物的叶肉栅栏细胞面积都呈现较为标准的正态分布曲线(图1(d)).横坐标代表细胞面积的对数值.结果显示,atarp5-2atarp6-1双突变体的峰值明显向左偏移,再一次表明双突变体的细胞大小受到了明显的抑制.根据叶片的大小与叶肉栅栏细胞的平均面积可以简单地估算叶片内细胞的数量.相对于野生型植物(定为100%),atarp5-2和atarp6-1栅栏细胞的数量略微降低(~92.9%±3.3%和~88.9%±2.4%),但atarp5-2atarp6-1双突变体则有着显著性的下降程度(~74.8%±1.8%).我们的结果表明AtARP5和AtARP6在控制植物叶片面积、以及细胞大小和数量上都有着协同的调控作用.
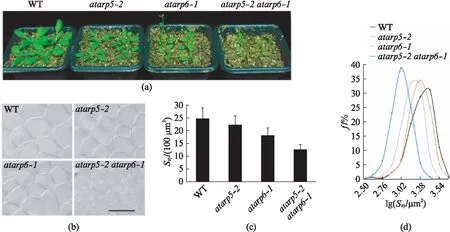
图1 AtARP5和AtARP6功能同时缺失导致植物叶片细胞面积减小Fig.1 The simultaneous loss-of-function in AtARP5 and AtARP6 results in the decrease of leaf cell area(a) 萌发后25 d的拟南芥表型;(b) 萌发后25 d的拟南芥叶片的DIC照片,Bar=100 μm;(c) 利用Image J对叶片栅栏细胞面积进行统计(每种植物统计>200个细胞),图中显示了不同植物的细胞面积的平均值和方差.单位是100 μm2;(d) 横坐标表示细胞面积的对数值,纵坐标表示不同面积的细胞出现的频率.
2.2 atarp5-2 atarp6-1双突变体内植物细胞的倍性下降
接下来,我们通过流式细胞仪检测了萌发后35 d拟南芥莲座叶的叶细胞核倍性(η).第1对真叶的数据显示,野生型植物的叶片已经出现了32C的细胞,而16C的细胞的比例占比最大.这样的分布比例在单突变体atarp5-2和atarp6-1都没有发生明显的改变,但atarp5-2atarp6-1双突变体则检测不到32C细胞,表明双突变体内的细胞内复制现象以及细胞倍性发生了改变(图2(a)).我们通过公式I内复制=(0×η2C)+(1×η4C)+(2×η8C)+(3×η16C)+(4×η32C)计算了相应的内复制指数(I内复制).atarp5-2atarp6-1双突变体的I内复制只有1.472 3,明显低于野生型(2.223 7)和各自的单突变体atarp5-2(2.070 7)和atarp6-1(2.013 3).表明AtARP5和AtARP6在维持和控制叶片细胞内复制进程中有着明显的协同作用.

图2 叶细胞核倍性的比较Fig.2 Comparison of nuclear ploidy levels of leaf cells(a) 第一对真叶的核倍性比较;(b) 第三对真叶的核倍性比较.
我们同样检测了第3对真叶,相应的结果与第1对真叶的结果类似(图2(b)).表明两个ARP蛋白的功能互作在植物的营养器官发育过程中发挥着重要的作用.
2.3 atarp5-2 atarp6-1双突变体细胞周期相关基因的转录水平
由于双突变体呈现了叶肉细胞面积减小以及细胞核倍性降低的表型,我们推测这可能由于细胞复制进程出现缺陷.接下来,我们检验了萌发后12 d不同拟南芥背景下细胞周期的标志性基因:CYCD3;3(G1期),组蛋白基因H3.1(S期),CYCB1;1(G2-M期),CYCA2;1(G2期).我们发现,相对于野生型,单突变体的各个标志性基因的转录水平并没有明显的改变,但在双突变体背景下,S期的H3.1基因和G2-M期的CYCB1;1基因的转录水平有着显著性的上调(图3).随后,我们细致地分析了DNA复制过程中的一些关键基因的转录水平,包括滑动钳位因子基因PCNA(ProliferatingCellularNuclearAntigen1),复制起始因子基因CDT1A(ChromatinlicensingandDNAreplicationfactor1A)、CDT1B、CDC6A(CellDivisionControl6A)、CDC6B,复制起始识别复合体的亚基基因ORC1a(OriginofReplicationComplex1a)、ORC1b、ORC3、ORC6,微小染色体维持蛋白基因MCM3、MCM4、MCM7[10-11].结果显示,在双突变体背景下,与DNA复制起始相关的CDT1B、ORC1a和ORC1b的转录水平显著上调,暗示AtARP5和AtARP6同时缺失可能导致细胞DNA复制的起始出现异常.
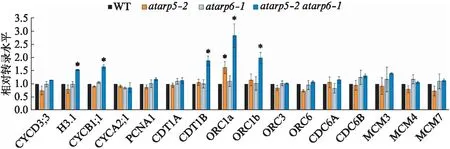
图3 细胞周期和DNA复制基因表达水平的定量RT-PCR分析Fig.3 Quantitative RT-PCR analysis of the expression levels of cell cycle and DNA replication genesFC(Fold change)>1.5,同时P<0.05的基因被标注成显著性差异(*).
2.4 AtARP5和AtARP6共同结合DNA解旋酶RVB1
由于AtARP5和AtARP6分别是拟南芥INO80和SWR1染色质重塑复合物中的特异性亚基.因此两者之间的功能互作可以理解为两个重塑复合物活性之间的互作.但目前,联系两个重塑复合物的分子机制并没有被很好地建立起来.我们之前的工作显示,AtARP5亲和层析中亲和蛋白的质谱结果包含了DNA解旋酶RVB1.该蛋白在进化中保守,在酵母中同时结合INO80和SWR1蛋白.酵母RVB1在体外具有DNA解旋酶活性并且可以结合复制叉[12].在拟南芥中,RVB1是致死基因,其功能缺失突变体无法获得,通过RNAi技术构建得到的弱突变体也出现了分生组织的生长问题[13].
由于实验结果显示atarp5-2atarp6-1双突变体出现了DNA复制进程的问题,因此我们推测ARP5和ARP6可能与RVB1存在着功能以及分子上的关联.因此,我们试图通过蛋白质层面的研究建立起相应的联系.我们构建了His-tag在N端融合的RVB1(表征分子量约为60 kDa),以及GST-tag在N端融合的ARP5(表征分子量约为106 kDa)和ARP6(表征分子量约为70 kDa).NRP1是植物中的组蛋白分子伴侣,对于H2A-H2B有着较高的亲和力.我们同样构建了GST-tag在N端融合的NRP1(表征分子量约为55 kDa,但因为NRP1蛋白偏酸性,实际条带在电泳中超过70 kDa),作为蛋白互作中的负对照.我们利用这些蛋白在体外进行了Pull-down实验.Pull-down结果显示,His-RVB1并不能结合GST-NRP1,但能与GST-AtARP5以及GST-AtARP6结合(图4(a)).我们进而利用BiFC验证相应的蛋白互作.将YFP的N端(Yn)融合到RVB1,将YFP的C端(Yc)融合到NRP1、AtARP5和AtARP6蛋白,注射到烟草叶片后,在烟草细胞中观测到Yn-AtRVB1/Yc-AtARP5和Yn-AtRVB1/Yc-AtARP6的组合都能产生荧光信号,但Yn-AtRVB1/Yc-NRP1并没有观测到荧光信号(图4(b)),表明RVB1可以分别与AtARP5和AtARP6蛋白结合.

图4 RVB1可以分别结合AtARP5和AtARP6Fig.4 RVB1 can interact with AtARP5 and AtARP6, respectively (a) Pull-down实验.GST-fusion proteins(GST-NRP1,GST-AtARP5和GST-AtARP6)分别固定在GSH亲和柱上,His-RVB1作为样品分别上样,充分洗脱后,beads用SDS-PAGE上样液煮样,利用SDS-PAGE检测.被GST-AtARP5和GST-AtARP6捕获的His-RVB1用黄色箭头标注;(b) BiFC实验.Bar=100 μm.
3 讨 论
真核生物的基因组DNA是以染色质的形式存在,因而染色质的动态调控影响了所有以基因组DNA为模板的生理活动,如DNA复制、基因组内复制、细胞增殖等过程.染色质重塑因子利用ATP水解能量主动调控染色质结构,探索不同染色质重塑因子之间的功能互作,有助于理解真核生物调控染色质结构的分子机制.在进化中,INO80和SWR1同属于一个染色质重塑因子家族,它们通过结合多个亚基,成为重要的染色质重塑复合物.
SWR1蛋白复合物调控组蛋白变异体H2A.Z掺入染色质以及在染色质的分布,对基因转录有着复杂的调控作用.INO80蛋白复合物在基因转录调控、DNA损伤修复和基因组稳定性上起着重要的表观遗传调控作用.我们之前在研究拟南芥AtINO80以及SWR1染色质重塑复合物的过程中,发现AtINO80与拟南芥SWR1同源基因PIE1的互作对于植物的生长有着极为重要的作用,两者的同时缺失导致植物致死.而AtINO80与AtARP6的遗传互作表明,尽管可以拿到双突变体,但植物胚胎高比例地死亡,即便少量存活后成长为植物,也出现发育极为不良的现象,育性极度下降[9].这些表型的观测表明,拟南芥INO80和SWR1染色质重塑复合物在细胞增殖和植物生长中发挥着至关重要的协同作用.
在本研究工作中,我们利用作为INO80复合物和SWR1复合物中特有的成员AtARP5和AtARP6做了遗传分析.我们的结果显示,atarp5-2atarp6-1双突变体最明显的表型是叶片面积减少,对其叶肉栅栏组织细胞大小统计后发现,atarp5-2,atarp6-1和atarp5-2atarp6-1叶肉栅栏细胞面积依次减小.通过RT-PCR检测发现,双突变背景下细胞周期及DNA复制相关基因H3.1、CDT1B、ORC1a和ORC1b以及关卡基因CYCB1;1的转录水平上调.在表型和细胞层面的分析中,我们观测到双突变体在细胞增殖以及细胞倍性上相对于野生型和各自的单突变体都受到了影响,我们推测AtARP5和AtARP6在DNA复制以及细胞周期相关基因的转录调控等方面发挥了协同的作用.尽管目前肌动蛋白相关蛋白在不同染色质重塑复合物中的具体分子活性尚不清楚,但我们的细胞和分子实验的结果显示,两个复合物核心组分AtINO80和PIE1充分发挥其重塑活性,分别需要依赖AtARP5和AtARP6的参与.
我们利用体外Pull-down实验和体内BiFC实验,验证了DNA解旋酶可以分别结合AtARP5和AtARP6.由于RVB1在体外具有解旋酶活性和结合复制叉的能力[12],同时由于RVB1是致死基因,其弱突变体表型相似于atino80atarp6-1观测到的表型,因此,我们猜测AtARP5和AtARP6可以通过RVB1的活性输出发挥调控作用.S期的进程有赖于复制叉的不断延伸,细胞需要持续地通过打开原有染色质结构才能释放出DNA母链用于后续的半保留复制,因而DNA解旋酶的活性需要有效地偶联到能重塑染色质结构的蛋白复合物,才能有效地推动S期的进程.目前,我们还不能解释两个复合物如何在复制叉稳定性和延伸性上协同工作,此外RVB1的活性调控机制由于其基因突变致死从而在遗传上没有深入下去.未来我们可以通过构建筛选GFP融合的RVB1转基因植物,进一步开展ARP5、ARP6和RVB1在体内的分子关联研究,同时利用RNAi技术构建RVB1的弱突变体,深入研究拟南芥INO80和SWR1蛋白复合物在植物细胞增殖中的功能关联.
