黄芪皂苷Ⅱ对哮喘幼年大鼠IL-21/STAT3 通路及气道炎症反应的影响
2022-01-17陈晓凤
伍 爽,李 微,黎 达,辛 迪,陈晓凤,李 雪
(1.齐齐哈尔市第一医院新生儿科,黑龙江 齐齐哈尔 161000;2.哈尔滨市道里区人民医院儿科,哈尔滨 150000)
哮喘是婴幼儿常见的呼吸系统疾病之一,是由多种免疫活性细胞及炎症介质参与的慢性疾病[1-3]。 其主要特征是气道炎症、气道高反应性、黏液生成增加和嗜酸性粒细胞浸润[4]。 黄芪是补益中药,具有健脾补中、升阳举陷、托毒生肌之功效,《本草纲目》 记载“可治一切气衰血虚之症”[5]。 其中,黄芪皂苷Ⅱ是黄芪重要的生物活性成分,具有免疫调节、抗肿瘤等生物活性[6-7]。 白细胞介素21(interleukin-21,IL-21)可介导多种生物学效应,与其受体IL-21R 结合后可通过信号传导途径Janus 激酶(Janus kinase,JAK)/信号转导和转录活化因子(signal transducer and activator of transcription,STAT)传递活化信号[8-9]。 He 等[10]研究发现,麻黄汤在大鼠哮喘模型中可有效缓解气道炎症并调节IL-21/STAT3 信号通路。 但目前,关于黄芪皂苷Ⅱ是否可通过IL-21/STAT3 信号通路,改善哮喘症状尚未见报道。 因此,本研究以哮喘幼年大鼠为研究对象,探讨黄芪皂苷Ⅱ对哮喘幼年大鼠IL-21/STAT3 通路及气道炎症反应的影响,为黄芪皂苷Ⅱ为在临床幼儿哮喘中的应用提供理论依据。
1 材料和方法
1.1 实验动物
72 只新生SD 幼年大鼠,雌雄兼有,SPF 级,3~4 周龄,体重70~100 g,购自吉林大学实验动物中心[SCXK(吉)2019-0001],大鼠饲养于齐齐哈尔医学院动物实验中心[SYXK(黑)2019-0017]。 饲养环境:温度(25±2)℃,湿度50%,正常饮食,光照明/暗(12/12)h。 实验严格遵循3R 原则。 本研究经齐齐哈尔市第一医院伦理委员会批准(IACUC-2019 伦审第89 号)。
1.2 主要试剂与仪器
黄芪皂苷Ⅱ(原料药,纯度98%,北京索莱宝科技有限公司,批号SA8620);地塞米松(原料药,纯度99%,武汉贝尔卡生物医药有限公司,批号50-02-2);卵清蛋白(ovalbumin, OVA)、乙酰胆碱(acetylcholine,Ach)(美国sigma 公司,批号A5253、A6904);白细胞介素-6(interleukin-6,IL-6)、白细胞介素-21(interleukin-21,IL-21)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒(美国Invitrogen 公司,批号RC0067、RK0947、RK1007);蛋白提取试剂盒、BCA 蛋白定量测定试剂盒、聚偏二氟乙烯(PVDF)、超敏ECL 化学发光试剂盒(上海碧云天生物技术有限公司,批号SF-1397、DK-0993、FFP32、P0018 S);IL-21、STAT3、磷酸化-STAT3(phosphorylation-stat3,p-STAT3)、GAPDH 抗体、羊抗鼠二抗(美国Abcam 公司,批号ab178694、 ab5904、 ab5916、 ab00134、 ab0788 )。402AI 型超声雾化器(江苏鱼跃医疗设备有限公司);FinePointe NAM 型动物肺功能检测仪(美国Buxco 公司);MM800 型光学显微镜(日本Nikon 公司);1703940 型蛋白电泳仪(美国Bio-Rad 公司);GIS-500 型凝胶成像仪购自杭州米欧仪器有限公司。
1.3 实验方法
1.3.1 动物分组及哮喘模型建立
将72 只幼年大鼠按随机数表法分成:对照组、模型组、黄芪皂苷Ⅱ低、中、高剂量组和地塞米松组,每组12 只。 参照文献[11]进行幼年大鼠哮喘模型构建:各造模组(除对照组外)在建模第1 天,大鼠腹腔注射OVA 混悬液(0.2 mL)致敏,OVA 混悬液的组成为OVA(20 μg)和氢氧化铝凝胶(2 mg),此后在第8 天和第15 天各进行此致敏操作1 次,于建模第16 天,大鼠给予4% OVA 的生理盐水雾化吸入激发,持续进行7 d。 对照组将致敏药物换成生理盐水也按照上述方法进行处理。 每次激发完成后1 h,黄芪皂苷Ⅱ低、中、高剂量组、地塞米松组分别腹腔注射0.3 mg/kg 黄芪皂苷Ⅱ、0.6 mg/kg 黄芪皂苷Ⅱ、0.9 mg/kg 黄芪皂苷Ⅱ[12]、0.2 mg/kg 地塞米松[13],对照组和模型组腹腔注射生理盐水,注射体积10 mL/kg。
1.3.2 气道反应性测定
末次OVA 刺激24 h 后,各组幼年大鼠分别吸入6.25、12.5、25、50 mg/mL 的Ach 溶液50 μL,每个剂量连续记录3 min 的增强呼气间歇(Penh)值,测定其气道反应性[14]。
1.3.3 样本采集
麻醉大鼠,取血,收集血清,-80℃保存备用。取1 mL 生理盐水进行肺部灌洗,收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF),离心后收集上清液,置于-80℃中保存备用,将底部细胞涂片后,Diff-Quik 染色,高倍镜下进行细胞分类计数。
解剖大鼠,取左肺置于甲醛溶液(10%)固定,取右肺剪碎,液氮速冻,-80℃保存。
1.3.4 BALF 中炎性因子测定取1.3.3 收集的BALF 上清液和血清,采用ELISA 试剂盒检测IL-6、IL-21、TGF-β1 含量。
1.3.5 幼年大鼠肺组织病理学检测
将固定在甲醛中的肺组织制成石蜡组织切片,苏木素-伊红(HE)染色后光学显微镜下观察。 参照Henderson 等[15]方法对肺组织周围炎症因子进行浸润评分,0 分:无炎性细胞;1 分:少许炎性细胞;2分:炎性细胞较多分布不均;3 分:大量炎性细胞,可见成团分布;4 分:大量炎性细胞聚集成团。
1.3.6 蛋白免疫印迹(Western blot)法检测幼年大鼠IL-21、STAT3 蛋白表达水平测定
取出部分冻存在-80℃中的肺组织,匀浆化,提取总蛋白,检测蛋白质浓度,取40 μg 蛋白上样,进行聚丙烯酰胺凝胶电泳,然后转移到PVDF 膜上,用5%脱脂牛奶室温下封闭2 h,将膜在4℃下与IL-21(1 ∶1000)、STAT3(1 ∶1000)、p-STAT3(1 ∶1000)、GAPDH(1 ∶2000)一抗孵育过夜,磷酸缓冲液洗涤膜,然后加入羊抗鼠二抗(1 ∶5000)37℃室温孵育2 h,使用超敏ECL 化学发光试剂盒将蛋白质可视化,凝胶成像仪观察条带并拍照。 以GAPDH 为内参蛋白。
1.4 统计学方法
采用SPSS 22.0 软件进行数据分析,计量资料以平均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验,P<0.05 为差异有统计学意义。
2 结果
2.1 黄芪皂苷Ⅱ对幼年大鼠气道反应性测定的影响
不同浓度Ach 激发后,与对照组相比,模型组幼年大鼠Penh 值显著升高(P<0.05);与模型组相比,黄芪皂苷Ⅱ各处理组幼年大鼠Penh 值显著降低(P<0.05);且随着黄芪皂苷Ⅱ剂量的增加,幼年大鼠Penh 值依次降低(P<0.05)。 见表1。
表1 各组幼年大鼠不同浓度Ach 激发后Penh 值的比较(±s,n=12)Table 1 Comparison of Penh values after Ach stimulation at different concentrations in each group of young rats

表1 各组幼年大鼠不同浓度Ach 激发后Penh 值的比较(±s,n=12)Table 1 Comparison of Penh values after Ach stimulation at different concentrations in each group of young rats
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与黄芪皂苷Ⅱ低剂量组相比,cP<0.05;与黄芪皂苷Ⅱ中剂量组相比,dP<0.05。 下同。Note. Compared with the control group, aP<0.05. Compared with the model group, bP<0.05. Compared with the Astragaloside Ⅱlow-dose group, cP<0.05. Compared with the Astragaloside Ⅱmedium-dose group, dP<0.05. The same as below.
分组Groups不同浓度Ach 激发后Penh 值Penh values of different concentrations of Ach after excitation 6.25 mg/mL 12.5 mg/mL 25 mg/mL 50 mg/mL对照组Control group 1.14±0.18 1.58±0.09 1.97±0.13 2.56±0.25模型组Model group 3.04±0.37a 3.53±0.29a 3.95±0.31a 4.61±0.41a黄芪皂苷Ⅱ低剂量组Astragaloside Ⅱlow-dose group 2.61±0.15b 3.10±0.25b 3.67±0.12b 4.15±0.34b黄芪皂苷Ⅱ中剂量组Astragaloside Ⅱmedium-dose group 1.95±0.25bc 2.47±0.17bc 3.13±0.19bc 3.69±0.28bc黄芪皂苷Ⅱ高剂量组Astragaloside Ⅱhigh-dose group 1.38±0.16bcd 1.89±0.21bcd 2.54±0.22bcd 3.27±0.26bcd地塞米松组Dexamethasone group 1.32±0.19bcd 1.82±0.18bcd 2.31±0.17bcd 3.17±0.22bcd
2.2 黄芪皂苷Ⅱ对BALF 中炎性细胞数量的影响
与对照组相比,模型组幼年大鼠BALF 中白细胞总数和嗜酸性粒细胞、中性粒细胞、淋巴细胞、巨噬细胞数显著升高(P<0.05);与模型组相比,黄芪皂苷Ⅱ各处理组幼年大鼠BALF 中白细胞总数和嗜酸性粒细胞、中性粒细胞、淋巴细胞、巨噬细胞数显著降低(P<0.05);且随着黄芪皂苷Ⅱ剂量的增加,幼年大鼠BALF 中白细胞总数和嗜酸性粒细胞、中性粒细胞、淋巴细胞、巨噬细胞数依次降低(P<0.05)。 见表2。
表2 各组幼年大鼠BALF 中细胞分类及计数结果(±s,n=12)Table 2 Cell classification and counting results in BALF of young rats in each group

表2 各组幼年大鼠BALF 中细胞分类及计数结果(±s,n=12)Table 2 Cell classification and counting results in BALF of young rats in each group
分组Groups白细胞总数(×104 cells/mL)Total white blood cell count嗜酸性粒细胞(×104 cells/mL)Eosinophils中性粒细胞(×104 cells/mL)Neutrophils淋巴细胞(×104 cells/mL)Lymphocyte巨噬细胞(×104 cells/mL)Macrophage对照组Control group 17.85±2.14 0.00±0.12 0.00±0.16 0.27±0.18 4.5±0.84模型组Model group 277.34±20.51a 178.36±7.47a 4.75±0.49a 52.38±5.97a 38.41±1.42a黄芪皂苷Ⅱ低剂量组Astragaloside Ⅱlow-dose group 189.42±21.18b 132.95±11.34b 3.84±0.73b 39.81±8.43b 35.31±1.25b黄芪皂苷Ⅱ中剂量组Astragaloside Ⅱmedium-dose group 137.68±18.35bc 91.83±8.57bc 2.15±0.58bc 26.65±5.51bc 31.76±1.17bc黄芪皂苷Ⅱ高剂量组Astragaloside Ⅱhigh-dose group 73.54±14.62bcd 62.19±7.62bcd 1.03±0.34bcd 19.72±3.27bcd 30.15±1.03bcd地塞米松组Dexamethasone group 68.43±10.45bcd 56.51±5.29bcd 0.93±0.47bcd 17.98±2.18bcd 28.67±1.05bcd
2.3 黄芪皂苷Ⅱ对各组幼年大鼠BALF 上清液和血清中IL-6、IL-21 和TGF-β1 含量的影响
与对照组比,模型组各组幼年大鼠BALF 上清液和血清中IL-6、IL-21 和TGF-β1 含量显著升高(P<0.05);与模型组比,黄芪皂苷Ⅱ各处理组幼年大鼠BALF 上清液和血清中IL-6、IL-21 和TGFβ1 含量显著降低(P<0.05);且随着黄芪皂苷Ⅱ剂量的增加,幼年大鼠BALF 上清液和血清中IL-6、IL-21 和TGF-β1 含量依次降低(P<0.05)。 见表3、表4。
表3 各组幼年大鼠BALF 上清液中炎性细胞因子含量比较(±s,n=12)Table 3 Comparison of inflammatory cytokines in BALF supernatant of each group

表3 各组幼年大鼠BALF 上清液中炎性细胞因子含量比较(±s,n=12)Table 3 Comparison of inflammatory cytokines in BALF supernatant of each group
分组Groups白细胞介素-6(ng/L)IL-6白细胞介素-21(ng/L)IL-21转化生长因子-β1(ng/L)TGF-β1对照组Control group 14.36±1.84 17.93±1.03 15.43±1.48模型组Model group 83.72±6.34a 97.56±4.63a 78.62±5.31a黄芪皂苷Ⅱ低剂量组Astragaloside Ⅱlow-dose group 64.97±7.12b 71.42±4.87b 69.91±3.28b黄芪皂苷Ⅱ中剂量组Astragaloside Ⅱmedium-dose group 56.43±5.82bc 59.14±2.98bc 53.49±4.09bc黄芪皂苷Ⅱ高剂量组Astragaloside Ⅱhigh-dose group 38.77±3.49bcd 42.35±2.13bcd 38.47±2.56bcd地塞米松组Dexamethasone group 36.84±2.19bcd 37.73±1.56bcd 30.15±2.08bcd
表4 各组幼年大鼠血清中炎性细胞因子含量比较(±s,n=12)Table 4 Comparison of inflammatory cytokines in serum of young rats in each group

表4 各组幼年大鼠血清中炎性细胞因子含量比较(±s,n=12)Table 4 Comparison of inflammatory cytokines in serum of young rats in each group
分组Groups白细胞介素-6(ng/L)IL-6白细胞介素-21(ng/L)IL-21转化生长因子-β1(ng/L)TGF-β1对照组Control group 11.83±1.53 13.94±1.62 15.64±1.17模型组Model group 85.46±7.01a 76.32±5.95a 83.29±6.54a黄芪皂苷Ⅱ低剂量组Astragaloside Ⅱlow-dose group 74.25±5.26b 58.46±4.33b 61.47±4.21b黄芪皂苷Ⅱ中剂量组Astragaloside Ⅱmedium-dose group 47.64±4.68bc 41.75±4.02bc 49.38±3.86bc黄芪皂苷Ⅱ高剂量组Astragaloside Ⅱhigh-dose group 28.31±2.54bcd 36.82±3.28bcd 35.61±4.03bcd地塞米松组Dexamethasone group 23.86±3.05bcd 34.34±2.81bcd 32.75±2.59bcd
2.4 黄芪皂苷Ⅱ对各组幼年大鼠肺组织病理损伤的影响
HE 染色后,光学显微镜下可观察到:对照组幼年大鼠肺组织细胞排列整齐,结构完整,支气管平滑肌厚度正常,未见明显的炎性细胞浸润;模型组肺组织可见幼年大鼠肺组织结构异常,支气管上皮细胞脱落、水肿,管壁增厚,管腔狭窄,腔内有大量炎性细胞和黏液浸润;黄芪皂苷Ⅱ各处理组和地塞米松组幼年大鼠支气管上皮组织结构较为整齐清晰,管腔内炎性细胞浸润减小,管壁厚度趋于正常。与对照组相比,模型组幼年大鼠肺组织炎症评分显著升高(P<0.05);与模型组相比,黄芪皂苷Ⅱ各处理组幼年大鼠肺组织炎症评分显著降低(P<0.05);且随着黄芪皂苷Ⅱ剂量的增加,幼年大鼠肺组织炎症评分依次降低(P<0.05)。 见表5、图1。
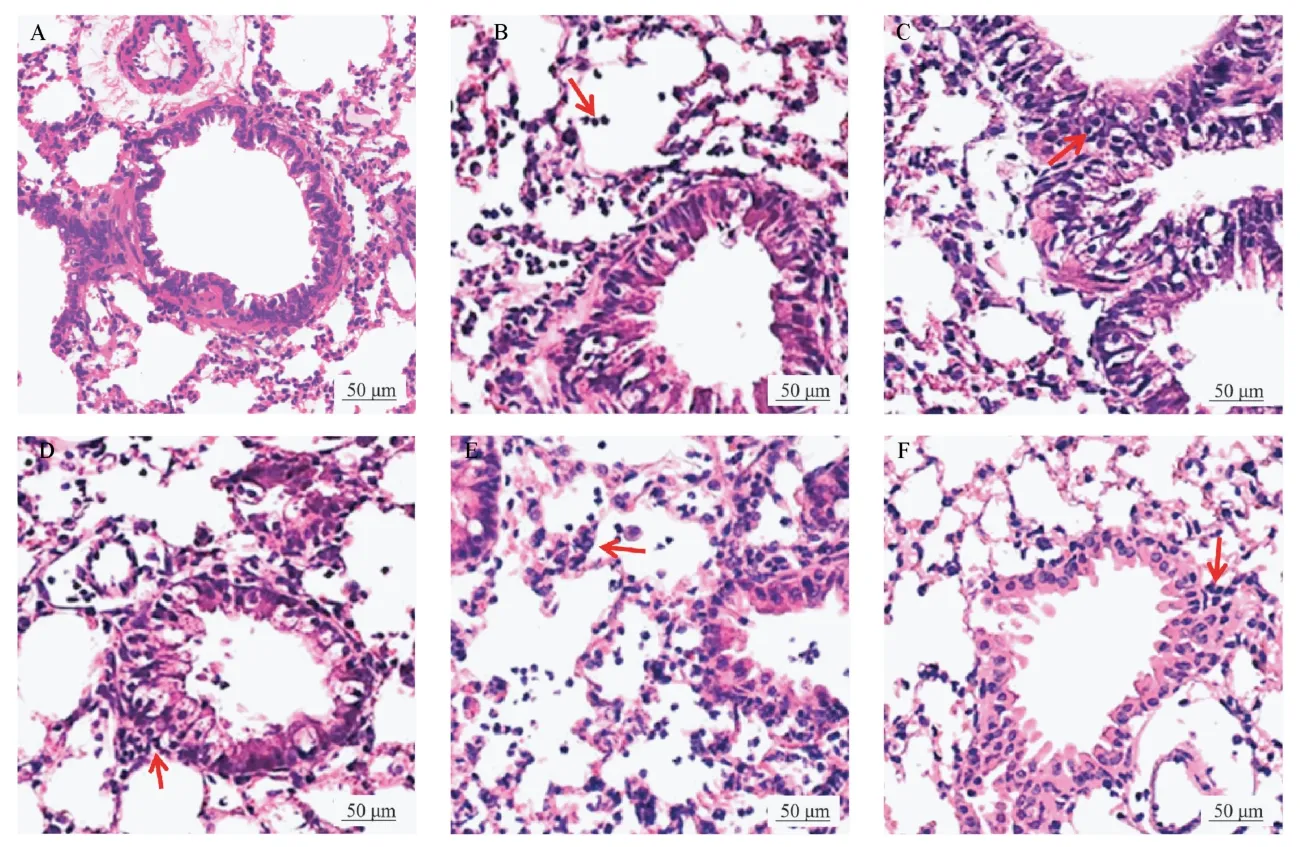
图1 各组肺组织HE 染色结果Note. A, Control group. B, Model group. C, Astragaloside Ⅱlow-dose group. D, AstragalosideⅡmedium-dose group. E, Astragaloside Ⅱhigh-dose group. F, Dexamethasone group.Figure 1 HE staining results of lung tissue in each group
表5 各组幼年大鼠肺组织炎症评分(±s,n=12)Table 5 Lung inflammation score of young rats in each group
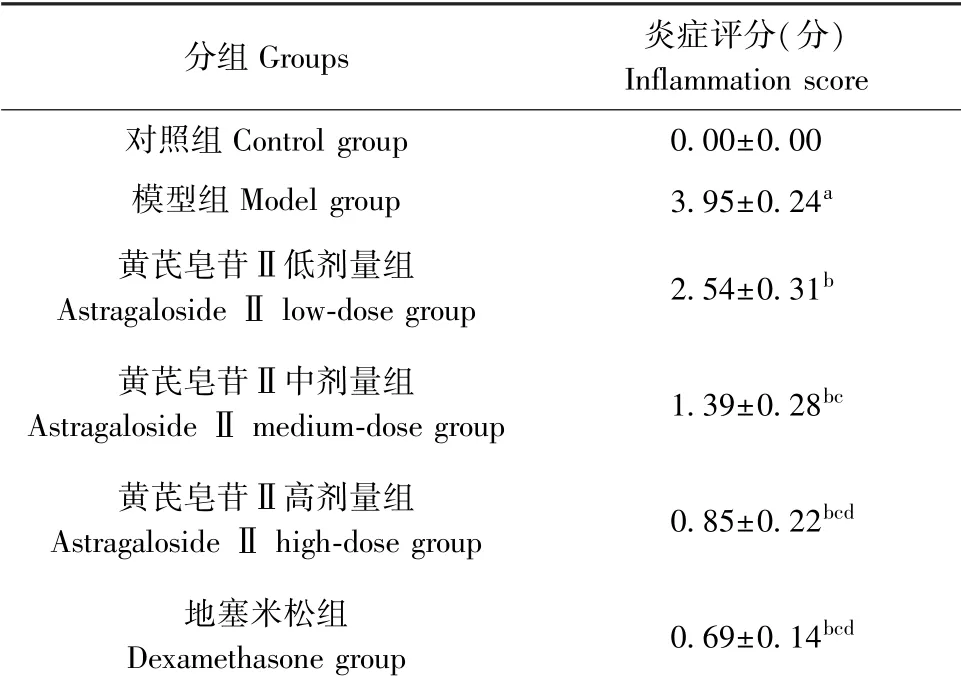
表5 各组幼年大鼠肺组织炎症评分(±s,n=12)Table 5 Lung inflammation score of young rats in each group
分组Groups 炎症评分(分)Inflammation score对照组Control group 0.00±0.00模型组Model group 3.95±0.24a黄芪皂苷Ⅱ低剂量组Astragaloside Ⅱlow-dose group 2.54±0.31b黄芪皂苷Ⅱ中剂量组Astragaloside Ⅱmedium-dose group 1.39±0.28bc黄芪皂苷Ⅱ高剂量组Astragaloside Ⅱhigh-dose group 0.85±0.22bcd地塞米松组Dexamethasone group 0.69±0.14bcd
2.5 黄芪皂苷Ⅱ对各组幼年大鼠肺组织IL-21、STAT3 蛋白水平的影响
与对照组相比,模型组幼年大鼠肺组织IL-21、p-STAT3 蛋白水平显著升高(P<0.05);与模型组相比,黄芪皂苷Ⅱ各处理组幼年大鼠肺组织IL-21、p-STAT3 蛋白水平显著降低(P<0.05);且随着黄芪皂苷Ⅱ剂量的增加,幼年大鼠肺组织IL-21、p-STAT3蛋白水平依次降低(P<0.05)。 见图2,表6。

图2 各组幼年大鼠肺组织蛋白印迹图Note. A, Control group. B, Model group. C, AstragalosideⅡlow-dose group. D,Astragaloside Ⅱmedium-dose group.E, Astragaloside Ⅱhigh-dose group. F, Dexamethasone group.Figure 2 Western blot of lung tissue of young rats in each group
表6 各组幼年大鼠肺组织IL-21、STAT3 蛋白表达水平检测结果(±s,n=12)Table 6 Detection results of IL-21 and STAT3 protein expression in lung tissue of young rats in each group
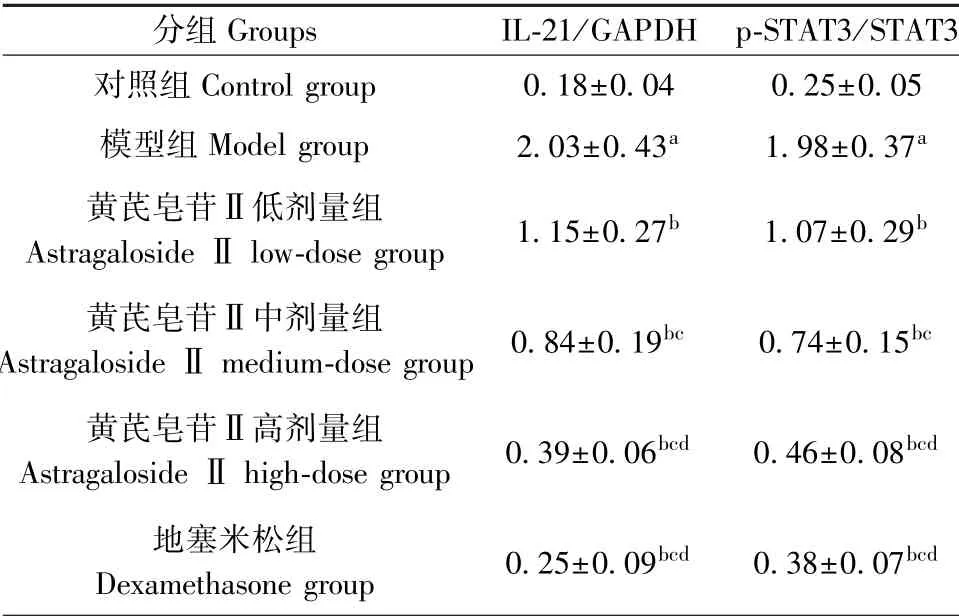
表6 各组幼年大鼠肺组织IL-21、STAT3 蛋白表达水平检测结果(±s,n=12)Table 6 Detection results of IL-21 and STAT3 protein expression in lung tissue of young rats in each group
分组Groups IL-21/GAPDH p-STAT3/STAT3对照组Control group 0.18±0.04 0.25±0.05模型组Model group 2.03±0.43a 1.98±0.37a黄芪皂苷Ⅱ低剂量组Astragaloside Ⅱlow-dose group 1.15±0.27b 1.07±0.29b黄芪皂苷Ⅱ中剂量组Astragaloside Ⅱmedium-dose group 0.84±0.19bc 0.74±0.15bc黄芪皂苷Ⅱ高剂量组Astragaloside Ⅱhigh-dose group 0.39±0.06bcd 0.46±0.08bcd地塞米松组Dexamethasone group 0.25±0.09bcd 0.38±0.07bcd
3 讨论
哮喘是一种以气道炎症、支气管高敏感性为特征的慢性疾病[16]。 哮喘气道炎症反应往往伴随各种炎症因子如IL-6、TGF-β1 等水平上调。 研究发现,地塞米松对哮喘具有明显的治疗作用[13],因此我们选用地塞米松作为本研究的阳性对照药物。血清中炎性因子IL-6、IL-21 和TGF-β1 及BALF 上清液中白细胞、嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞数量的检测可用来观察哮喘大鼠血液中及肺组织中的炎性因子及炎性细胞水平。 因此,在本研究中,我们利用OVA 诱导建立哮喘幼年大鼠模型,结果发现哮喘幼年大鼠呼吸急促,口唇发绀,明显烦躁不安,镜下可见肺组织结构损坏严重,炎性细胞大量浸润,且炎症评分升高,幼年大鼠在吸入不同浓度的Ach 激发后,其Penh 值显著升高,BALF 上清液和血清中IL-6、IL-21 和TGF-β1 含量显著升高,BALF 上清液中白细胞总数、嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞数显著升高,表明哮喘可引起幼年大鼠肺组织炎症反应,呼吸障碍,揭示模型建立成功。
黄芪是临床重用的中药材,黄芪皂苷Ⅱ是该药活性成分,具有免疫调节、抗炎、抗肿瘤等多种生物活性。 研究发现,黄芪可以调节呼吸道、消化道以及胃粘膜分泌功能,增强人体第一道防线,黄芪活性成分黄芪多糖能显著抑制IL-6、IL-1β、TNF-α 的分泌,治疗炎症反应[17-18]。 本研究采用黄芪皂苷Ⅱ对哮喘幼年大鼠进行药效学分析,研究结果显示,哮喘幼年大鼠经黄芪皂苷Ⅱ处理后,幼年大鼠肺组织结构较为正常,支气管腔内炎性细胞浸润明显减少,黏膜水肿改善,无明显脱落,肺组织炎症评分降低。 Ach 激发后Penh 值显著降低,BALF 上清液和血清中IL-6、IL-21 和TGF-β1 含量显著降低,BALF上清液中白细胞总数、嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞数显著降低,表明黄芪皂苷Ⅱ能明显抑制哮喘幼年大鼠的炎症反应,降低幼年大鼠气道反应性,减轻肺组织病理损伤,且随着药物剂量增大,效果更加显著。
气道炎症是哮喘的典型特征,缓解炎症反应可有效控制哮喘症状。 近年来发现,在多种与免疫有关的疾病中,IL-21 表达明显上调[19-20]。 STAT3 蛋白是IL-21 的主要信号传导因子,其磷酸化活化后可参与多种自身免疫性疾病产生和进展过程[10]。本研究结果说明在哮喘幼年大鼠体内,IL-21/STAT3通路被激活,可能与炎症反应与免疫反应增强,肺组织受损有关。 吴爱祥[21]研究发现黄芪甲苷可通过抑制STAT3 通路,减轻炎性因子MCP-1 水平。
本研究中黄芪皂苷Ⅱ可下调哮喘幼年大鼠体内IL-21 蛋白表达及STAT3 磷酸化水平,表明黄芪皂苷Ⅱ可调节IL-21/STAT3 信号通路,因此我们推测黄芪皂苷Ⅱ减轻幼年大鼠哮喘症状,减少炎症反应等功能可能与抑制IL-21/STAT3 通路活化有关。
综上所述,黄芪皂苷Ⅱ可能通过抑制IL-21/STAT3 通路,减轻哮喘幼年大鼠哮喘症状及气道炎症,修复肺组织功能,为临床治疗哮喘提供了新思路,但具体机制仍需进一步研究。
