原位针刺开窗在保留左锁骨下动脉的胸主动脉腔内修复术中的应用
2022-01-17王洛波王兵杨彬秦委委许飞王旭
王洛波,王兵,杨彬,秦委委,许飞,王旭
(1.山东省济宁市第一人民医院血管外科/济宁医学院第一临床学院,山东济宁272000;2.郑州大学第五附属医院血管外科,河南郑州450000)
近些年,随着微创理念与技术的发展,主动脉疾病的治疗模式发生了巨大改变[1],腔内治疗被广泛应用于主动脉疾病,该技术也得到很多指南的推荐,特别是复杂的B 型主动脉夹层[2-3]。而针对近端锚定区不足,支架移位,逆撕等问题,主动脉腔内原位开窗技术凭借较高的成功率和较少的并发症在临床上得到越来越多的应用[4-5]。主动脉原位开窗针作为一种新型的开窗器械,山东省济宁市第一人民医院在2017年2月—2019年12月使用主动脉原位针刺开窗行保留左锁骨下动脉(left subclavian artery,LSA) 的胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)25 例,近期随访效果满意,报告如下。
1 资料与方法
1.1 一般资料
本研究的纳入标准:⑴锚定区<15 mm,或存在主动脉夹层、穿透性主动脉溃疡、动脉瘤或假性动脉瘤累及LSA;⑵LSA 与主动脉弓的夹角>45°,并且在LSA 近端没有明显的弯曲[6]。排除标准:⑴涉及升主动脉的病变;⑵不适合行TEVAR 的解剖结构,如LSA 严重迂曲和狭窄或主动脉锚定区直径非常大;⑶起源于主动脉弓的优势左椎动脉;⑷肾功能不全或严重心肺疾病无法耐受全身麻醉;⑸有足够锚定区的B 型夹层[7]。
根据上述标准,对我院2017年2月—2019年12月采用原位针刺开窗行TEVAR 患者的临床资料进行分析,共纳入25 例患者,男22 例(88%),女3 例(12%);年龄45~68 岁,平均(62.1±11.2)岁。患者的其他基本资料见表1。
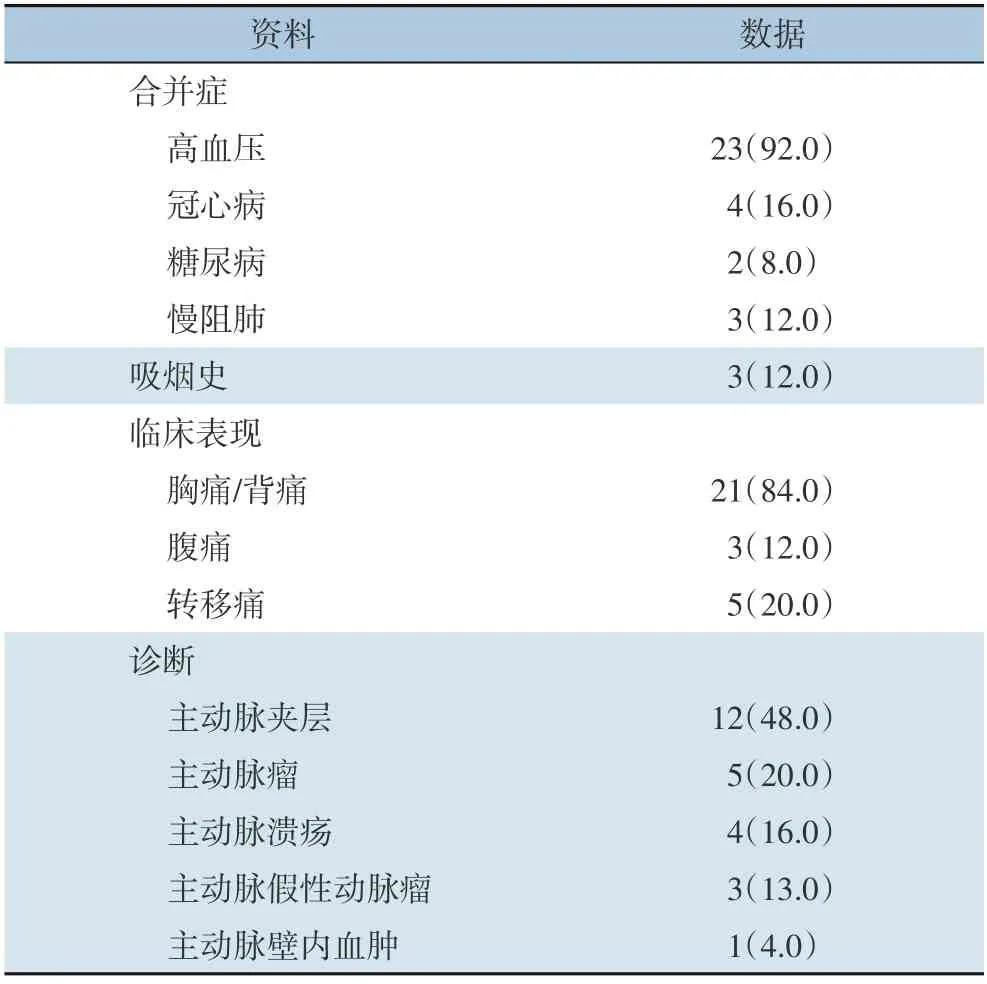
表1 患者的一般资料[n(%)]Table 1 The general data of the patients[n(%)]
1.2 手术方法
所有的患者均在复合手术室接受全身麻醉,消毒铺巾左上肢和腹股沟区,通过手术暴露或经皮穿刺股动脉,同时纵向切开左肘窝,暴露左肱动脉。首先,通过穿刺鞘从左肱动脉引入1 个8 F或9 F、55 cm 长的Fustar 可调弯鞘,回撤到左侧锁骨下动脉开口处,然后,将血管造影导管从股动脉引入主动脉。进行血管造影来评估明确主动脉病变位置、大小及累及范围,并评估双侧椎动脉优势。引入主动脉支架至主动脉弓,并在计划的锚定区释放,并覆盖LSA。经Fustar 可调弯鞘管引入先健Futhrough 穿刺针(深圳先建)抵住胸主动脉支架,多角度转动C-臂,确保可调弯鞘头端在主动脉弓平行位和切线位的平面上都能垂直于胸主动脉覆膜支架,将LSA 穿刺装置上的球囊充盈,针头被固定在左锁骨下动脉血管的中心,这是确保可以精确穿刺支架的关键一步。击穿刺针行原位开窗,穿刺过程中若突然有落空感,应立即停止穿刺针穿刺,避免造成对侧血管壁的损伤,并立即行造影证实是否开窗成功。然后,导丝穿过穿刺孔进入主动脉腔。从1 个直径为3 mm 的Sterling 球囊(波科,美国)开始连续扩张,随后逐渐交换Advance 球囊(Cook,美国);直径为5~8 mm,通常最大直径的球囊比接下来植入的分支支架直径小1~2 mm,以便开窗与分支支架之间的连接更牢固。在开窗球囊扩张后,从肱动脉引入1 个Fustar 可调弯鞘,以保护分支支架,无论是裸支架还是覆膜支架,当其穿过开窗孔位并释放时,近端10 mm 段伸入主动脉腔,远端固定在LSA(图1)。最后,如有必要,用同等直径的球囊扩张支架,并进行血管造影检查手术结果,了解各分支动脉的通畅情况及支架有无移位、狭窄及有无内漏。最后拔除鞘管,使用ProGlide 血管缝合器(雅培,美国)缝合股动脉穿刺口,一次性股动脉绷带加压包扎。6-0 普洛伦线缝合左肱动脉,止血后逐层缝合切口。
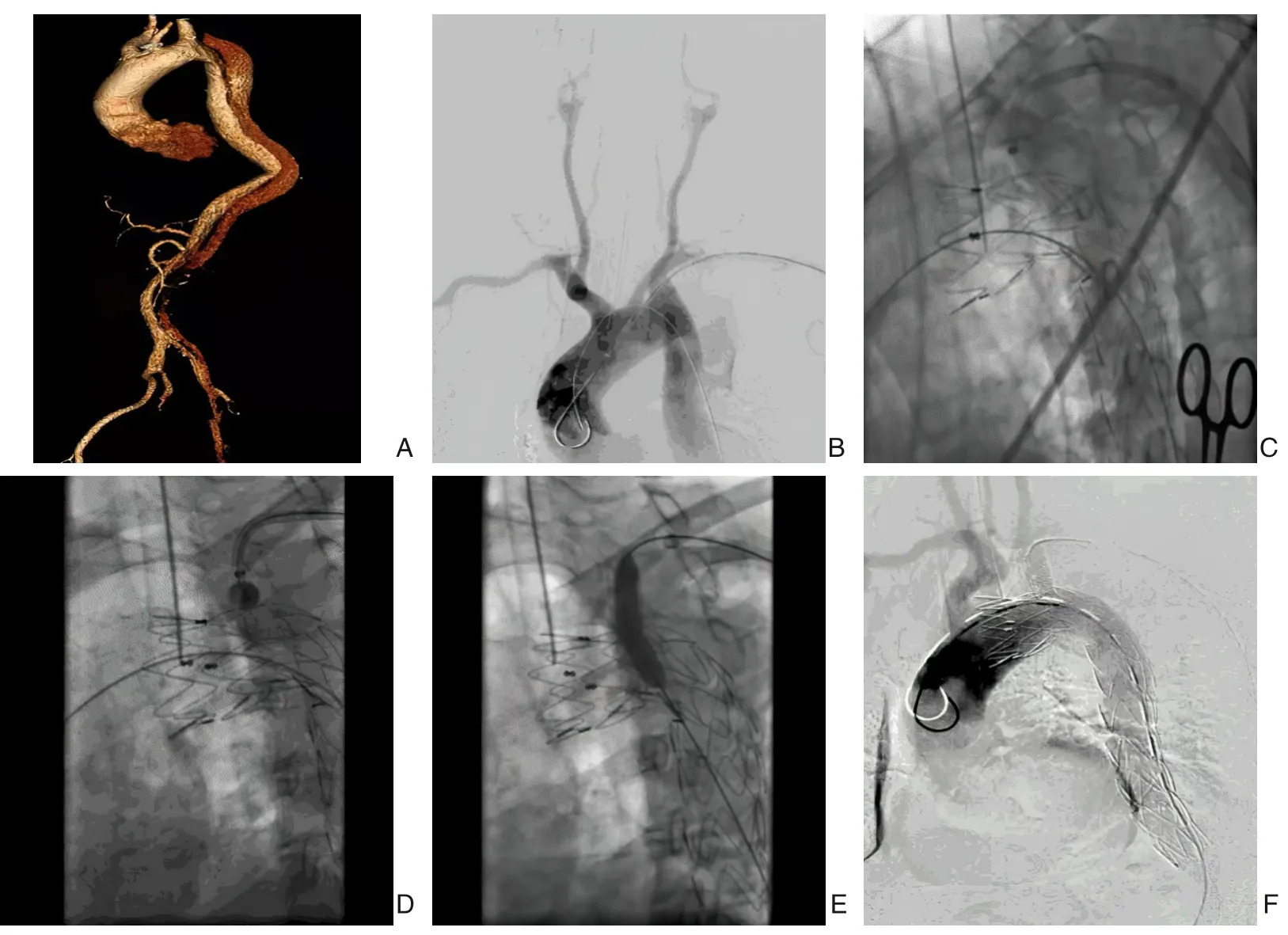
图1 术中影像资料A:CTA显示胸主动脉夹层的病变情况;B:血管造影来评估明确主动脉病变情况;C:已释放主体支架;D:将穿刺装置上的球囊充盈,针头被固定;E:球囊开始连续扩张;F:术后造影显示已置入分支动脉支架重建LSAFigure 1 Intraoperative imaging dataA:CTA showing the range of the thoracic aortic dissection;B:Angiography for determination of the thoracic aortic dissection; C:View after releasing the main stent; D: Filling the balloon in the puncture device and fixation of the needle;E:Continuous expansion of the balloon;F:Postoperative angiography showing the reconstructed LSA after the branch stent placement
1.3 随访观察
出院后的1、3、6、12 个月及随后的每年,对患者进行随访。主要通过复查主动脉CTA,评估患者支架有无移位、变形及支架的通畅性、真假腔的变化、有无新发夹层和动脉瘤及内漏的发生。通过颅脑CT 和神经系统的体格检查,评估患者是否合并新发的严重神经系统并发症。
2 结果
2.1 手术情况
25 例患者中24 例患者(96.0%) 成功进行了TEVAR 术和使用原位针刺技术进行开窗并成功保留了LSA,另外1 例患者的技术失败是由于尽管对支架进行了开窗,但无法对LSA 进行支架植入,故保留导丝行“烟囱”技术进而保留LSA。此外还有1 例患者因经济原因,开窗成功后未行LSA 支架植入术,故适当扩大开窗直径,随访12 个月时,其LSA 灌注良好。因此,本研究共使用23 枚支架植入LSA,13 枚覆膜支架,10 枚裸支架。手术及术后相关的资料见表2。
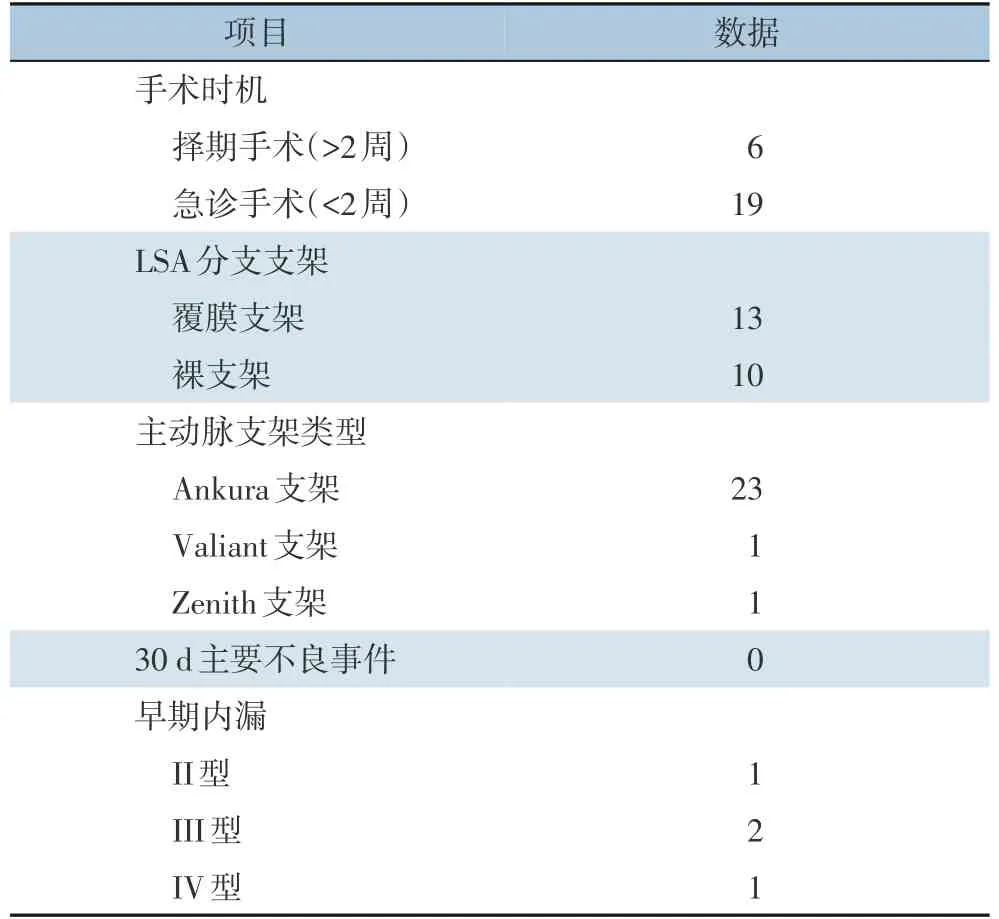
表2 手术及术后相关资料(n)Table 2 The surgical and perioperative data(n)
2.2 术后随访情况
所有的患者在30 d 内均未发生围术期重大不良事件(死亡,中风或截瘫),双侧肱动脉切口愈合良好,所有患者的左桡动脉搏动正常。无I 型内漏,II、II、IV 型内漏分别为1、2、1 例,对这些患者,停止使用抗血小板药物,并严格控制血压。本研究25 例患者术后均获得随访,随访时间6~31 个月,中位随访时间13 个月,所有的II 型、III 型和IV 型内漏在中位随访13 个月时消失,主体支架及分支支架形态良好,无明显狭窄或移位(图2)。

图2 术后1 个月复查主动脉CTA,主体及分支支架形态良好无移位、变形Figure 2 CTA at 1 month after surgery showing were the good shape of the main stent and branch stents without obvious displacement or deformation
3 讨论
尽管开放手术仍然作为主动脉病变的标准术式,但其相对较高的病死率和并发症以及手术难度限制了开放手术的广泛应用[8-9]。腔内器械及手术技巧的发展为主动脉疾病提供了新的治疗选择,TEVAR 技术通过微创从股动脉导入人工血管支架,到达预定破口位置后迅速打开支架进行修复[10]。由于其创伤小、恢复快、效果确切的特点,已经成为治疗胸主动脉扩张性疾病的主流方法,并得到相关指南的推荐[11-12]。
TEVAR 的首要条件是在病变两端有一段≥1.5 cm的正常血管作为锚定区[13]。但在临床上,部分患者的破口位置距离其颈动脉、锁骨下动脉和无名动脉很近,甚至可能跨过主动脉弓到达升主动脉,由于缺乏足够的锚定区而无法行TEVAR 术。近端锚定区不足限制了TEVAR 术的广泛开展[14]。因此,保留弓上分支动脉血供是TEVAR 的难点[15]。目前预开窗、“烟囱”、杂交和原位开窗技术的应用拓展了TEVAR 的适应证,但都存在一定弊端[16]。预开窗是根据术前CTA 的测量结果,在支架上标记后开孔。但整个系统再次组装过程可能发生支架本身和标记材料的扭曲,增加定位和选择的难度。开窗后支架整体强度可能降低。开孔连续锁边缝合有助于提高强度,但加固强度取决于缝合技巧[17]。“烟囱”是通过分支动脉释放1 枚与主动脉内支架平行的覆膜支架或裸支架,有助于延长近端锚定区,从而拓展TEVAR 的应用范围。主动脉支架和烟囱支架之间会存在缝隙,导致内漏发生率较高,影响远期效果[18]。杂交手术是传统手术和腔内微创技术结合,治疗累及弓上分支的扩张性疾病。其充分拓展锚定区,但该技术仍有一定创伤,可能的严重并发症是移植物感染,虽不多见,但一旦发生即是灾难性后果[19]。原位开窗技术是在植入支架完全覆盖病变后,通过分支动脉破膜开窗,并保留其血供。相对于传统的预开窗技术,原位开窗不需要对位,方便使用[20]。Shu 等[21]研究对比了烟囱技术、预开窗技术和原位开窗技术,研究发现原位开窗在主动脉弓部病变的腔内治疗中有着巨大潜力,当主动脉近端破口非常靠近分支动脉时,烟囱技术、预开窗都容易发生内漏,而原位开窗相对较小,可以防止内漏的发生。
目前原位开窗的方法可以分为机械开窗(针刺开窗)和物理开窗(激光和射频)[22]。激光和射频在破膜的时候烧灼可能产生血凝块,从而存在一定的栓塞风险[23]。Luo 等[24]的一项研究纳入了50 例行原位针刺TEVAR 的患者,其中期随访表明针刺开窗安全可行,同时根据他们的经验,原位针刺开窗可能有助于降低围手术期的并发症。但通常LSA 从主动脉发出的角度较小,部分复杂的解剖条件并不利于穿刺针进行破膜,对此笔者使用Futhrough 破膜系统和Fustar 可调弯鞘组成血管腔内穿刺系统进行原位开窗,其穿刺针中空,穿刺后可顺利通过0.018 英寸导丝;同时穿刺深度可调节,避免破膜后过深损伤对侧血管壁;再结合使用Fustar 可调弯鞘,头端角度可调整,其内穿刺针相应角度调整,保证穿刺垂直进针,提高穿刺成功率。通过这些器械的辅助,缩短了手术时间,同时减少了造影剂的用量。
当前应用于原位开窗的支架主要有Relay、Valiant、Hercules、TAG 以及Ankura 支架。Li 等[25]的一项研究表明,Relay 支架对球囊扩张的抵抗力最强;Ankura 支架窗孔质量最佳,不伴有纤维材料撕裂;而TAG 支架有时在大直径球囊(≥6 mm)扩张后出现裂隙样改变。原位开窗应考虑对支架材料的损伤,聚酯和ePTFE 支架在开窗的质量方面表现不同。在本研究中使用最多的是Ankura 支架,其覆膜材料为ePTFE,23 例支架均破膜成功,同时在本研究的长期随访中其形态稳定,窗口无明显回缩。
在主体支架开窗后,通常会植入1 枚分支支架不仅可以稳定窗口并维持血流的通畅性,还可以降低主体支架移位概率。国外Tse 等[26]在LSA 上使用的是Advanta V12 支架,具有较好的抗错位能力,但国内暂未上市。国内王利新等[27]使用Viabahn 自膨式覆膜支架加球扩式裸体支架进行加固。本研究13 例均选用Fluency 自膨式覆膜支架,在随访期间未发现内漏及支架的移位。与烟囱和体外开窗不同,原位开窗相对较小,主体支架与分支支架的连接相对紧密,一般不容易发生内漏,并且术后的血流动力学符合生理,因此本研究有10 例患者植入Express LD 裸支架,术后随访显示支架无明显移位,无内漏发生。尽管球囊逐级扩张以扩大开窗,但不规则形状的开窗有时仍会使长鞘或分支支架难以穿过开窗,在本研究中遇到1 例术中支架难以通过开窗,遂保留导丝,行紧急烟囱技术保留LSA。原位开窗的一个优势就是如果分支血管重建失败,可以迅速转为烟囱等技术,除此以外,原位开窗无需特殊定制和精准的术前测量,可以直接利用现有的器材保留重建分支血管。
本研究结果显示,在随访期间(6~31 个月)所有患者的主体支架及分支支架形态良好,无明显狭窄或移位。Shang 等[28]于2018年发表了10 例针刺原位开窗的系列报道,共纳入10 例患者,其手术全部成功,无卒中、内漏等并发症出现。整体来讲,原位开窗技术的发展逐步成熟,但需要注意的是原位开窗技术是对现有支架的超适应证应用,其对支架的完整性有所破坏,因此仍需进一步随访评估支架的稳定性[29]。Kasprzak 等[30]利用无名动脉和左颈总动脉双开窗技术行主动脉腔内隔绝,随访长达5年,主体支架的形态良好,分支支架通畅。
原位针刺开窗在行保留LSA 的TEVAR 术中是可行和有效的,短期随访令人满意;同时新型开窗针的应用使得这一技术操作相对简便,无需特殊的支架定制。尽管如此,原位开窗是一种超适应证技术,可能影响支架移植物的长期耐久性。目前开展针刺开窗技术的单位相对较少,未来仍需要更多的病例数据和更长期的随访结果来验证这一技术的疗效。
