沉默HDAC9对牙周膜干细胞增殖与成骨分化的影响
2022-01-17戈文斌张琨罗世通周治刘亚丽
戈文斌,张琨,罗世通,周治,刘亚丽
1.昆明医科大学附属口腔医院正畸科,云南 昆明(650106);2.云南大学附属医院正畸科,云南 昆明(650021)
牙周炎是以牙周组织的破坏为主要表征的炎症感染性疾病,严重威胁人类口腔健康[1],对受损牙周组织的修复再生是牙周炎治疗的研究热点[2]。作为牙周组织来源的干细胞,牙周膜干细胞(periodontal ligament stem cells,PDLSCs)在牙周组织抗炎及骨量的维持和修复方面具有重要作用[3],是牙周组织损伤修复再生的主要候选细胞[4]。采取适当的策略,提高PDLSCs的生物学性能,具有重要的意义。表观遗传可以调控基因和蛋白的表达水平及功能而无需改变DNA序列,从而对细胞的增殖与分化产生影响,进而影响机体发育与疾病的进展和转归,参与转录激活和抑制的蛋白因子在其中起到重要作用[5]。组蛋白去乙酰化酶(histone deacetylases,HDACs)是重要的表观遗传调控分子,可以去除组蛋白赖氨酸侧链上的乙酰基,逆转染色质的开放状态,使染色质结构浓缩,从而阻遏基因的转录[6]。在细胞的增殖、分化等过程中,HDAC家族通过调控组蛋白的乙酰化水平发挥重要作用[7-8]。研究发现牙周炎患者牙周组织中HDAC9表达上调,提示HDAC9可能参与了牙周炎的进展过程[9]。但HDAC9在牙周组织损伤修复再生方面的研究较少,本研究通过RNA干扰技术沉默PDLSCs中HDAC9的表达,探讨HDAC9对PDLSCs增殖与成骨分化的影响,旨在为干细胞应用于牙周疾患的治疗提供新的视角和策略。
1 材料和方法
1.1 主要试剂与仪器
α-MEM培养基(SH30265.01B,Hyclone,美国),胎牛血清(AC03L055,上海李记生物科技有限公司,中国),CD34抗体(CD34-581-01)、CD45抗体(MHCD4501)、CD90抗体(A15794)、CD105抗体(MHCD10504)(Thermo Scientific,美国),siHDAC9序列及其阴性对照siNC序列(上海吉玛,中国),细胞周期试剂盒(MA0334,大连美仑,中国),CCK-8试剂盒(MA0218,大连美仑,中国),兔抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(10205-2-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(10494-1-AP)(Proteintech,中国),兔抗人RUNX2抗体(A2851,ABclone,中国),山羊抗兔二抗(511203,成都正能,中国),成骨诱导分化培养基试剂盒(HUXMA-90021,Cyagen,美国),总RNA提取试剂盒(LS1040,Promega,美国),反转录试剂盒(RR047,Takara,日本),qRT-PCR荧光染料试剂盒(RR820,Takara,日本),引物合成(上海生工,中国),流式细胞仪(CyFlow®Space,Partec,德国),酶标仪(Multiskan MK3,Thermo Scientific,美国),凝胶成像仪(ChemiDocTMXPS+,Bio-Rad,美国),实时荧光定量PCR仪(QuantStudio5,Applied Biosystems,美国)。
1.2 方法
1.2.1 PDLSCs体外培养与鉴定 取得昆明医科大学附属口腔医院伦理委员批准(伦理号:KYKQ2021MEC028)并经患者知情同意,收集12~20岁患者的因正畸治疗而拔除的健康前磨牙。酶解组织块法原代培养PDLSCs,当细胞密度达70%以上时,采用有限稀释克隆法纯化并扩增细胞。取第3代PDLSCs,胰酶消化,含2%胎牛血清的磷酸盐缓冲液(phosphate buffered saline,PBS)调整细胞浓度为1×106个/mL,分装至EP管中,加入相应的CD34、CD45、CD90、CD105抗体,4℃避光孵育0.5 h,含2%胎牛血清的PBS洗2次并重悬,流式细胞仪测定CD分子的表达。
1.2.2 细胞转染 由上海吉玛公司构建实验所需的siHDAC9和siNC序列,取第3代PDLSCs,接种到6孔板中,当PDLSCs密度达70%以上时,饥饿12 h,分为siNC组和siHDAC9组,使用Lipofectamine 2000转染相应的siRNA。转染24 h后,qRT-PCR测定干扰效果。siRNA序列和引物序列见表1。
1.2.3 细胞增殖检测 ①流式细胞术检测细胞周期:siNC组和siHDAC9组分别转染相应的siRNA。转染48 h后,胰酶消化收集各组细胞,4℃下75%冷乙醇固定18 h,加入染色工作液(按染色缓冲液∶碘化丙啶染色液∶RNase A=100∶5∶2的比例配制),37℃孵育0.5 h,试验重复3次(n=3),流式细胞仪检测并分析。
②CCK-8检测细胞增殖活性:以每孔3×103个细胞的量接种PDLSCs到96孔板中,分别转染siHDAC9与siNC,设5个复孔,并设调零孔,置于37℃、5%CO2孵箱中培养,分别于转染1、2、3、4 d后取出细胞,加入含CCK-8的培养基,37℃孵育2 h,酶标仪测定450 nm时的OD值,绘制生长曲线。
③Western blot检测PCNA的蛋白表达:转染48 h后,提取各组总蛋白,将蛋白等质量上样电泳,湿转法转膜,封闭液封闭0.5 h,加入相应一抗,4℃过夜孵育,加入二抗孵育1.5 h,在凝胶成像仪中显影,保存图片并分析。
1.2.4 成骨分化检测 ①qRT-PCR检测RUNX2、ALP的mRNA表达:转染24 h后,加入成骨诱导液开始诱导培养,每2~3 d更换1次诱导液。诱导7 d后,提取各组总RNA,测定总RNA浓度,将RNA反转录成cDNA,配制qRT-PCR的反应液,对mRNA的表达进行定量。计算相对表达量。引物序列见表1。
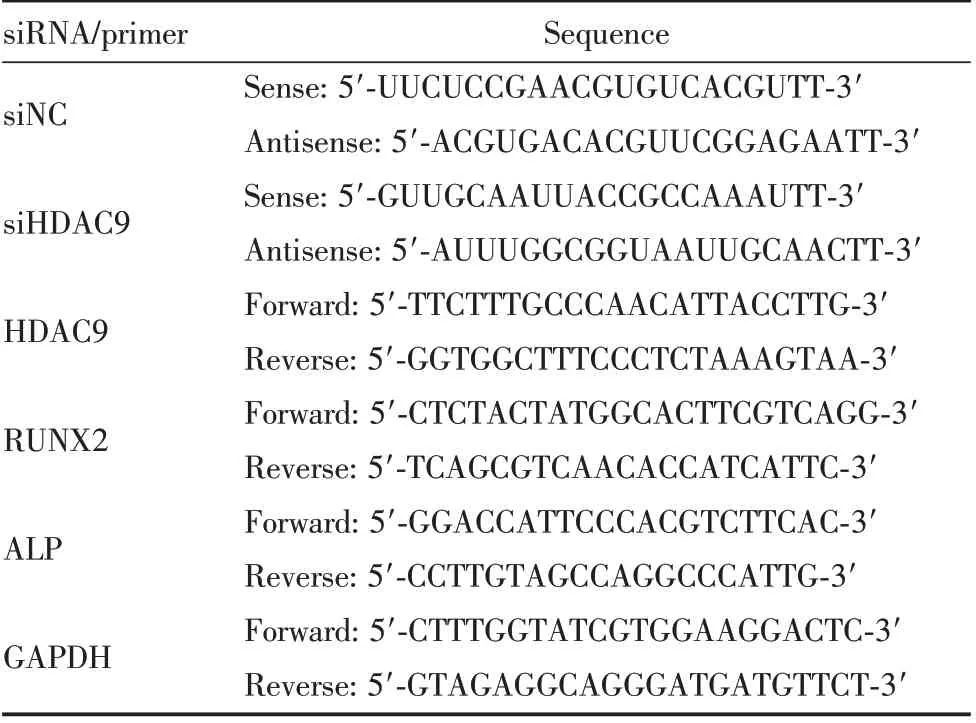
表1 siRNA序列和qRT-PCR引物序列Table 1 Sequences of siRNA and qRT-PCR primers
②Western blot检测RUNX2的蛋白表达:诱导7 d后,提取各组总蛋白,Western blot检测RUNX2的蛋白表达。
③茜素红染色:14 d后,4%中性甲醛溶液室温固定0.5 h,茜素红室温染色5 min,PBS洗3次,观察染色效果并拍照。
1.3 统计学分析
统计学软件SPSS 26.0进行数据分析,两组间的差异用t检验进行比较,P<0.05为差异有统计学意义。
2 结果
2.1 PDLSCs体外培养与鉴定
原代细胞从组织块周围爬出,呈纺锤形,成簇生长(图1a);细胞传代后状态良好,呈长梭形,放射状或旋涡状簇集生长,逐渐融合成片(图1b)。
Figure 1 Cultivation of PDLSCs图1 PDLSCs的培养
流式细胞术测定结果显示,所培养的细胞阴性表达CD34(0.72%)(图2a)、CD45(1.08%)(图2b),阳性 表达CD90(97.84%)(图2c)、CD105(98.02%)(图2d),与PDLSCs表型相符,说明细胞为间充质来源。

Figure 2 Identification of PDLSCs by flow cytometry图2 流式细胞术鉴定PDLSCs
2.2 转染后HDAC9的mRNA表达
转染24 h后,通过qRT-PCR检测HDAC9 mRNA表达,相较于siNC组,siHDAC9组PDLSCs中HDAC9 mRNA表达降低(t=13.431,P<0.01),表明沉默有效(图3)。

Figure 3 Relative mRNA expression of HDAC9 after transfection图3 转染后HDAC9 mRNA表达
2.3 细胞增殖检测
2.3.1 流式细胞术检测细胞周期 转染48 h后流式细胞术检测细胞周期,siHDAC9组PDLSCs增殖指数PI(S期+G2/M期细胞占比)(37.64±0.53)%大于siNC组(33.52±0.44)%(t=-10.352,P<0.01)(图4)。
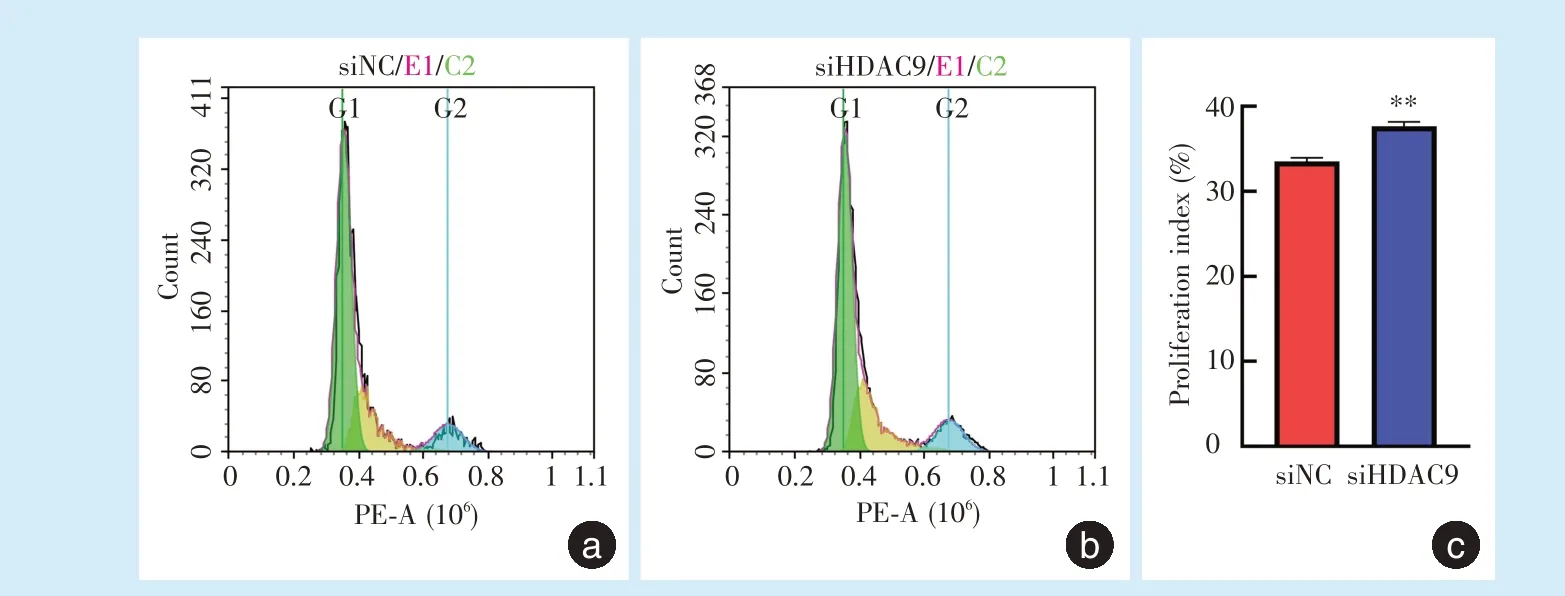
Figure 4 Cell cycle of PDLSCs after HDAC9 silencing图4 HDAC9沉默后PDLSCs细胞周期
2.3.2 CCK-8检测细胞增殖活性 CCK-8检测结果显示,1 d时,2组PDLSCs的OD值差异无统计学意义(P>0.05);2、3、4 d时,siHDAC9组PDLSCs的OD值高于siNC组(P<0.05),siHDAC组PDLSCs增殖活性较强(图5)。
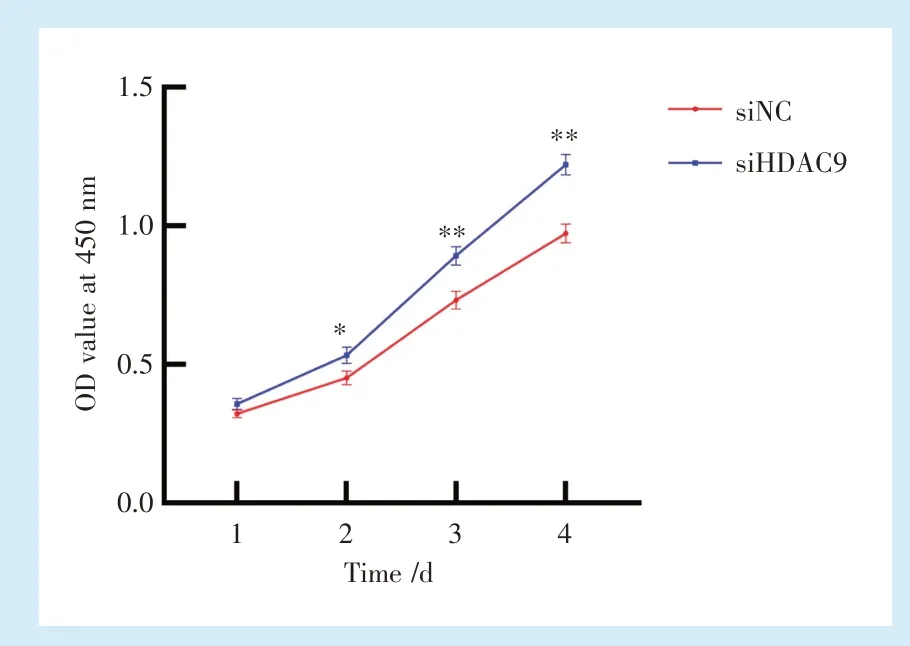
Figure 5 Proliferation of PDLSCs after HDAC9 silencing图5 HDAC9沉默后PDLSCs细胞增殖活性
2.3.3 Western blot检测PCNA的蛋白表达 转染48 h后,Western blot检测PCNA的蛋白表达,结果显示,siHDAC9组PCNA蛋白表达高于siNC组(t=-13.267,P<0.01)(图6)。
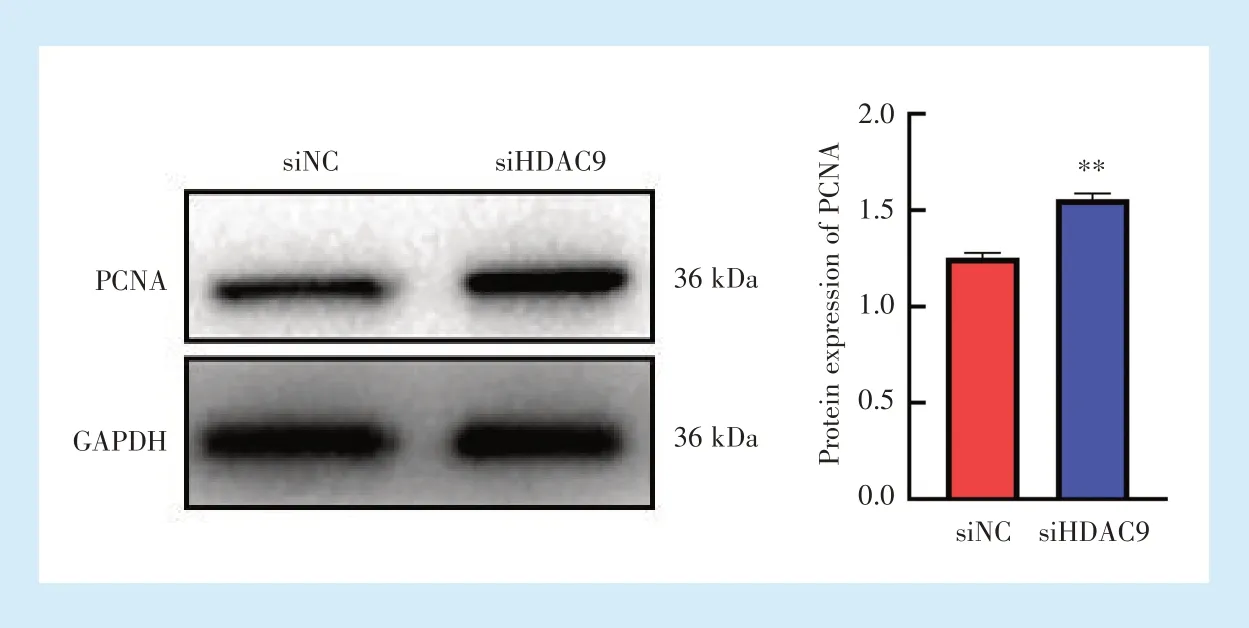
Figure 6 Protein expression of PCNA after HDAC9 silencing图6 HDAC9沉默后PCNA蛋白表达
2.4 成骨分化检测
2.4.1 qRT-PCR检测RUNX2、ALP的mRNA表达 成骨诱导7 d,qRT-PCR检测RUNX2、ALP的mRNA表达,与siNC组比较,siHDAC9组RUNX2 mRNA表达上调(t=-16.719,P<0.01),ALPmRNA表达上调(t=-4.152,P<0.05)(图7)。
2.4.2 Western blot检测RUNX2的蛋白表达 成骨诱导7 d,Western blot检测RUNX2的蛋白表达,结果显示,siHDAC9组高于siNC组(t=-15.726,P<0.01)(图8)。
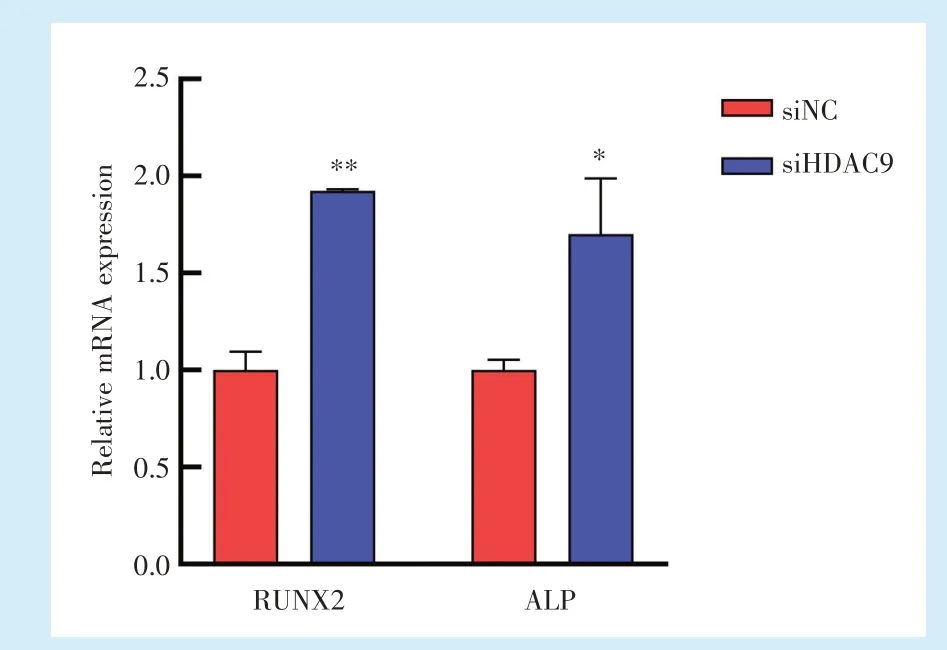
Figure 7 Relative mRNA expression of RUNX2 and ALPafter HDAC9 silencing图7 HDAC9沉默后RUNX2、ALPmRNA相对表达量

Figure 8 Protein expression of RUNX2 after HDAC9 silencing图8 HDAC9沉默后RUNX2的蛋白表达量

Figure 9 Alizarin red staining after HDAC9 silencing图9 HDAC9沉默后茜素红染色
2.4.3 茜素红染色 成骨诱导14 d,茜素红染色观察,结果显示,siHDAC9组的显色程度高于siNC组,显微镜下可见siHDAC9组的矿化结节多于siNC组(图9)。
3 讨论
牙周炎的传统治疗方法虽能控制炎症,阻断或延缓疾病的进展,但对缺损牙周组织的修复效果欠佳。因而,控制疾病的进展、修复受损的牙周组织是牙周炎治疗的难点,寻求稳定而可靠的再生技术具有重要的意义[2]。牙周膜干细胞(periodontal ligament stem cells,PDLSCs)作为一种间充质来源的干细胞,具有高度增殖和多向分化能力[10],在修复与再生领域受到广泛关注[11]。Liu等[12]从小型猪拔除的牙齿中获取自体PDLSCs并用于治疗牙周缺损,发现PDLSCs能够再生因牙周炎而受损的牙周组织。因此,干细胞疗法能够有效促进受损组织的再生,这为牙周炎的治疗提供了一种新的思路[13]。采取适宜的策略,对PDLSCs生物学特性进行维系和改进,对应用其进行损伤修复具有重要价值。
RNA干扰现象是一种基因转录后沉默的现象,其中siRNA可作为介导子降解相应的mRNA,从而阻遏基因的表达。RNA干扰技术利用此现象设计特异性siRNA用于沉默相应基因的表达,与其他基因敲除方法相比,其不仅操作较为简便,价格实惠,且具有高度的特异性[14]。
脂质体转染法是利用脂质体携带目的分子通过膜融合或直接穿膜的方式将目的分子转染进细胞中的方法,与病毒转染法、电穿孔转染法等其他转染方法相比,其具有易于操作、重复性高、对细胞损害小等优点[15]。本实验利用RNA干扰技术构建HDAC9的siRNA并用Lipofectamine 2000将其转染至PDLSCs中,然后通过qRT-PCR检查干扰效果,发现siRNA联合脂质体转染能够有效降低HDAC9的表达,可为相关实验奠定良好的基础。
PDLSCs的增殖与成骨分化潜力对其骨量维持和修复功能的发挥至关重要[3,16]。在诸多生理病理过程中,一系列的相关因子参与其中,可通过调控某些关键因子,维系和改进PDLSCs的增殖与成骨分化潜力。表观遗传在疾病的进展与转归中扮演着重要的角色[17]。包括HDAC9在内的HDACs作为表观遗传中蛋白乙酰化水平的重要调控因子,可参与诸多细胞的生物学过程。本实验选取能够在核质间穿梭的Ⅱ类HDACs HDAC9探讨其对基于PDLSCs的损伤修复的影响。
Rastogi等[18-19]研究发现,miR-377的表达下调可使HDAC9的表达上调,进而促进细胞的增殖,促进口腔鳞状细胞癌的进展;而使用siRNA下调HDAC9的表达,则可导致G0/G1期细胞阻滞,抑制细胞的增殖,抑制口腔鳞状细胞癌的进展。然而有趣的是,Luo等[20]采用一定浓度的HDAC抑制剂刺激牙髓干细胞(dental pulp stem cells,DPSCs)后,发现HDAC9等HDACs的表达被抑制,组蛋白H3和H4的乙酰化水平升高,而DPSCs增殖能力上调,提示HDAC9表达的下调对DPSCs的增殖或起到一定的促进作用。在对细胞成骨分化的调控方面,HDAC9似乎也表现出不同的作用。Chen等[21]研究发现,HDAC9的高表达可促进RUNX2对骨桥蛋白(osteopontin,OPN)基因转录的启动,增强间充质干细胞(mesenchymal stem cells,MSCs)的成骨分化能力;HDAC9的下调则可使MSCs的成骨分化失衡,进而诱发骨质疏松的产生。而Zhang等[22]的研究则显示,HDAC9沉默可能通过改变细胞自噬水平等方式,致使小鼠MSCs的矿化结节形成增多,RUNX2、ALP的表达上调,HDAC9的沉默对小鼠骨缺损的骨量恢复发挥了积极作用。此外,刘凡[23]的研究显示,HDAC抑制剂可通过NF-κB通路和Wnt通路增强脂多糖刺激下牙龈干细胞(gingival stem cells,GSCs)的成骨分化能力。以上研究表明,HDAC9可参与细胞的增殖和成骨分化过程,但最终导致的影响不尽相同。有学者分析认为,HDAC9对细胞增殖和成骨分化的不同作用可能与细胞来源和种类的差异、不同作用信号之间的差异等因素有关[24]。HDAC9对PDLSCs的增殖和成骨分化的影响尚不清楚。
本研究通过多种生物学方法检测显示,沉默PDLSCs可使PDLSCs的增殖能力增强,同时亦可使PDLSCs中矿化结节等的产生增多,促进PDLSCs的成骨分化,提示HDAC9或可对PDLSCs的增殖和成骨分化发挥负向调控作用。这为通过细胞移植或自体细胞干预等方式将PDLSCs应用于牙周疾患的治疗提供了新的视角和策略,未来或可针对此设计药物,提高PDLSCs的损伤修复能力。
同时,本研究也为进一步探究相关机制奠定了基础,但HDAC9调控PDLSCs的增殖与成骨分化的作用靶点和相关信号通路,以及在纷繁复杂的调控网络中是否存在何种相互作用尚不明确,有待未来深入研究,相关问题的阐明将会为HDAC9在基于PDLSCs的牙周疾患防治中的精确应用指明方向。
