古尔班通古特沙漠白梭梭枝干光合及其影响因素
2022-01-16冯晓龙王玉刚
冯晓龙,刘 冉,马 健,*,徐 柱,王玉刚,孔 璐
1 中国科学院新疆生态与地理研究所, 荒漠与绿洲生态国家重点实验室, 乌鲁木齐 830011 2 中国科学院阜康荒漠生态国家野外科学观测研究站,阜康 831505 3 中国科学院大学, 北京 100049 4 新疆天池管理委员会博格达生态环境监测站, 阜康 831500
叶片是众多陆生植物最主要的光合器官,此外,植物的其他部位,如茎干、花、果实和根系也存在光合作用[1]。因为植物枝干部位的叶绿素主要存在于皮层,枝干的光合作用又称做皮层光合作用,此外,叶绿素叶也存在于木射线和木髓中,因此也称其为木质组织光合[2- 3]。枝干光合Pg通常指利用树皮内的绿色组织,将木质组织呼吸产生的CO2重新同化,也有少数植物茎部,可以通过气孔吸收部分外界CO2作为底物进行光合作用[4]。
枝干光合(Pg)可以作为叶片光合的重要补充,相较于叶片光合,枝干光合存在诸多优势。枝干存在时间较长,几乎常年存在,而且在一些小叶物种中,枝干面积占比较大[5];枝干光合Pg能够提升皮层氧气浓度,消除植物茎部暂时性缺氧可能带来的危害[6];一般而言,植物通过光合作用固定的碳中,有一半通过呼吸返回到大气中,而枝干光合可再固定茎部CO2释放量的7%—123%[4],从而有效减少碳的局部损失,提升植物的水分利用效率(WUE)[7-8];枝干光合也能够影响植物体其他部位的生理活动,Saveyn等[2]对茎部的遮光实验表明枝干光合有利于枝干生长和幼芽的萌发;Kocurek等[9]对书带木(Clusiaminor)的研究发现枝干光合可以改变植物体碳分配,影响根的生长。干旱胁迫下,叶片同化和筛管运输受到限制,而枝干光合产物可视为碳水化合物的可靠来源[10],同时枝干光合可以驱动树皮吸水以修复栓塞,维持植株的碳平衡和水力结构的完整,延迟干旱胁迫[10- 12],此外,枝干光合也影响叶片对干旱胁迫的敏感性,剔除枝干光合的植株中,叶片最大净光合速率下降更快[13]。
目前已有较多关于植物枝干光合作用的影响因子及其作用机理的研究,但其在不同物种间存在差异。全球变暖使得树木死亡的可能性升高[14],生态学家和植物学家广泛研究干旱胁迫下的植物生理生态响应机制,植物枝干光合Pg也引起了广泛关注[15- 17]。有研究发现西方白松(PinusmonticolaDougl. ex D. Don)枝干光合随温度的升高而持续增加,最高温度甚至达到45 ℃[18]。除温度外,其他环境影响因子也引起生态学家的关注,臭氧胁迫下,桦树(BetulapendulaRoth.)叶片光合速率明显下降,而枝干光合(Pg)增加,枝干光合支撑起枝干甚至整棵植株的碳平衡[19]。刘俊祥等[20]对旱柳(Salixmatsudana)枝干光合的研究表明,枝条不同组织的光合色素含量和光化学效率呈现随径向深度的增加而显著降低的规律。综上所述,枝干光合能够帮助维持植株生理平衡,在干旱胁迫下发挥重要作用[21-22],因此,对我国干旱区荒漠植物枝干光合的研究,可以为全球气候变化背景下荒漠生态系统结构和功能对干旱胁迫的响应提供科学参考。
白梭梭是古尔班通古特沙漠的优势木本植物,以其作为建群种形成的白梭梭群落是沙漠中分布最广、最重要的一个群落,通常出现在流动、半流动和半固定沙地的沙丘顶部和丘坡中上部,在丘坡下部和丘间低地常被梭梭群落所更替[23]。目前对白梭梭叶片和根部特性的研究较多[24-25],而枝干光合(Pg)特性的研究十分有限。本试验以白梭梭为研究对象,阐明白梭梭不同径级枝干光响应与光合日变化特征,确定最适白梭梭的枝干光响应曲线拟合模型;比较枝干与叶片的光合特性差异;探究叶片与枝干光合(Pg)的主要的影响因子;量化枝干光合在其植株个体水平上的贡献。
1 研究区概况与研究方法
1.1 研究区概况

图1 枝干光合测量装置Fig.1 Photosynthesis measuring device for branches and stems
研究区位于古尔班通古特沙漠的南缘,地理坐标为87°55′E,44°22′N,海拔460 m。古尔班通古特沙漠位于新疆准噶尔盆地中央,是中国面积最大的固定、半固定沙漠,面积有大约4.88万km2,也是中国第二大沙漠。该区属于典型的温带干旱气候,夏季炎热,高温可达40 ℃以上,冬季寒冷且漫长,有5个月的平均气温在0 ℃以下。年降水量70—150 mm,年蒸发量约1000 mm。研究区植被种类比较丰富,主要有白梭梭(Haloxylonpersicum)、梭梭(Haloxylonammodendron)、淡枝沙拐枣(Calligonumleucocladum)、琵琶柴(Reaumuriasoongorica)、柽柳(Tamarixchinensis)等。5月份短命和类短命植物发育,平均盖度可达40%左右,主要种有尖喙牻牛儿苗(Erodiumoxyrrhynchum)、角果藜(Ceratocarpusarenarius)、荒漠庭荠(Alyssumdesertorum)等,在沙丘底部或丘间低地广泛分布着地衣植物为主的生物结皮,其中还有微生物、藻类和苔藓植物等多种类型,其组成和分布因环境而异,是除种子植物以外维持该沙漠地表稳定的重要生物因子[26]。
研究对象为长势良好的多年生白梭梭,于2020年7月白梭梭生长旺盛季开展试验。选取3棵株高(2.3±0.12)m、冠幅(1.8±0.2)m×(1.0±0.2)m、基径(49±3)mm相似的白梭梭,每棵按枝干直径大小划分A级(13.36±0.84)mm,B级(8.37±0.25)mm,C级(4.94±0.49)mm。分别测定各径级枝干光响应曲线及光合日变化特征,辅以监测环境因子及相关叶片/枝干功能性状。
1.2 光响应曲线测定及拟合
1.2.1叶片光响应曲线
使用LI- 6400便携式光合仪(Li-Cor, Lincoln, NE, USA),选择植株生理活动相对活跃的上午时段(8:00—12:00)测量,光源使用2 cm×3 cm自带红蓝光源叶室控制,CO2浓度采用外带液化CO2小钢瓶由二氧化碳注入系统控制,稳定参比CO2浓度在400 μmol/mol,设定气体流量Flow=500 μmol/s,设定光强梯度为:2000、1600、1200、800、400、200、150、100、50、0 μmol m-2s-1。叶片平铺于叶室后首先在2000 μmol m-2s-1的光强下适应5—8 min至参数稳定,启用光响应自动测量程序开始测量,程序默认最小稳定时间120 s,变异系数<0.5记录结果。光响应曲线测定结束后测定叶片面积进行换算。
1.2.2枝干光响应曲线
同时,使用另一台LI- 6400便携式光合仪,预热检查后将样品室连接P-Chamber(MilletHill Biotech Co.,Ltd,China),P-Chamber叶室包裹在待测枝干上,测定面积约25 cm2,固定密封后在旁边吹气检查LI- 6400的参数值,确保不漏气。参比CO2浓度控制方法及设定参数同上,光强由P-Chamber主机控制,设置梯度与叶片相同。光适应稳定后,改变光强并记录测定结果[27]。
1.2.3叶片/枝干光响应曲线拟合
采用4种典型的光响应曲线模型,直角双曲线模型(RH)、非直角双曲线模型(NRH),指数方程模型(EE)和修正的直角双曲线模型(MRH),分别对白梭梭的叶片和枝干进行光响应曲线拟合,并与实测值比较后选出最优模型[28]。
1.3 枝干/叶片光合日变化测定
选择天气晴朗的一天,于8:00—18:00,每隔2h测定叶片的净光合速率(Pn),B级枝干的净光合速率、呼吸速率,光强设为测量时间点外界光强,CO2参比浓度稳定在400 μmol/mol。利用土壤温湿度测量仪(TDR- 150(6445),FieldScout,USA)在测量时间点测定植株就近的土壤层0—5 cm、5—10 cm的土壤温度和土壤含水量。温湿度记录仪(MX2301A,HOBO,USA)测量空气湿度和温度变化,自动气象站实时监测气象因子,结果见图2。
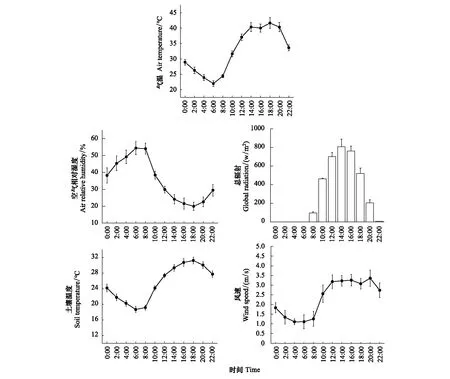
图2 研究期内环境因子的平均日变化(10d)Fig.2 Average daily change of environmental factors during the study period
枝干光合(Pg)指光照下枝干CO2释放速率(Rli)与黑暗条件下枝干CO2释放速率(Rd)的差值。其表达式[7]如下:
Pg=|Rd-Rli|
枝干光合再固定比例是指枝干光合(Pg)占枝干暗呼吸速率(Rd)的百分比,其表达式[18]如下:
%refixation ==|Rd-Rli|/Rd
本实验中,用枝干光合固定CO2的总量(Pg×Ss,Pg:枝干光合,Ss:枝干总面积)占植株光合总量(Ps×Ss+Pn×Sl,Pn:叶片净光合速率,Sl:叶片总面积)的比值来表征枝干光合在植株个体水平上的贡献。
1.4 生理指标测定
黎明前剪取白梭梭叶片和不同径级枝干迅速放入冰盒运回实验室分析。
1.4.1叶绿素含量
分别取叶片0.1 g、枝干1 g,剪碎,用95%乙醇与80%丙酮(1∶1)混合液25 mL暗处浸提24 h,提取液在波长663、645 nm下测定吸光度,并应用公式计算叶绿素a、b含量(mg/g)[29]。
Ca=12.7A663-2.69A645
Cb=22.9A645-4.68A663
CT=Ca+ Cb

式中,Ca:叶绿素a的浓度;Cb:叶绿素b的浓度;CT:叶绿素的总浓度;A645、A663:叶绿素溶液在波长645 nm和663 nm处的吸光度;C:叶绿体色素的浓度(mg/L);FW:鲜重(g);VT:提取液总体积(mL);n:稀释倍数。
1.4.2含水量及地上生物量等的测定
分别取白梭梭叶片和各级枝干1 g、4 g放入盛有蒸馏水的锥形瓶内,于低温冰箱保存24 h后65 ℃烘干至恒重。白梭梭平地采伐后装袋运回实验室,后将枝条截成约20 cm长的小枝并按直径分成A、B和C三组,对应直径分别为: dA>10 mm, 5 mm≤dB≤10 mm, dC<5 mm。采用直径长度估算法计算枝干的表面积。选取样地生长状况相似的10棵白梭梭,取若干叶片用于计算比叶面积,用比叶面积来估算叶片面积和直径小于1 mm的枝条面积,测量完毕后于65 ℃烘干至恒重。总碳测定使用multi N/C 2100碳氮分析仪(multi N/C 2100 TOC,analytikjena,Germany)。
1.5 数据分析
采用配对样本t检验(Paired-samplest-test)的方法分析白梭梭叶片和各级枝干叶绿素含量差异、叶绿素a/b,应用Spearman相关性检验分析影响白梭梭叶片光合,枝干光合和枝干呼吸的环境影响因子。数据由Excel 2019和SPSS 20进行处理, 图表采用Origin 9.0绘制,图表中的数据均为平均值±标准误差(Mean±SE)。
2 结果
2.1 枝干/叶片叶绿素含量比较
实验测定结果表明白梭梭叶片叶绿素含量与枝干叶绿素含量差异显著(P<0.01),叶片叶绿素a和叶绿素b含量均明显高于对应枝干的叶绿素含量,叶片总叶绿素含量是枝干总叶绿素含量9—16倍,而在各径级枝干之间叶绿素含量未检验出显著性差异。叶绿素a/b的值在白梭梭叶片和枝干间差异显著(P<0.05),枝干叶绿素a/b的值相当于对应叶片的63%—72%。B级枝和C级枝叶绿素a/b相似,A级枝略低于B、C级枝,但未检出显著性差异,表明各径级枝干之间叶绿素a/b差异不明显(图 3)。

图3 白梭梭叶片与各径级枝叶绿素含量及叶绿素a/b的平均值Fig.3 The average value of content of chlorophyll and chlorophyll a/b in leaves and stems of H. persicum. Different letters on the bar chart indicate significant differences in position on the plant柱状图上的不同字母表示植株部位之间差异显著(P<0.05); A级枝:直径>10 mm;B级枝:5 mm≤直径≤10 mm;C级枝:直径<5 mm
2.2 枝干/叶片光响应曲线拟合及光合特征比较
2.2.1光响应曲线拟合
由表1可知,对白梭梭叶片的光响应曲线拟合中,RH和NRH对Pn,m的拟合结果存在高估现象,EE对LCP的拟合结果低于实测值,MRH的拟合结果较精确,适合作为最优模型。对白梭梭枝干的光响应曲线拟合中,RH和NRH和NRH高估了Pn,m,不符合实际测量结果(未测得枝干净光合为正值),而EE仅能够对Pn,m有较精确的拟合,MRH模型各项拟合指标较精确,综上所述,在对白梭梭叶片/枝干的光响应曲线进行拟合时,应优先考虑MRH,以提高拟合结果的精确度,此外,不能单纯将R2作为模型拟合优劣的判断标准。
2.2.2光合特征比较
由图4可知,白梭梭叶片与各径级枝干的光响应曲线存在较大差异(P<0.01)。叶片光合总量是Pg总量的9.8—17.3倍,未能测得枝干净光合为正值,A级枝Pg最大,B级枝和C级枝分别占A级枝的61%、56%。

图4 白梭梭叶和各径级枝的光响应曲线Fig.4 Light response curves in leaf and stems of H. persicum
由表1可知,白梭梭枝干光饱和点低于叶片,A级枝干至C级枝干光饱和点逐渐减小(A级枝>B级枝>C级枝)。光响应曲线拟合参数结果显示,白梭梭叶片表观量子效率(AQE)约0.029,枝干AQE较叶片低,在0.006—0.014。叶片暗呼吸速率大于各径级枝干的暗呼吸速率,A级枝干到C级枝干暗呼吸速率逐渐减小(A级枝>B级枝>C级枝)。
2.3 枝干/叶片光合特征日变化
在8:00—10:00空气温度快速上升,空气湿度与之相反,8:00—18:00温度总体保持升高(图 2)。叶片光合速率在8:00—10:00上升幅度最大,达186%;对应枝干上升幅度较低,仅17%,说明白梭梭叶片较枝干对外界环境因子的响应更迅捷。12点时白梭梭叶片光合速率下降,降幅为23%,但对应枝干光合上升了29%,仅变化了0.25 μmol m-2s-1。白梭梭枝干呼吸速率在8:00—14:00持续增多,之后保持平稳,枝干光合变化与之相同(图 5)。测定时间范围内白梭梭叶片光合变化幅度明显高于枝干,并且叶片和枝干变化不同步。

表1 白梭梭叶片和各径级枝干的光响应曲线拟合

图5 白梭梭叶和枝净光合速率日变化特征Fig.5 Daily change in net photosynthetic rate of leaf and stem of H. persicum
2.4 枝干/叶片光合特征影响因素
实验结果表明(表 2),白梭梭叶片的相对含水量明显高于各级枝干,而A级枝干相对含水量低于C级枝干。C级枝干较A、B级枝干呼吸速率强,其枝干光合也较高(图 4)。比叶面积远高于比枝面积,是其9—26倍。叶片总碳含量约占枝干总碳含量的89%,但各径级枝干间差异不显著。叶片干物质含量和总碳含量都明显低于枝干,而各径级枝干间差异不显著。

表2 白梭梭不同部位的各项参数
根据最小显著差异法,表中同一列不同大写字母表示在0.05水平上植株枝与叶片之间差异显著,同一列不同小写字母表示在0.05水平上枝间差异显著;RWC:相对含水量 Relative water content;SLA:比叶面积 Specific leaf area;LDMC:干物质含量 Dry matter content;TC:总碳 Total carbon
从表3可知,叶片光合速率与空气温度、空气相对湿度、光合有效辐射有较强的相关性,此外,土壤含水量和土壤温度与叶片光合速率相关性叶较强。深层土壤含水量(10 cm)较浅层土壤含水量(5 cm)与叶片光合速率的相关性更强,表明叶片光合速率受深层土壤含水量(10 cm)的影响更大。枝干呼吸速率与光合有效辐射、空气温度和空气相对湿度相关性较强,但枝干光合与环境因子未检出显著相关性,表明枝干光合的变化基本不受环境因子的影响。图6为白梭梭叶片光合速率与枝干光合的线性相关分析,根据R2可知,枝干光合与叶片光合及枝干呼吸速率有显著的线性相关关系,表明叶片和枝干光合存在一定联系。

表3 白梭梭不同部位的光合与环境因子的相关系数
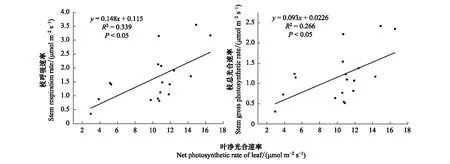
图6 白梭梭叶片光合与枝干光合的线性关系Fig.6 The linear relationship of photosynthetic rate between leaves and branches of H. persicum
2.5 枝干光合对自身呼吸CO2的再固定及其在植株个体水平上的贡献
白梭梭枝干光合平均CO2固定率约73%,能够维持在较高水平,最高可达90%(图 7),显著减少了枝干呼吸释放的CO2。CO2再固定比率在16点前逐步下降。
在植株个体水平上,白梭梭枝干总面积是叶片总面积的1.2—2.1倍,枝干光合固定二氧化碳的量对植株个体水平上固碳量的贡献为10.1%—21.2%,平均贡献比约15.4%,而且该比值在上午先下降后上升,10点该比值最低,归因于叶片光合速率的快速提升,在炎热干燥的中午和下午,植物处于干旱胁迫时该比值并没有明显变化(图 8)。

图7 枝呼吸再固定比例的日变化 Fig.7 Daily change in proportional refixation rate of respiration in stem
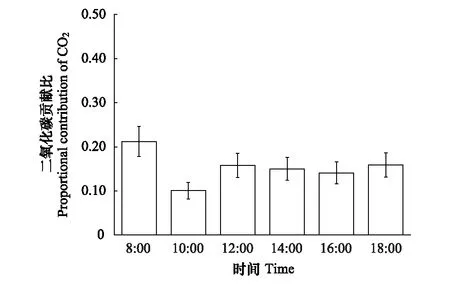
图8 枝干光合吸收二氧化碳贡献比的日变化 Fig.8 Daily change in proportional contribution of CO2 assimilation in stem photosynthesis
3 讨论
3.1 白梭梭枝干和叶片的叶绿素含量差异
本实验中,白梭梭叶片和枝干叶绿素含量差异显著。白梭梭在进化过程中为减少蒸腾作用,叶片逐渐退化为同化枝,但依旧保持叶片光合最优化分配,叶绿素含量远高于枝干。王莹[30]对柏树、红柳、小叶丁香和家槐等44种植物的叶片和枝干叶绿素含量进行测定,结果表明叶片叶绿素含量平均是枝干的19.76倍,与王文杰等[21]对林木非同化器官光合功能统计结果相似。枝干具有较低的叶绿素a/b比例,叶绿素b丰度高有利于对光能的捕捉和传递,这是典型阴生植物的特点[22]。Levizou等[31]对24种植物的研究还表明,枝干叶绿素比率在阳面和阴面无显著性差异,认为可能与枝干内部特定的微环境有关。此外,因为叶片的遮挡,枝干处光照总量低于叶片,这可能也是叶绿素差异的原因之一。Wittmann等[32]对杨树遮光处理后发现枝干叶绿素含量上升了约40%,表明光照影响叶绿素含量。叶绿素差异形成可能是植物对光照环境的适应。
3.2 白梭梭枝干和叶片的光合特征差异
本实验中,白梭梭枝干光饱和点低于叶片,这与Wittmann等[32]对白杨和山毛榉的研究结果一致。白梭梭各径级枝干的CO2释放量与Cernusak等[18]对白松(PinusmonticolaDougl. ex D. Don)的测定结果相似,枝干光合Pg范围在0—2.7 μmol m-2s-1,远低于叶片的光合总量。木本植物枝干结构和叶片结构通常存在较大差异,这些差异是影响光合功能特性的原因。木本植物茎部软木(栓皮)对光有高吸收性和低透射性,导致枝干处光合有效辐射的利用率较低,这是枝干光合的主要限制因素[32]。通常认为,枝干释放出的大部分CO2是由树皮下的形成层和边材中的活细胞产生的,枝干光合同化了其中一部分CO2,此外,枝干中的微生物和大型生物的呼吸,木质部和韧皮部中溶解的CO2,也可能是枝干释放的CO2中的一部分[33]。
本实验中枝干暗呼吸速率、枝干光合、枝干光合与枝干呼吸速率的比率,从A级至C级逐步减小(图 4),这与Hölttä等[34]建立的模型恰好相反,该模型以樟子松(PinussylvestrisL.)为研究对象,考虑到木质部汁液将呼吸生成的CO2往上运输并积累。Salomón等[35]对桉树(Eucalyptustereticornis)的研究也表明,CO2再固定率在枝干高度上存在显著差异,上层枝干再固定率要高于下层。桉树属于高大乔木,上层阳光较下层充足,且下层树皮的粗糙度大于上层,而白梭梭则与之不同,白梭梭属于小乔木,A级枝阳光比较充足,木质化时间较长但死皮已脱落,枝干表面较C级枝干光滑,而从枝干相对含水量来看,A级枝高于C级枝,其代谢活动相对旺盛[36],此外,也可能是溶解在木质部下层汁液中的CO2组分较多[37],这些差异的综合作用导致白梭梭A级枝干光合作用更强。
3.3 环境因子对叶片和枝干光合特征的影响
白梭梭叶片光合速率受到空气温度、空气湿度,土壤含水量和温度等多种环境因子的影响,枝干呼吸速率仅与光合有效辐射、空气温度和空气相对湿度存在一定联系,而枝干光合基本不受环境因子的影响(表 2),也有可能是未达到其响应阈值[18]。白梭梭枝干对环境因子的敏感性明显低于叶片,这与Hölttä等[34]对枝干CO2释放量建立的模型相符,该模型还预测了枝干呼吸的温度依赖性将大于枝干CO2释放量的温度依赖性。Nilsen[38]对鹰爪豆(SpartiumjunceumL.)的研究结果同样表明枝干光合对空气温度、光照强度等环境参数和水分胁迫的敏感性均低于叶片光合速率。由此可见,枝干光合可能是白梭梭对水分胁迫有较强耐受性的原因之一。
3.4 枝干光合维持植株碳平衡的重要意义
本实验结果证明,枝干光合能够有效减少植物枝干呼吸释放的CO2,在植物处于干旱胁迫的中午和下午,枝干光合对植株碳平衡的贡献比例仍然维持在稳定水平,有效降低了植物因为干旱胁迫而导致的碳饥饿风险。此外,干旱胁迫造成筛管碳运输功能紊乱,影响碳在植物体的转运[39],枝干光合再固定呼吸释放的CO2,降低碳运输能耗并延迟碳耗尽的时间,从而提升植物抗旱性。众多研究已证明枝干光合能在干旱胁迫中发挥重要作用[3, 8, 10],因此,枝干光合对维持植株正常生长有不可忽视的作用。
3.5 关于枝干光合的研究建议
本实验探究了枝干光合的变化,但未测量枝干液流变化情况,因此不能判断枝干CO2释放量变化与液流变化的关系。国际上对枝干光合作用的内部机理目前尚不明确,枝干液流中可能含有较高浓度的CO2,这些CO2可能沿径向向外扩散到大气,从而干扰枝干光合的测定[33]。然而,Wittmann等[40]实验结果表明线粒体呼吸在光照和黑暗条件下是相似的,进而排除线粒体呼吸对枝干CO2释放量的影响;抑制光呼吸,改变枝干液流(sap flow)均未明显改变枝干CO2释放量,证实了光下枝干CO2释放量的减少只能是由于枝干光合作用所致。而Salomón等[41]同位素实验表明木质部转运的CO2占到枝干释放的CO2的13%—38%,表明木质部转运的CO2在评估枝干光合/呼吸中有显著影响。因而,建议借助稳定同位素示踪法、树干液流技术等手段,对植物根部液流,茎部液流和冠层液流的CO2来源和去向展开进一步研究,在微观上还可以对枝干光合产物的形态组成及去向进一步研究。此外,枝干光合能够提升植物抗逆性(如耐旱性),对其光合潜能的开发可能成为促进植物生长和提升作物产量的一种有效手段[42-43]。
4 结论
白梭梭叶片叶绿素含量是枝干叶绿素含量的12—16倍,枝干光饱和点低于叶片,枝干光合可以有效减少枝干呼吸释放的CO2,维持枝干甚至整棵植株的碳平衡。枝干暗呼吸速率主要受光合有效辐射,空气温度和空气相对湿度的影响,而在一定范围内,枝干光合(Pg)基本不受外界环境因子的影响,对环境因子的依赖程度远低于叶片光合速率,这可能是白梭梭抗逆能力较强的原因之一。白梭梭A级枝干的光合作用较C级枝强,这可能是枝干表面光滑程度、木质部液流情况等的作用结果。于植株本身而言,植物枝干光合作用可以贡献植株个体水平固碳量的15.3%。因此,本研究成果证明,忽视枝干光合的贡献来预测未来气候变化背景下荒漠生态系统碳过程,可能存在根本性缺陷,并为进一步完善白梭梭耐旱机制的研究提供理论支撑。
