泥炭沼泽湿地关键元素地球化学特征及其对碳排放的影响机制
2022-01-16吕雪艳于志国
余 珂,张 尹,吕雪艳,于志国,*
1 南京信息工程大学水文与水资源工程学院, 南京 210044 2 水利部珠江水利委员会水文水资源局, 广州 510611 3 郑州市象局,郑州 450000
泥炭沼泽湿地(泥炭地)是全球土壤碳的主要储存地[1]。世界自然保护联盟(International Union for Conservation of Nature,IUCN)指出,近天然泥炭地(大于300万平方公里)含有超过5.5亿吨的碳,占所有土壤碳的42%,泥炭地的碳排放对全球气候变化具有重要意义。研究表明,泥炭地的碳排放主要有两种形式,一方面直接排放二氧化碳(CO2)和厌氧分解产生的甲烷(CH4)到大气中,另一方面通过溶解有机碳(Dissolved organic carbon,DOC)溶解流失到地表水中[2]。泥炭地中的DOC既是土壤生物化学过程的产生物,又是土壤微生物生长、分解有机碳的重要来源[3],在陆地生态系统碳循环中具有重要的作用。近几十年来,部分高纬地区泥炭地或其他富含有机质土壤的排水中DOC浓度增加[2],表明泥炭地向其他地表水释放的碳量显著增加,因而可能促进CH4和CO2释放并对温室效应产生积极的推动作用。
硫、铁是泥炭地中最主要的关键元素,硫、铁元素地球化学过程对碳的循环和活性具有十分重要的意义。在西北欧、中欧等地区,工业时期矿物燃料的消耗增加了泥炭地和其他生态系统的硫(S)输入[4- 6]。通常,硫在泥炭地中主要以硫酸盐形式存在,是雨养型泥炭地中重要的电子受体。另外,铁(Fe)作为最具氧化还原敏感性的元素,参与泥炭地中大量的地球化学循环过程,且与S循环密切相关,研究表明活性铁是硫循环重要的参与者[7- 9]。因此,硫、铁元素可能会强烈影响泥炭地中有机质的分解,进而影响碳排放[10- 13]。
本研究选址德国中部典型雨养泥炭沼泽湿地,位于中高纬地区,该类型泥炭地在全球变暖的背景下对气候变化、干沉降的敏感性更高,对研究泥炭地的碳排放机制有重要价值。当前对于泥炭地碳排放的研究主要集中于受地上部因素影响的温室气体排放[14- 15](CH4、CO2等),而对于地下部重要元素的地球化学过程与碳排放交互机制报道较少[16]。因此,本研究选取雨养泥炭地进行原位采样,探究两地孔隙水中硫、铁元素的地球化学成分组成特征及变化规律,以探讨其与DOC以及CH4、CO2排放的关联性,阐明地下部地球化学过程对于碳排放的影响机制,以期了解泥炭地碳排放的关键影响因素,为厘清碳排放规律的变化机制以及泥炭沼泽湿地碳排放核算提供理论支撑。
1 材料与方法
1.1 采样地概况
本研究调查区域为德国图林根森林泥炭沼泽地,包括两个采样点:高海拔采样点(TBP)和低海拔采样点(TSP),两者均为典型雨养型泥炭地。TBP采样点位于北坡(50°39′34″N,10°44′34″E),属于森林生物圈保护区的核心地带,海拔945—983 m,年降水量为1300 mm[16],年平均气温为4℃。该采样点泥炭层平均厚度超过3—4 m[17],泥炭沼泽植被以矮小灌木为主,覆盖彩色泥炭藓。TSP采样点位于海拔884—893米山脊状斜坡,沿西南方向倾斜坡度在2°到4°之间[17],年降雨量为1230 mm,年平均气温为5℃,泥炭层厚度达2.5 m,植被覆盖类型主要是矮小灌木和丰富的泥炭藓。
1.2 采样方法
使用分段式气液采样装置(MLP)原位采集TBP和TSP采样点泥炭土壤剖面中的孔隙水,采样时间为2018年6—7月。将MLP采样器置于土壤中平衡4周后分段采样孔隙水。TBP和TSP采样点采样深度分别为270 cm和200 cm,其中,150 cm深度以上以10 cm分辨率采集样品,而150 cm深度以下以20 cm分辨率采集样品。将采集样品储存于容积为20 mL顶空样品瓶中,注入超纯水并用0.2 μm渗透膜覆盖。静置一段时间后,在顶空样品瓶中抽取2 mL气体样品,注入盛有50 μL 6 mol/L HCl的7.5 mL顶空样品瓶中,用丁基橡胶塞(Wicom, Heppenheim, Germany)紧塞瓶口,测定可溶性温室气体浓度。因泥炭浅层生物地球化学过程活跃,沉积物表面至60 cm深的沉积物层是微生物反应活性最高的活性带,是研究地球化学活动的关键区域。使用长度为60 cm的高分辨率(1 cm)孔隙水采样器(DC)采集浅层孔隙水。采样器置于土壤中平衡4周后分段采集孔隙水,将收集的孔隙水样品注入盛有20 μL 6 mol/L HCl的1.8 mL顶空样品瓶中备用,测定可溶性气体浓度。本研究选取的雨养泥炭地相对变异性较小,由于野外采样的时间和空间以及工作量较大的限制,故本次实验使用的数据是在前期预实验基础上有代表性的原位采样结果。此外,本研究的采样为被动式扩散采样法,孔隙水及气体扩散收集到的样品即为长期动态平衡的结果,与自然环境中的实际浓度较为接近,因此样品的代表性较高,2个采样点均无重复采样。整个采样过程持续4周,将累积的样品量作研究值。
利用俄罗斯箱式采样器采集泥炭土壤样品,TBP采样深度为340 cm,TSP采样深度为210 cm。对采集到的泥炭芯每隔5—10 cm进行分层置于采样袋冷冻保存以待分析。
1.3 分析方法
(1)对分段式气液采样装置采集样品测定以下内容:用总有机碳分析仪(Shimadzu TOC 5050)分析可溶性有机碳(dissolved organic carbon,DOC)浓度。利用气相色谱仪(SRI 8610 C, SRI Instruments, USA)测定CO2和CH4,用亨利定律计算CO2和CH4浓度[18]。通过化学抑制离子色谱(Metrohm modular IC system, A Supp 4 Column, Metrohm, Filderstadt, Germany)分析硫酸盐、硝酸盐浓度。(2)对高分辨率孔隙水采样器采集的样品测定以下内容:根据生成亚甲基蓝颜色深浅,运用分光光度法测定硫化氢(H2S)浓度,使用邻菲罗啉分光光度法[19]测定溶解态亚铁浓度。(3)对泥炭土壤样品测定以下内容:使用硫酸提取固体样品中亚铁,并使用邻菲罗啉分光光度法进一步测定。使用能量色散微探针多元素分析仪(EMMA)测定总铁浓度。用亚甲基蓝法(Varian Cary 1E, Agilent, Santa Clara, USA)还原铬后[20]以H2S定量测定固相中TRIS含量。
1.4 数据处理
本研究数据处理使用Excel 2010,作图使用Sigmaplot 14.0软件。统计分析使用SPSS 17.0软件,文中所提及的DOC与硝酸盐、硫酸盐、亚铁、pH以及CH4与硫酸盐、亚铁的相关系数,其计算方法均为Pearson相关性分析方法。
2 结果与讨论
2.1 泥炭剖面硫、铁地球化学变化特征
还原无机硫(RIS)是沉积物中硫重要高活性成分,两处采样点TRIS浓度分布如图1所示。由于测量过程中样品受到污染,TSP采样点缺失部分测量数据,仅保留深度5—30 cm范围TRIS数据(图1)。TBP采样点TRIS浓度在上部(0—87 cm)先增后减,超过87 cm深度后无明显波动。TRIS在上部(0—87 cm)平均浓度远高于下部(87 cm以下),表明上部深度范围内硫酸盐还原作用活跃。两处采样点表层TRIS浓度均为0.5 μmol/g,自表层至~20 cm深度范围均急剧增加,其中,TBP采样点在23 cm处TRIS浓度最大,为29.8 μmol/g。在23—87 cm范围内TRIS浓度急剧降低至1.24 μmol/g,超过87 cm后TRIS浓度均低于1 μmol/g且无明显波动,平均值约为0.51 μmol/g。与Broder等[21]在Patagonia泥炭地PBr2采样点发现的变化趋势相似,TRIS浓度在40 cm深度达到最高值后开始减少。推断是由于随着硫酸盐浓度的增加,TRIS可能被再氧化而减少,相似的结果在Blodau等[22]在加拿大Mer Bleue泥炭地也有发现。本研究中TBP采样点近80%深度范围内TRIS的浓度均小于1 μmol/g,远低于Broder等[21]在PBr2站点观测到的TRIS浓度范围(2.5—5 μmol/g),这是因为PBr2站点常受海浪侵袭,有较高的硫酸盐输入,而TBP泥炭地接受的硫酸盐输入主要来自大气沉降,浓度远低于PBr2站点。
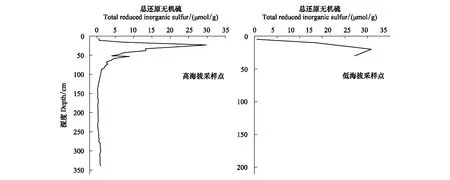
图1 不同采样点总还原无机硫浓度随深度分布Fig.1 Distributions of total reduced inorganic sulfur concentrations with depth in different sampling sites
由图2可以看出,两处采样点亚铁浓度随深度均呈减少趋势。在0—20 cm范围内,TSP和TBP中亚铁浓度分别由18.29 μmol/L 减少到10.72 μmol/L和32.99 μmol/L 减少到12.61 μmol/L。在20—60 cm范围内,亚铁浓度波动减少,TSP和TBP中波动范围分别为1.88—11.979 μmol/L和2.03—21.77 μmol/L。此外,TBP和TSP中H2S平均浓度相差较大,分别为2.27 μmol/L和0.75 μmol/L,且两处采样点H2S浓度总体呈现先增后减的趋势(图2),TBP和TSP分别在9 cm(4.82 μmol/L)和35cm(1.17 μmol/L)深度达到最大浓度。
H2S的形成机理主要包括微生物成因、热化学成因和岩浆成因等[23- 24],考虑研究区的地理位置特点,重点关注微生物成因。微生物作用生成H2S主要有两种途径,第一种主要发生在地表并由腐败作用主导,生成的H2S含量不会很高。第二种是通过微生物硫酸盐还原菌利用有机质或烃类来还原硫酸盐生成H2S,这种方式被称为微生物硫酸盐还原作用(BSR),是微生物作用生成H2S的主要途径,需在严格的厌氧环境中进行,且地层介质条件必须适宜硫酸盐还原菌的生长和繁殖,因此在深层难以发生[25]。
根据图2两者浓度变化趋势,将H2S成因以及硫、铁的地球化学过程按深度划分分析:(1)在泥炭地最表层约0—5 cm深度范围:两采样点H2S均有小幅度增加过程,表明H2S有低浓度生成。此深度下H2S可能主要通过泥炭地表生物降解腐殖作用生成,但由于接近地表,痕量溶解氧导致硫酸盐还原菌还原硫酸盐作用较弱。同时,有氧环境还抑制了硫酸盐的还原性,并易于将较强还原性H2S氧化成硫酸盐。(2)在约5—20 cm深度范围:两采样点亚铁浓度急剧减少,H2S也均呈现减少的趋势(图2)。推断是H2S在孔隙水扩散过程中易与阳离子Fe2+结合为硫化亚铁(FeS),进而与H2S、S、聚硫化物经过一系列生物地球化学过程生成稳定的黄铁矿[26](FeS2),从而使两者浓度均减少。与TRIS约20 cm深度范围观察到的高值相对应,此深度范围是厌氧环境,适宜硫酸盐还原菌的生长和繁殖,在硫酸盐还原菌作用下硫酸盐还原作用最为强烈。因此,H2S主要通过硫酸盐还原菌还原硫酸盐生成,而生物降解腐殖作用较小。(3)在20 cm至35 cm(TSP)/39 cm(TBP)深度范围内:H2S浓度随深度波动增加,亚铁浓度随深度波动减少(图2)。随深度增加,由于游离亚铁离子减少,反应速率减缓, H2S消耗也随之减少。由于生成H2S浓度增加,并且始终大于消耗H2S量,H2S呈增加趋势,直到35—39cm左右浓度达到最大。该深度范围H2S主要由硫酸盐还原菌将硫酸盐还原生成。(4)底部深度范围:两采样点H2S都随深度减少(图2),推测此深度范围不适宜硫酸盐还原菌生长,BSR作用弱,且无足量硫酸盐参与反应。亚铁在此范围随深度波动变化不大(图2),与H2S反应进一步减弱,此范围内铁不以FeS或FeS2形式存在。
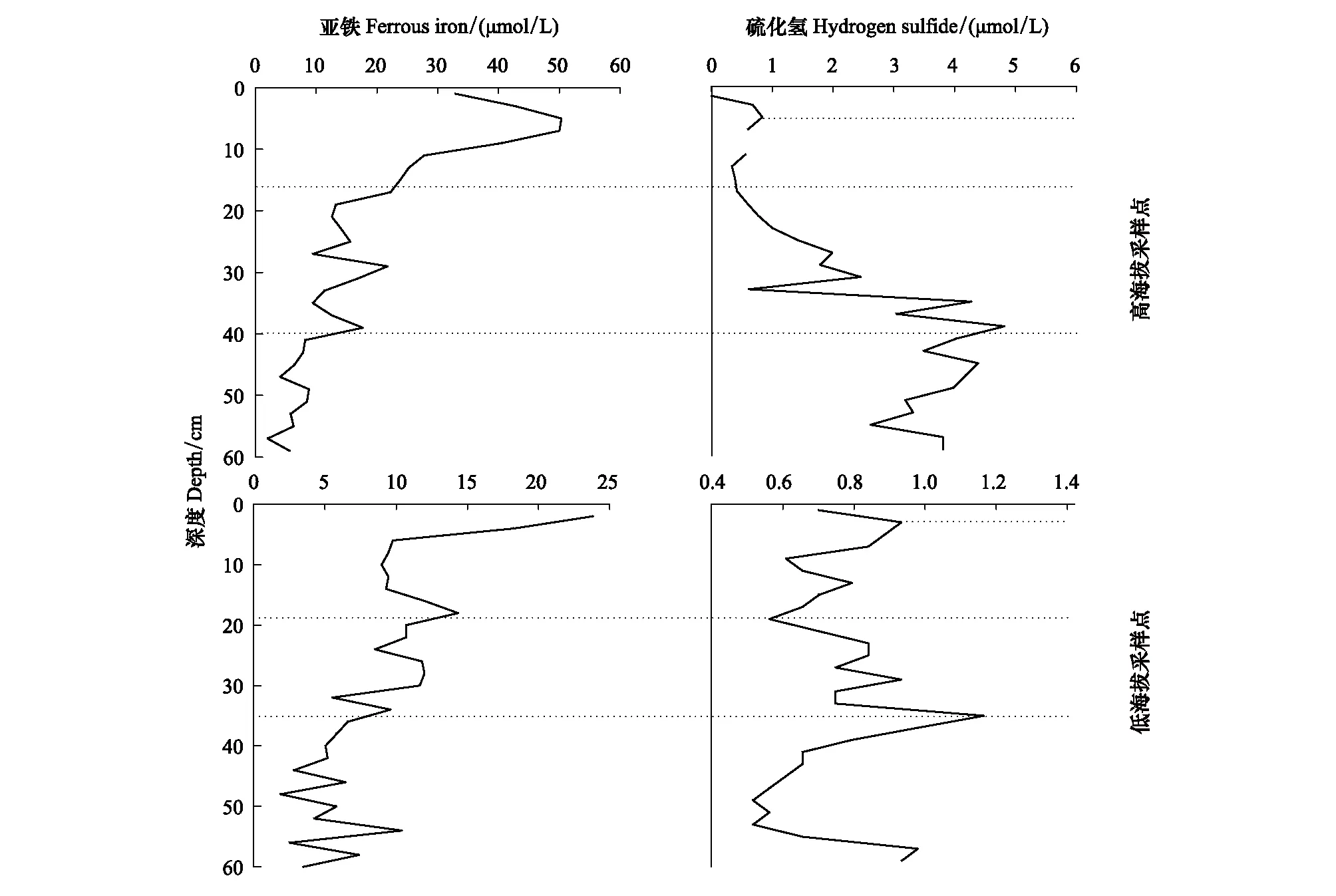
图2 不同采样点中亚铁、硫化氢浓度随深度分布Fig.2 Distributions of ferrous iron and hydrogen sulfide concentrations with depth in different sampling sites
2.2 泥炭剖面DOC浓度分布和影响DOC排放的地球化学因素
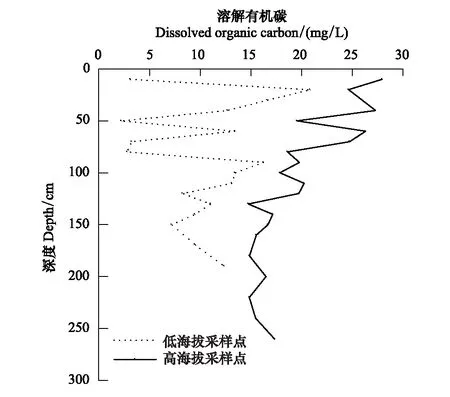
图3 不同采样点中溶解有机碳浓度随深度分布 Fig.3 Distributions of dissolved organic carbon concentrations with depth in different sampling sites
由图3可知,两处采样点DOC高浓度均出现在泥炭地上部以及表层附近。TBP和TSP中DOC浓度分别在10 cm和20 cm深度最高,分别为27.93 mg/L和20.81 mg/L。此外,TBP中DOC浓度随深度呈减少趋势,平均浓度19.79 mg/L;TSP中的DOC浓度随深度无明显变化规律,90 cm以上波动较大,但超过90 cm后波动较小,平均浓度10.33 mg/L,略低于TBP中DOC浓度。
根据表1相关性分析发现,TBP中DOC与亚铁呈显著正相关,相关系数为0.507,DOC与硫酸盐呈显著负相关,相关系数为0.699。根据表2相关性分析发现,TSP中DOC与亚铁呈显著正相关,相关系数为0.380,而DOC与硫酸盐无显著相关性。进一步比较表1、2可发现TSP泥炭地中多数项相关性均低于TBP。此外,TSP剖面上DOC浓度波动较大(图3),浓度变化接近7倍,原因是腐殖酸等在水溶液中的扩散非常低[27]。
根据王东香等[28]对神农架大九湖泥炭地的研究结果表明,DOC与亚铁、硫酸盐均有较强的相关性,泥炭地的水位是一个重要因素,泥炭地中水位的波动会影响氧化还原程度和微生物活性[29- 30]。Knorr等[31]对巴伐利亚东北部的Lehstenbach流域的代表性湿地研究中发现,在孔隙水的样品中,DOC与亚铁呈极显著正相关(R2=0.78),证实DOC浓度与铁的氧化还原动态变化过程密切相关。铁氧化物可作为胶结剂促进土壤微团聚体的形成,其通过吸附和共沉淀作用与土壤有机碳结合形成复合体,实现物理保护提高有机碳的稳定性实现有机碳累积。淹水环境中,铁还原的微生物代谢过程不仅直接耦合有机碳矿化,从而导致溶解有机碳浓度的增加,这与我们研究发现结果一致。本研究中DOC浓度与硫酸盐的相关性与Knorr等[31]的研究中观察到结果相似,均呈显著负相关。硫酸根是强酸性阴离子,在淹水环境中,硫酸盐的还原过程可消耗酸度提高pH值[32],而DOC的溶解度受pH值和离子强度的控制[33- 34],故pH值升高也可提高DOC浓度增加。同时在本研究中,两个采样点的DOC浓度与硝酸盐和pH均无显著相关性,两个采样点孔隙水中硝酸盐浓度过低(0.02—0.03 mg/L范围),推断是对于DOC浓度影响不明显主要原因。
综上,对两处采样点的DOC浓度与铁、硫等关键元素关系发现,在厌氧环境中,铁氧化物还原性溶解产生的亚铁,与其结合的有机碳被释放到溶液中会导致DOC浓度的升高,因此DOC浓度与亚铁呈正相关;而硫酸盐还原的过程中消耗酸度使pH值升高,可促进DOC溶出,因此DOC浓度与硫酸盐呈负相关。铁、硫的氧化还原过程对泥炭地碳循环的直接和间接影响值得进一步关注。
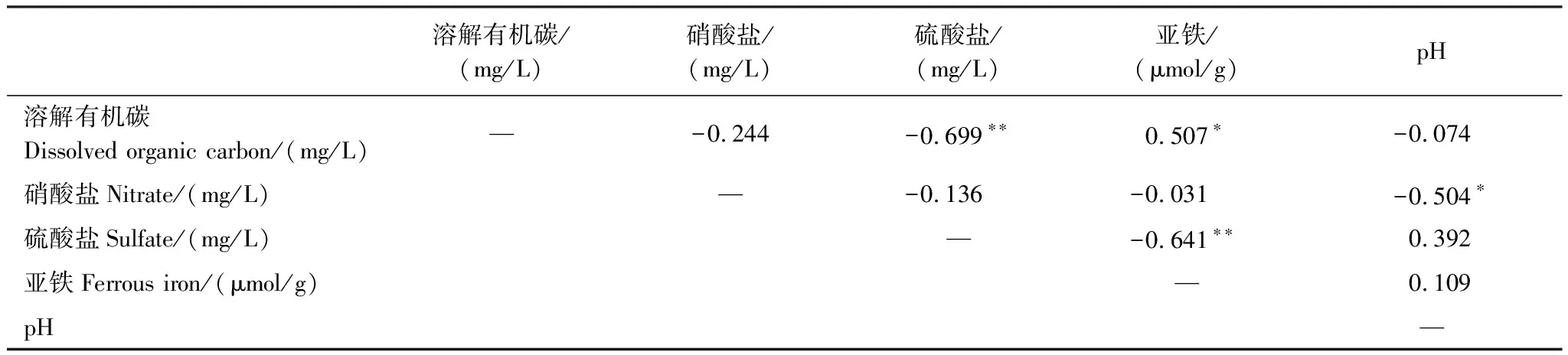
表1 高海拔采样点硝酸盐、硫酸盐、亚铁、pH与溶解有机碳的Pearson相关系数
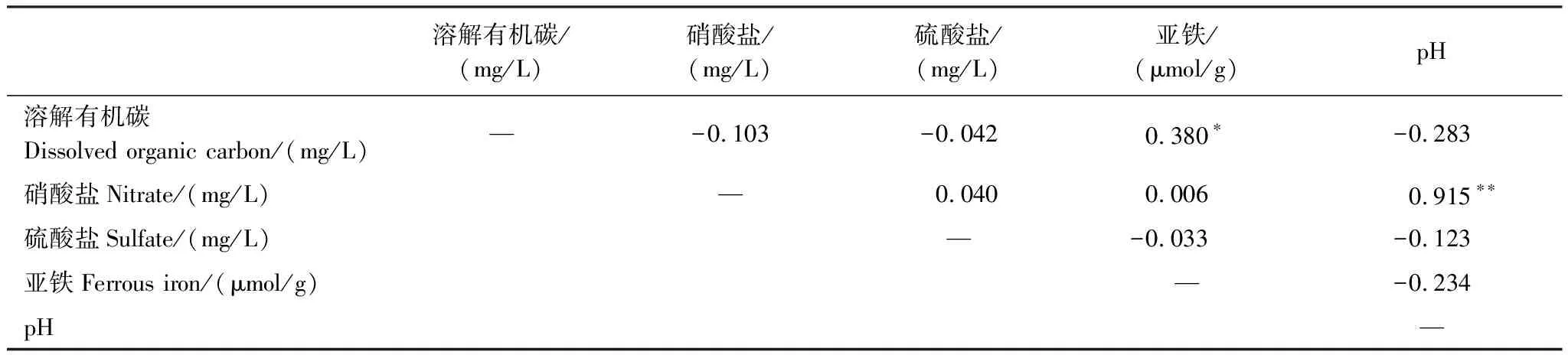
表2 低海拔采样点硝酸盐、硫酸盐、亚铁、pH与溶解有机碳的Pearson相关系数
2.3 泥炭剖面CH4、CO2浓度分布和影响CH4、CO2排放的地球化学因素
如图4所示,两处采样点CH4浓度均随深度增加而增加。TBP中CH4浓度为1.88—735.90 μmol/L,最大浓度出现在260 cm,表层至60 cm深度范围增长速率较为缓慢,60 cm以下增长速率较快。TSP中表层至60 cm以上深度范围的CH4浓度在300 μmol/L左右,最大值出现在170 cm深度处,60 cm以下波动幅度较大,浓度范围为223.71—543.51 μmol/L。由于地下水位的不断下降,氧气进入到原本因淹水而缺氧的土层中,致使甲烷氧化区从近地表向下延伸至近60 cm深度处,从而使较深层的CH4被氧化[35],表层至60 cm深度范围的CH4增长速率缓慢。此外,两处采样点CO2浓度都随深度先增后减。两处采样点在0—60 cm深度范围波动较小,TBP中在90 cm处达到最大浓度4191.94 μmol/L,TSP在120 cm达到最大浓度4210.74 μmol/L。两处采样点在达到最大浓度后均随深度急剧降低,TBP在100 cm降低至3148.78 μmol/L,TSP在130 cm降低至1464.78 μmol/L。两处采样点~130 cm以下的深度范围CO2随深度减少,CH4随深度增加,是由于在较深、活性较低的泥炭地层以H2还原CO2产CH4占主导[35],由此解释产生的CH4高值。
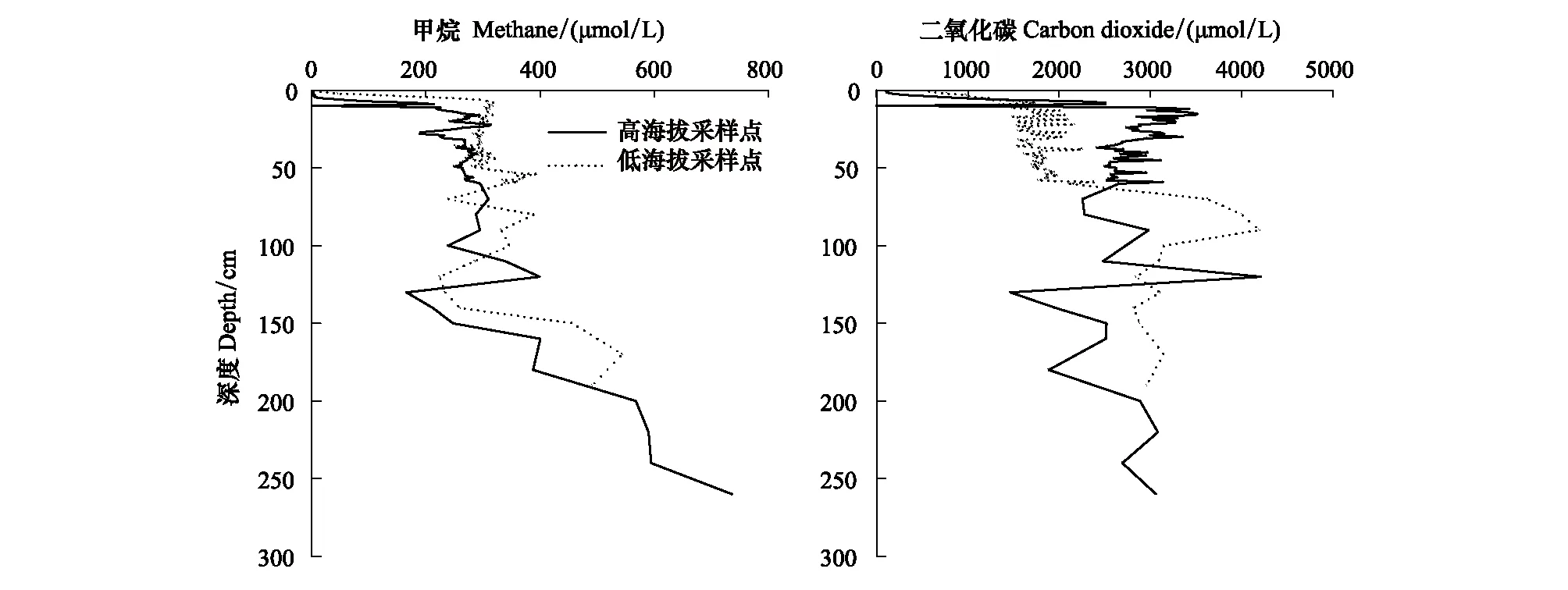
图4 不同采样点中甲烷、二氧化碳浓度随深度分布Fig.4 Distributions of methane and carbon dioxide concentrations with depth in different sampling sites

图5 不同采样点中甲烷和硫酸盐、甲烷和总还原无机硫、甲烷和亚铁浓度随深度的分布Fig.5 Distributions of methane and sulfate、methane and total inorganic sulfur、methane and ferrous iron concentrations with depth in different sampling sites
如图5所示在TBP和TSP采样点中硫酸盐和CH4在剖面上变化趋势相反。TBP采样点CH4浓度随深度先增后减再增,硫酸盐浓度随深度先减后增再减。80—150 cm深度范围硫酸盐平均浓度较高为0.52 mg/L,而CH4平均浓度偏低为276.74 μmol/L,此范围内硫酸盐和CH4呈显著负相关,相关系数达到-0.823。 TSP采样点硫酸盐在40 cm达到最大浓度,在120—140 cm深度范围浓度相对较高,但此范围内CH4浓度相对较低,40 cm处CH4浓度为291.18 μmol/L,120—140 cm深度范围平均浓度238.80 μmol/L。Broder等[21]对智利泥炭地研究发现,CH4浓度最高的深度对应硫酸盐浓度较低。以上结果均表明硫酸盐浓度较高条件下,CH4生成被抑制,此结果与过往研究结果相一致[36- 38]。同时,两处泥炭地底部较低硫酸盐浓度与CH4急剧增加相一致。如图5中所示,TBP和TSP中TRIS在0—87 cm范围浓度较高,此深度范围内CH4浓度整体偏低。表明较高的还原性无机硫含量可能抑制CH4生成,这与Broder 等[21]对Patagonia泥炭地采样结果一致。泥炭沼泽中两种产甲烷菌可利用醋酸和氢产生CH4,而硫酸盐还原菌对氢和醋酸的亲和力高于产甲烷菌[39],可与产甲烷菌竞争基质醋酸和氢[40],从而抑制CH4的产生。
如图5所示,TBP采样点CH4和亚铁在剖面呈现相反变化趋势,CH4浓度随深度增加而增加,而亚铁浓度则随深度增加而减少,两者呈显著负相关,相关系数为-0.684。0—50 cm深度范围亚铁浓度较高,CH4浓度相对偏低。50 cm深度以下范围亚铁浓度较低,CH4较高。同样,TSP采样点浅层高浓度的亚铁也导致CH4生成率偏低。亚铁能够满足产甲烷菌对于营养元素的需求,促进CH4生成,但由于铁和镍是硝酸盐、亚硝酸盐还原酶的组成成分,会促进氨氮氧化并造成高氨氮毒害产甲烷菌,亚铁浓度对产CH4生成具有“低促高抑”的效应[41- 43]。
理论上,泥炭湿地地下部排放的CO2/CH4是1∶1,但是由于饱和水条件会使土壤中电子受体浓度升高,厌氧细菌可利用电子受体进行还原反应产生CO2,使得实际情况下CO2/CH4比率大于1。经计算,TBP与TSP采样点中CO2/CH4除近地表层的高值外,TBP中两者比值处于5—13范围内,TSP中两者比值处于4—10范围内。Steinmann等[44]在瑞士的雨养泥炭沼泽观察到的CO2/CH4比率约为5,Blodau等[45]在加拿大三处不同类型的泥炭沼泽观察到溶解的CO2/CH4比率约为6,均与本研究的结果相近。表明硫酸盐仅在泥炭沼泽内部循环时可作为替代电子受体,使厌氧条件下碳矿化转向生成更多CO2[46]。TBP采样点0—50 cm深度范围内亚铁和CO2浓度相对较高,两者变化趋势相似,均随深度先增后减(图6),但超50 cm后两者呈现相反变化趋势,亚铁浓度先减后增,CO2浓度先增后减。然而,TSP采样0—50 cm深度范围内亚铁浓度相对较高,CO2浓度相对较低,超过50 cm后两者均呈现先增后减趋势。TBP和TSP采样点中亚铁浓度对于CO2生成的影响作用较小,Blodau等[45]的研究结果也表明铁还原对于碳排放量的影响相较于硫酸盐还原作用较小。
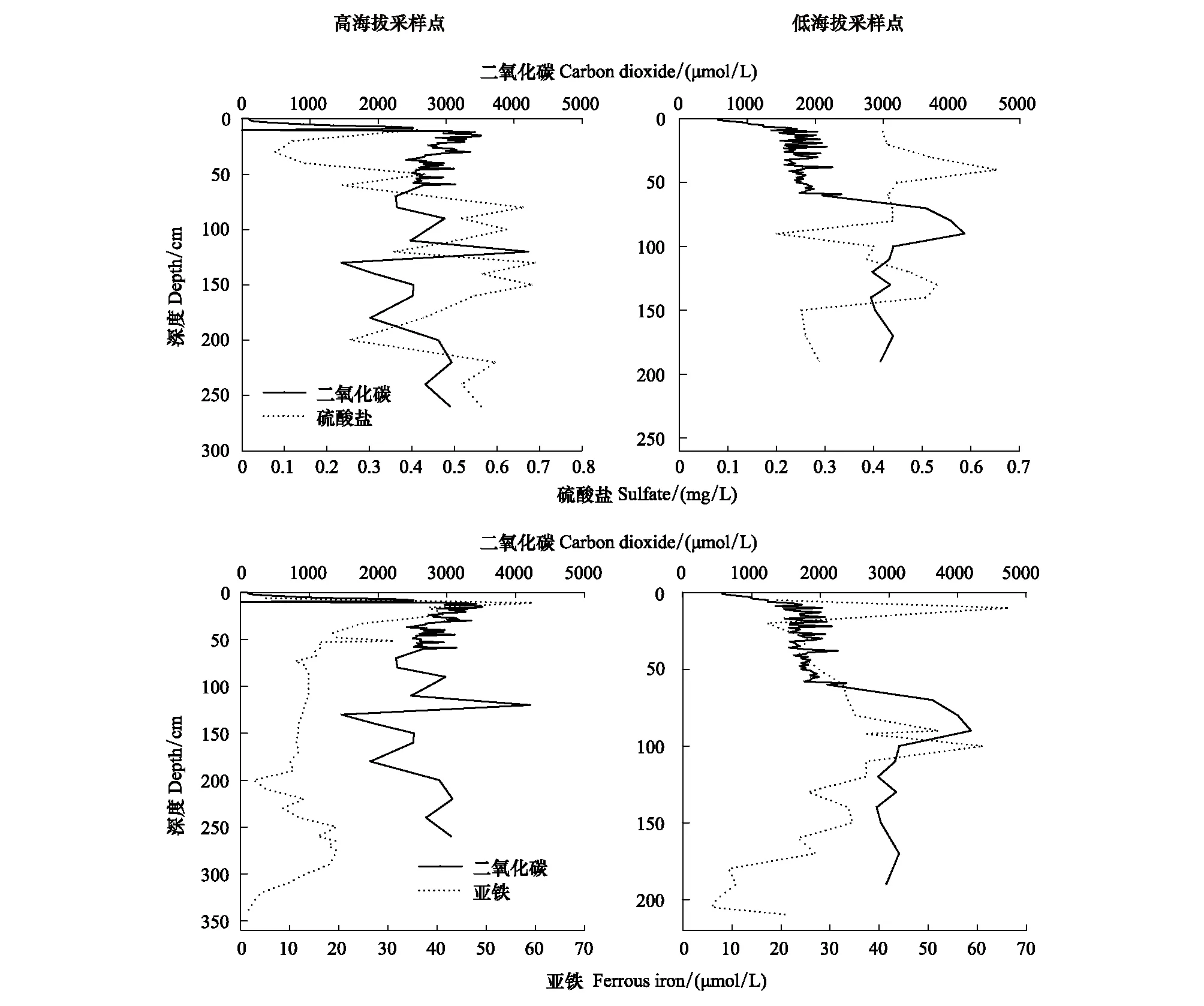
图6 不同采样点中二氧化碳和亚铁、二氧化碳和硫酸盐浓度随深度的分布Fig.6 Distributions of carbon dioxide and ferrous iron、carbon dioxide and sulfate concentrations with depth in different sampling sites
以上结果表明硫酸盐和亚铁均影响CH4、CO2排放,且硫酸盐影响高于亚铁。增加硫酸盐输入作为替代电子受体会使厌氧条件下碳矿化转向生成更多CO2,硫酸盐还原也可抑制CH4的生成。亚铁对于CH4生成一定程度上会起到低促高抑的效果,而对于CO2的生成的影响较弱。
3 结论
(1)两个采样点的总还原无机硫(Total Reduced Inorganic Sulfur, TRIS)浓度均随深度先增后减。TBP采样点的TRIS在上部(0—87 cm)平均浓度远高于下部(87 cm以下),表明该泥炭地上部深度范围内硫酸盐还原作用活跃。TBP泥炭地上部的H2S主要是通过微生物硫酸盐还原作用(BSR)生成,同时H2S在孔隙水扩散过程中易与阳离子Fe2+结合为FeS,进而与H2S、S或者聚硫化物经过一系列生物地球化学过程生成稳定的黄铁矿,在接近60 cm处反应减缓。表明活性铁是泥炭地中硫地球化学循环重要的参与者。
(2)根据各地球化学影响因素与DOC的相关性计算,TBP中DOC与亚铁呈显著正相关,与硫酸盐呈显著负相关。TSP中DOC 与亚铁呈显著正相关。DOC与亚铁、硫酸盐均有较强的相关性,是由于泥炭地中水位的波动会影响氧化还原程度和微生物活性。相关性计算结果表明,在厌氧环境中,铁氧化物被还原溶解产生亚铁,与其结合的有机碳被释放到溶液中从而导致DOC浓度的升高;而硫酸盐作为电子受体被还原的过程中消耗酸度使pH值升高,泥炭孔隙水中微生物活性增强,DOC浓度由此增加。地下水位变化引起的铁、硫的氧化还原活动对泥炭地碳循环的直接和间接影响具有重要意义。
(3)两处采样点的高硫酸盐浓度、TRIS浓度均对应较低的CH4浓度,表明较高的硫酸盐浓度以及硫酸盐还原过程都会抑制CH4的生成。两处采样点的CO2/CH4均高于4,表明硫酸盐作为替代电子受体会使厌氧条件下的碳矿化转向更多的CO2和更少的CH4生成。而两处采样点亚铁与CH4、CO2只有特定深度范围的相关性,亚铁对于CH4生成一定程度上会起到低促高抑的效果,而对于CO2的生成影响较小。铁的还原对于CH4、CO2的生成影响小于硫酸盐。
