渗滤液中聚苯乙烯微塑料表面老化行为及抗性基因的富集规律
2022-01-16苏应龙庞蕊蕊邵博群张中键
苏应龙,庞蕊蕊,邵博群,张中键,谢 冰
(华东师范大学生态与环境科学学院,上海200241)
塑料制品以其轻便等特点在日常生活和工业生产中被广泛使用,然而由于其难降解的特性而导致的塑料污染成为重要的环境问题之一。与此同时,废弃塑料在紫外线照射、风力等外界作用下逐步破碎化而形成一类广受关注的新兴污染物——微塑料。微塑料是指粒径小于5 mm的塑料颗粒。目前,微塑料已经被证实在海洋、土壤等中普遍存在[1-2]。环境中的微塑料容易与其他污染物发生相互作用。研究发现,微塑料表面可以富集重金属和有机污染物,从而改变后者迁移转化规律和传播风险[3-4]。He等[5]、Su等[6]的调查显示,垃圾填埋系统中的渗滤液已成为微塑料的重要污染源。同时,渗滤液中存在抗生素抗性基因(ARGs)等具有较高风险的新兴污染物。微塑料表面会富集ARGs[7],但是在渗滤液中,微塑料的存在是否会影响ARGs的环境行为还有待进一步探究。
在自然环境中,塑料和微塑料颗粒在阳光、风力等作用下逐步发生老化,从而改变其表面性质,而性质的变化导致微塑料的环境行为以及对其他污染物的影响效应发生改变[8]。Liu等[9]研究紫外加速老化对聚苯乙烯(PS)、聚氯乙烯(PVC)与环丙沙星(CIP)吸附相互作用的影响,发现老化后的塑料具有更强的吸附能力。由此可见,研究微塑料老化过程对其他污染物的影响可准确评估其实际环境效应。在渗滤液体系中,存在除了微塑料之外的多类型新兴污染物,如具有较高传播扩散风险的抗性基因[10]。已有研究发现,海洋环境中微塑料的存在可以促进ARGs的传播[11-12]。然而,目前尚未有研究分析长期存在于渗滤液体系中微塑料的老化过程对ARGs行为的影响。
以环境中存在浓度较高的PS微塑料为例,分析其在渗滤液体系中的表面性质变化,揭示其自然老化规律。在此基础上,分析PS微塑料老化过程对ARGs的富集效应,并从微生物群落富集、微生物与ARGs的关联关系和调控基因表达等方面揭示影响机制。
1 材料和方法
1.1 实验材料
实验所用的PS微塑料购自中国上海阿拉丁生化科技股份有限公司,尺寸为0.5~3.0 mm。PS是颗粒类和泡沫类塑料的主要成分,主要来源为生活用品及水上泡沫浮标等[13]。渗滤液取自位于上海浦东的老港垃圾填埋场。作为生活垃圾填埋场,该填埋场生活垃圾日接收量约为1.2万吨。原始渗滤液样品用500 mL的玻璃瓶从渗滤液调节池中提取,并用铝箔覆盖瓶盖内部避免塑料瓶盖受到污染,然后装进密封的盒子内保存并带回实验室。
1.2 批次实验
为避免渗滤液中固有微塑料和其他颗粒态杂质的干扰,实验前对渗滤液进行300目(目=孔·m-2)的筛网过滤处理。将PS微塑料添加到含100 mL渗滤液的锥形瓶中,保证PS微塑料的最终含量为300~400个·L-1,该数值约为实际渗滤液中PS微塑料含量的10倍[5-6]。将锥形瓶置于(30±1)℃、200 rpm的摇床中以模拟实际渗滤液流动过程,进而分析其中PS微塑料的长期老化行为,分别在30、60、90 d后取样进行分析。从锥形瓶中提取含有PS微塑料的渗滤液样品,其中的PS微塑料颗粒用不锈钢筛分离后用于分析物理化学特征、表面附着微生物群落和ARGs相对丰度。过滤后的渗滤液用于测定微生物群落和ARGs相对丰度。所有实验操作均含有3个平行样品。
1.3 PS微塑料表面特征
在对提取的PS微塑料进行表面理化性质分析之前,先用体积分数为30%的H2O2消化,再用双蒸水(ddH2O)冲洗3次,去除表面附着的微生物和有机物。得到的PS微塑料进一步自然干燥,以进行后续理化性质表征。
PS微塑料的热稳定性采用热重分析仪STA449F3(NETZSCH,Germany)分析。PS微塑料质量为10 mg,通过N2吸附/脱附,以10℃·min-1的升温速率加热到800℃。采用比表面积和孔隙度分析 仪(ASAP 2460,Micromeritics,USA)和Brunauer-Emmett-Teller(BET)吸附模型确定PS微塑料的比表面积。使用EscaLab 250Xi X射线光电子能谱仪(XPS)(ThermoFisher Scientific,USA)对PS微塑料表面元素组成进行分析,XPS测量光谱能量为70 eV、能量跃迁为1.0 eV,C1s和O1s高分辨率光谱能量为30 eV、能量跃迁为0.05 eV。使用XPSpeak软件(4.1版)处理高分辨率光谱信号。在衰减全反射模式下利用傅里叶变换红外光谱(FTIR)扫描PS微塑料,波长范围为4 000~600 cm-1,分辨率为4 cm-1。利用红外分析软件(OMNIC)对红外光谱图进行处理,根据FTIR结果计算羰基指数(CI)来确定PS微塑料表面的老化程度,CI为羰基部分(1 780~1 600 cm-1)与亚甲基部分参考峰(1 490~1 420 cm-1)的峰面积比值[14]。
1.4 DNA提取和ARGs定量
用PowerSoil DNA试剂盒(MoBio,USA)提取PS微塑料颗粒和渗滤液样品的总DNA。用SMA4000分光光度计(Merinton,China)检测DNA含量,提取的DNA保存于-20℃条件下用于后续的ARGs定量和微生物群落分析。
采用实时定量聚合酶链式反应(PCR)在CFX96(Bio-Rad,USA)上检测ARGs丰度[15-16]。本研究的目标基因包括氨基糖苷类耐药基因(aadA1和str B)、β-内酰胺类耐药基因(blaOXA和blaTEM)、磺胺类耐药基因(sul1和sul2)、四环素类耐药基因(tetQ)和整合子(intI1和intI2)。这些ARGs在渗滤液及其他环境中检出频率较高[15-16]。实时荧光定量PCR(qPCR)在96孔板中进行,分析试剂包括2.50μL 10x缓冲液(25 mmol·L-1Mg2+)、0.50μL dNTPs(10 mmol·L-1)、0.50μL Taq聚合酶(2.50 U)、0.50μL引物1(10μmol·L-1)、0.50μL引物2(10 μmol·L-1)、1μL DNA模板和19.50μL ddH2O。引物序列、扩增子大小和目的基因退火温度见参考文献[17]。扩增程序:95℃预变性5 min;PCR循环(94℃,30 s,在一定温度下退火30 s,72℃扩增30 s,循环40次);74℃扩增30 s。所有目标基因的扩增效率在(100%±10%)内,R2≥0.99。拷贝数由标准曲线确定,ARGs的数量由16S rRNA基因归一化后的相对丰度评估。
1.5 微生物群落分析
利用Illumina Miseq 2000平台对细菌16S rRNA的基因高变区(V3-V4)进行扩增、纯化、定量并测序,以研究渗滤液和PS微塑料上的细菌群落结构。生成的序列通过Ribosomal Database Project(RDP)将引物、低质量、歧义碱基序列过滤掉,从而得到高质量序列[18]。利用QIIME(v1.8.0)中的聚类算法UCLUST以97%的相似度对得到的高质量序列进行操作分类单元(OTU)聚类分析,然后选择每个OTU的代表性序列,利用Greengenes数据库以0.80的置信阈值分配到分类系统中。通过计算α-多样性来评价细菌的丰富度,β-多样性来分析样品间基于Bray-Curtis距离的细菌组成结构差异。基于这些序列,利用Picrust预测部分功能基因的表达水平。
1.6 数据分析
采用SPSS 22.0软件(IBM公司,USA)进行统计分析。采用方差分析(ANOVA)明确样品ARGs丰度差异,将P<0.05作为统计学意义上的显著差异。采用R(V 3.3.2)中的软件包vegan、Hmisc和igraph构建网络来分析渗滤液和PS微塑料表面ARGs与微生物群落结构的关联,网络由软件Gephi(V 0.9.2)绘制。
2 结果与讨论
2.1 渗滤液中PS微塑料的理化性质变化
在自然环境下,PS微塑料易发生老化现象,从而导致表面理化性质的改变。采用热重分析揭示PS微塑料的热稳定性变化。如图1a所示,相比老化前PS微塑料颗粒,渗滤液中自然老化90 d后的PS微塑料颗粒的热重性质发生了显著改变。特征温度T5,即失重率为5%时对应的温度,是用来表示聚合物低温热性能的重要指标[19-20]。渗滤液中老化后PS微塑料的T5值从老化前PS微塑料的370℃降至293℃,而T5值越低,表示样品中存在越多的不稳定中间体,可在中低温条件下被分解。随着温度升高至800℃,老化后PS微塑料仍存在8.5%的残留物质,显著高于老化前PS微塑料(1.2%)。原因可能是,渗滤液中的微生物降解作用导致易降解组分含量降低,从而难降解组分相对百分比较高。此外,老化过程也可能形成高温下难以分解的高度交联结构[21]。

图1 PS微塑料颗粒在渗滤液中老化90 d前后的性质表征Fig.1 Characteristics of PS MPs before and after being aged in leachate for 90 d
老化前后PS微塑料的比表面积、元素组成等理化参数如表1所示。老化后PS微塑料的比表面积增加了1.5倍。为了研究PS微塑料表面元素组成的变化,利用X射线光电子能谱(XPS)对其元素含量进行表征(见图1b)。图1b中,氧和碳的结合能分别为532 eV和284.9 eV。显而易见,与老化前PS微塑料相比,老化后PS微塑料的氧元素含量更高,wO/wC为0.20,高于老化前的0.04,该结果表明老化后PS微塑料表面含氧基团显著增多。进一步采用C1s高分辨率谱分析表面基团的形式,其中284.6 eV和286~287 eV分别对应主峰C-C键和C-O键,结果表明C-O键是老化后PS微塑料表面存在的主要含氧基团。

表1 渗滤液老化前后PS微塑料的表面性质Tab.1 Surface properties of PS MPs before and after being aged in leachate
图2是PS微塑料在渗滤液老化过程中的红外光谱图。从图2可以看出,老化后PS微塑料颗粒在部分波数的信号增强,即形成新的基团,如RC-OH(1 168 cm-1处的C-O伸缩振动,1 360 cm-1处的O-H面内弯曲振动)、RCOOH(1 732 cm-1处的C=O伸缩振动,960 cm-1处的O-H面外弯曲振动)和Ar-OH(1 380 cm-1处的C-O伸缩振动)。此外,羰基指数是评价微塑料表面氧化程度的重要指标[19,22]。在渗滤液老化90 d后PS微塑料的羰基指数为0.35,高于老化前PS微塑料的0.11,因此自然老化增加了PS微塑料表面的氧化程度。然而,渗滤液中自然老化的微塑料的羰基指数低于高级氧化处理的微塑料[22],这表明相比物理化学处理手段,自然老化过程造成的氧化程度较低。同时,在渗滤液的自然老化过程中,PS微塑料表面变化主要是形成C-O的基团发生氧化,其氧化程度低于C=O。
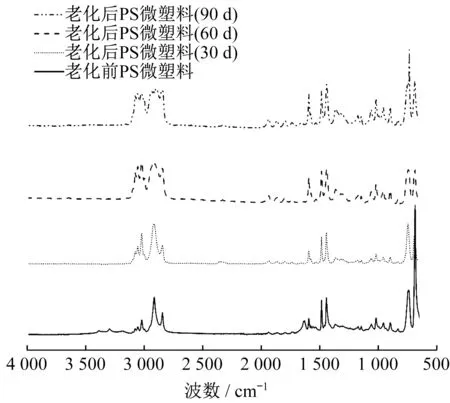
图2 不同老化时间下PS微塑料的红外光谱Fig.2 FTIR spectra of PS MPs before and after being aged in leachate for different aged days
2.2 老化过程中PS微塑料表面上ARGs和微生物群落的演变过程
除了PS微塑料,抗生素抗性基因(ARGs)也是渗滤液中存在的高风险新兴污染物之一[6,16]。研究发现,环境中的微塑料可富集重金属、抗生素等污染物,从而增加其扩散风险[23-25]。Lu等[26]在2019年报道了海洋环境中PS微塑料表面可富集ARGs。上述结果证实,渗滤液中PS微塑料表面性质会发生改变,而性质变化会影响其对污染物的吸附行为。鉴于此,通过定量分析渗滤液中PS微塑料表面上ARGs的丰度,明确老化过程中PS微塑料对ARGs影响规律的变化。如图3所示,随着老化时间的增加,PS微塑料表面上ARGs如sul1、blaOXA、blaTEM、tetQ和intI2的相对丰度显著高于渗滤液体系中,富集倍数为1.9~31 200.0倍,而aadA1、strB、sul2、intI1等ARGs则无明显富集现象。Lu等[26]的研究也发现,微塑料上总ARGs相对丰度远远大于水中对应值。因此,渗滤液体系中可在PS微塑料表面富集ARGs,并且老化过程可增强富集效果。
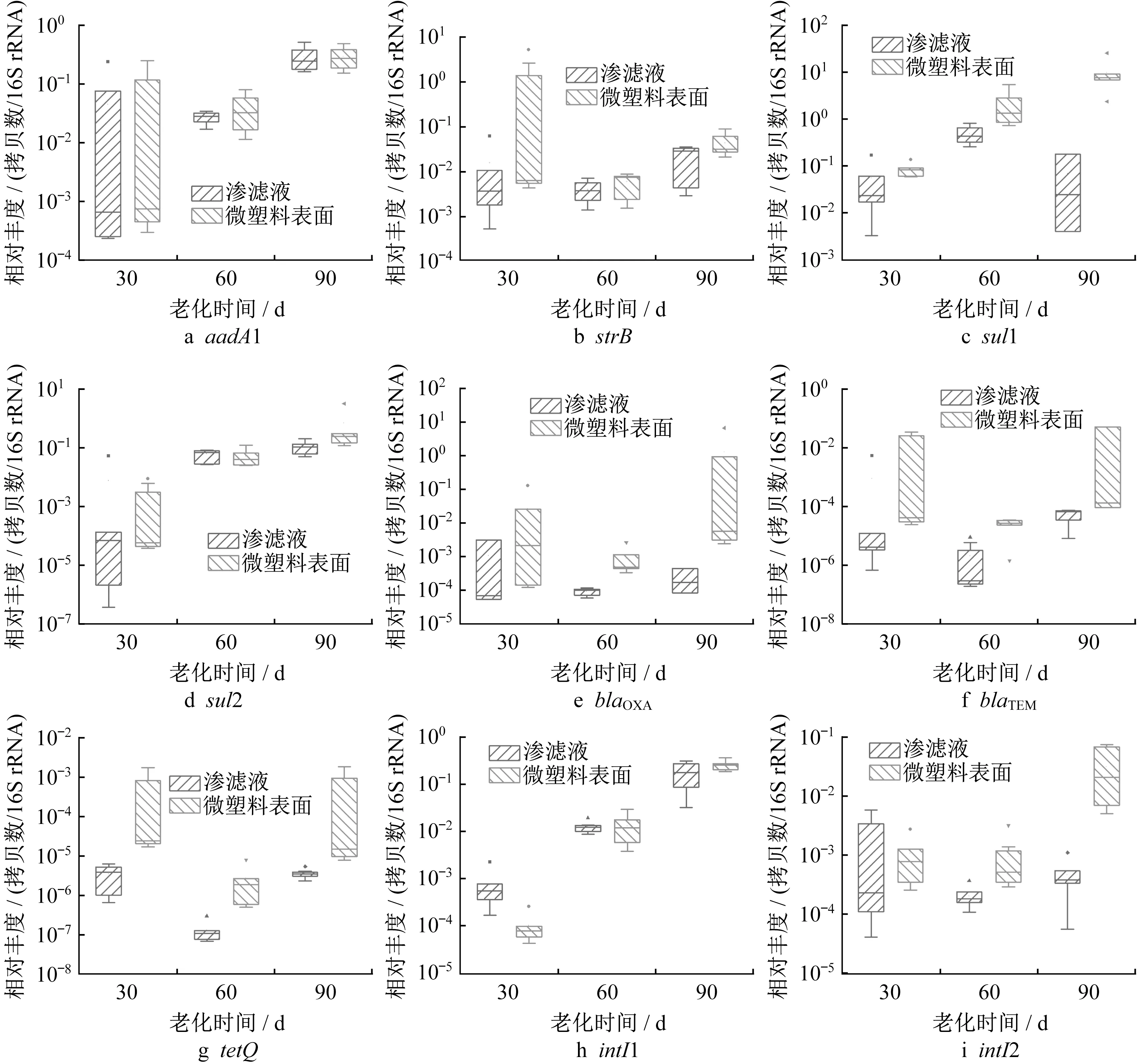
图3 目标ARGs在渗滤液中和PS微塑料表面上相对丰度变化箱线图Fig.3 Boxplot of relative abundance variations of target ARGs in leachate and on PS MPs’surface
细菌群落是决定ARGs环境行为的重要因素之一[6,16]。大量研究表明,微塑料表面可附着和定殖微生物群落,尤其是病原菌[27-28]。因此,进一步分析老化过程中渗滤液和PS微塑料表面微生物群落结构变化规律。在属水平上,共检测到20个属,其中棒状杆菌属(Corynebacterium)在所有样本中为主要组成属,相对丰度为17.318%~71.812%。孢子虫属(Sporosarcina)在第30天和第60天渗滤液中和PS微塑料表面上均为主要菌属,平均相对丰度分别为24.6%和15.1%,而空白组在第60天未检出,在第90天所有样本中均未检出。特吕珀菌属(Truepera)在第30天未检出,在第60天开始检出,其中空白组先提高后降低,渗滤液中和PS微塑料表面上在第90天时相对丰度分别增加到了9.30%和15.03%。赖氏菌属(Leifsonia)在第60天检出,在第90天渗滤液中相对丰度显著增加,达到29.10%。此外,在PS微塑料老化过程中,溶杆菌属(Lysobacillus)、芽孢杆菌属(Bacillus)、少盐芽胞杆菌属(Paucisalibacillus)和假棍状杆菌属(Pseudoclavibacter)在渗滤液中和PS微塑料表面上相对丰度均有所下降。对渗滤液中和PS微塑料表面上主要菌群相对丰度进行比较,PS微塑料表面上棒状杆菌属的相对丰度是渗滤液的1.52~2.05倍。由此可见,PS微塑料对棒状杆菌属具有较强的选择富集能力,而棒状杆菌属是一种重要的病原菌。该结果与文献报道结果类似,即微塑料可作为致病菌的主要载体,具有致病性的微生物在其表面上进行富集从而增加环境风险[29]。随着渗滤液中PS微塑料表面结构发生变化,其表面更易吸附和定殖微生物,而不同类型微生物的定殖和富集能力具有差异,从而导致微生物相对丰度变化规律不同。因此,随着老化过程的进行,赖氏菌属的相对丰度逐渐增加,而其他部分微生物的相对丰度(如假棍状杆菌属、溶杆菌属、芽孢杆菌和少盐芽胞杆菌属)呈现降低趋势。
2.3 老化过程中PS微塑料表面上ARGs变化机制
采用网络分析进一步从群落结构变化的角度揭示PS微塑料表面上ARGs的富集规律。图4a和4b分别为整个实验周期所测得的渗滤液中和PS微塑料表面上目标ARGs与微生物属之间的关联网络。其中,渗滤液体系中ARGs与34个属相关,而PS微塑料表面上ARGs相关微生物属为25个,即渗滤液中的ARGs潜在宿主具有更高的多样性。此外,通过分析网络的拓扑性质可以发现,PS微塑料表面上的ARGs-微生物网络的网络直径(ND)和聚类系数(CC)分别为3.28和0.47,高于渗滤液中相应的属性值(2.82和0.40),较高的网络直径和聚类系数表明PS微塑料表面上的微生物与ARGs存在更为紧密的关联关系,即宿主微生物在ARGs的传播中发挥更为明显的作用。网络分析结果与微生物群落结构演变过程相符合。通过图4可以发现,目标ARGs与棒状杆菌属没有相关性,即棒状杆菌属不是ARGs的潜在宿主微生物,因而其他ARGs宿主微生物在PS微塑料表面上的大量富集导致棒状杆菌属相对丰度降低。另外,特吕珀菌属和赖氏菌属与目标ARGs相关性较高,这与两者在老化过程中相对丰度从低到高的变化紧密相关。以上结果表明,PS微塑料表面上的ARGs与微生物具有更为密切的关联作用,即形成区别于渗滤液体系的特定生态位。
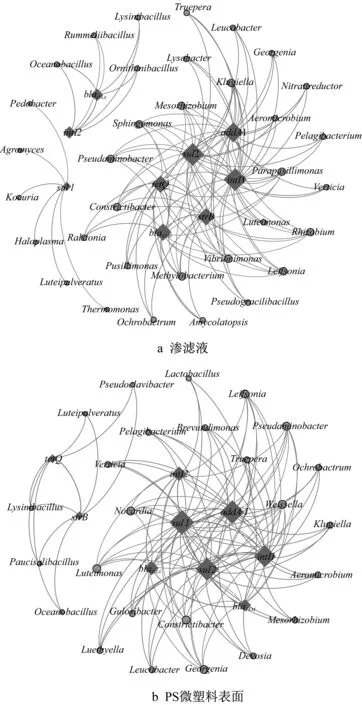
图4 渗滤液中和PS微塑料表面上ARGs与潜在宿主属的相互作用网络分析Fig.4 Network analysis of co-occurrence of ARGs and potential host genera in leachate and on PS MPs’surface
除了细菌群落,ARGs的变化受到微生物基因水平的调控。基于此,采用Picrust分析预测了部分与调控抗性基因相关基因的相对丰度。图5表示部分功能基因的表达水平,基因表达单位为RPKM,即百万序列中来自于目标基因每千碱基长度的序列数。其中,tcaB(K07552)为调控大环内酯类抗生素抗性的基因,pcoD(K07245)和nrsD(K07785)分别编码针对重金属铜和镍抗性的蛋白。大量研究表明,微生物对抗生素与重金属抗性具有较强的共选择效应[30-31]。本研究中,PS微塑料表面上微生物中抗生素和重金属抗性相关调控基因的表达水平显著高于渗滤液体系中。由此可见,PS微塑料表面定殖的微生物具有显著区别于渗滤液的生态位,其中涉及抗生素抗性调控的基因表达水平较高而导致PS微塑料表面ARGs相对丰度高于渗滤液。此外,PS微塑料老化过程中伴随着部分降解,PS微塑料表面上微生物群落演变过程可能与能够降解塑料的微生物相关,从而使得相关的ARGs发生改变。
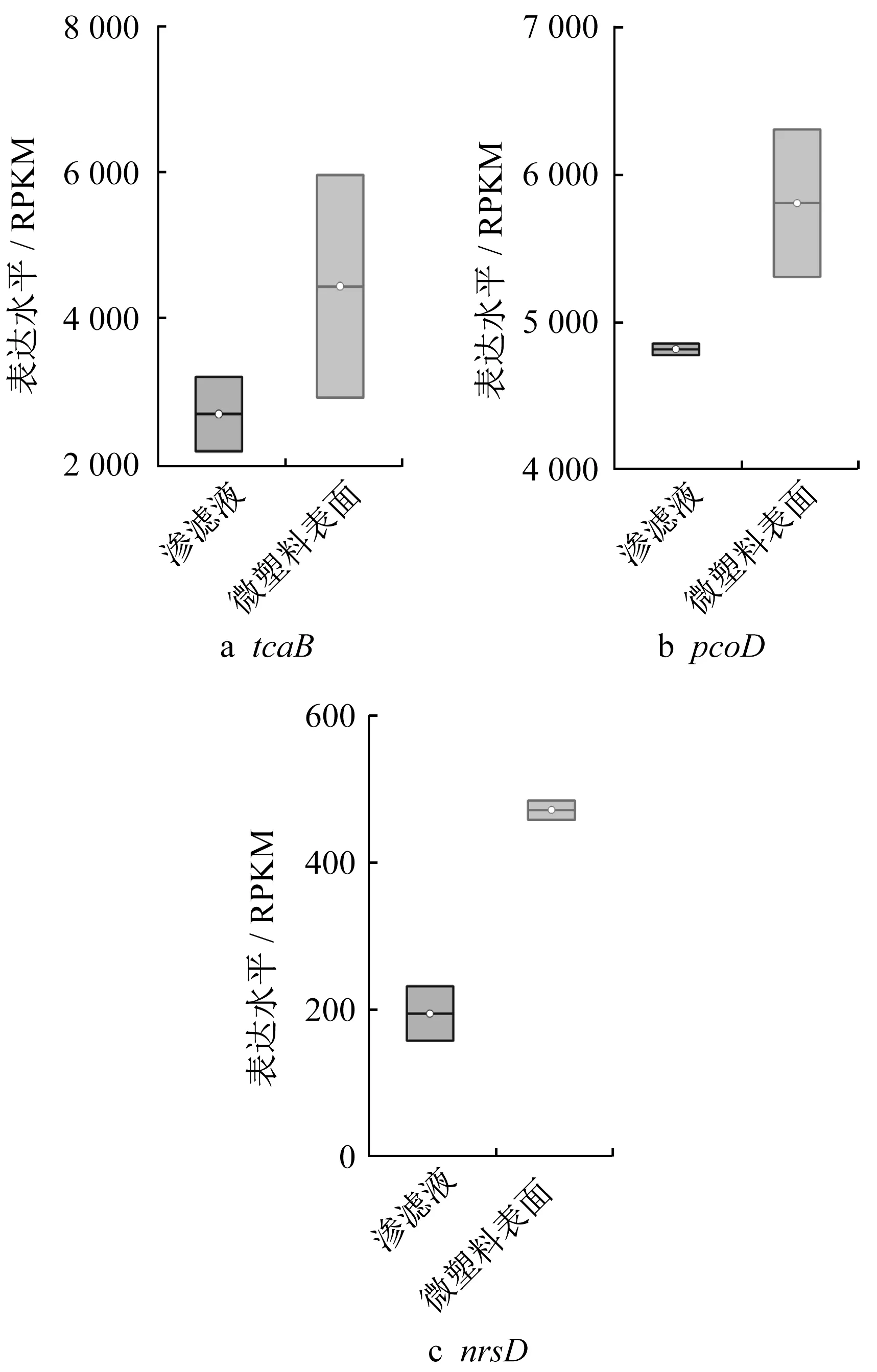
图5 渗滤液中和PS微塑料表面上与ARGs相关的部分功能基因表达水平Fig.5 Predicted expression level of typical functional genes involved in ARGs propagation in leachate and on PS MPs’surface
3 结论
(1)渗滤液中长期存在的PS微塑料颗粒发生老化现象,90 d老化后可导致其表面理化性质改变,包括热稳定性改变、比表面积变大、C-O基团含量增加等。
(2)渗滤液中PS微塑料表面上选择性富集ARGs,并且随着老化时间延长富集倍数显著增加。此外,PS微塑料表面附着的微生物群落中含有更高相对丰度的病原菌。
(3)相比渗滤液体系中,PS微塑料表面上ARGs与微生物形成更为稳定和密切的关联关系,参与抗生素抗性的调控基因表达水平较高。这些结果都导致PS微塑料表面上ARGs相对丰度较高,从而增强ARGs的扩散风险。
