德宏州油茶炭疽病病原鉴定及其生物学特性
2022-01-14周嫒婷尹加笔沈德周马焕成伍建榕
周嫒婷,王 芳,尹加笔,沈德周,马焕成,伍建榕
(1.西南林业大学 a.云南省高校森林灾害预警控制重点实验室;b.西南地区生物多样性保育国家林业局重点实验室,云南 昆明 650224;2.德宏州林业和草原局,云南 德宏 678400)
油茶(Camellia oleifera)属于山茶科(Theaceae)山茶属(Camellia)[1],是我国特有的常绿四大本木油料树种之一[2],其榨取的食用油素有“东方橄榄油”的美誉之称,还可以用作医疗保健品、洗护产品、饲料等[3]。油茶集生态效益、经济效益和社会效益于一身,对于推进山区综合开发、维护国家粮油安全、改善人民健康状况、促进农民就业增收和加快国土绿化进程等都具有十分重要的作用[4]。近年来,随着油茶的规模化种植,真菌性病害、细菌性病害、寄生性植物病害等随之增加。真菌性病害是种类最多且最为严重的一类[5],如油茶软腐病、油茶叶枯病、油茶炭疽病等,其中炭疽病又是最严重的病害之一,病原菌侵入以后,受害部位出现不规则的或半圆形的黑褐色轮纹斑,后期会产生小黑点,最终导致油茶落叶、落果,严重阻碍油茶产业的健康发展。
油茶作为德宏州的重要经济树种,由于炭疽病的危害,全州油茶普遍呈现出产量和品质大幅下降的趋势。所以,为明确德宏州油茶炭疽病病原种类及特性,本研究拟采用组织分离法分离病原菌,结合形态学和ITS基因鉴定病原菌,并研究其生物学特性,以期为病害的综合防控提供可靠的理论基础。
1 材料与方法
1.1 材料
1.1.1 供试病害叶片
2020年6—8月在云南省德宏州梁河县中营油茶基地采集具有炭疽病典型症状的叶片,标本保存在西南林业大学生物多样性病理学实验室。
1.1.2 培养基
PDA培养基:1 L的培养基含200 g马铃薯,20 g葡萄糖,15~20 g琼脂;PSA培养基:1 L的培养基含200 g马铃薯,20 g蔗糖,15~20 g琼脂;OA培养基:1 L的培养基含20 g燕麦,15~20 g琼脂;以上培养基均121 ℃灭菌30 min。
1.2.3 仪器与试剂
仪器:高压蒸汽灭菌锅、超净工作台、接菌环、镊子、培养箱、微波炉等。
试剂:1‰升汞溶液、75%乙醇、95%乙醇,去离子水,蒸馏水,用于真菌分子鉴定的试剂购自生工科技有限生物公司。
1.2 方法
1.2.1 油茶炭疽病害野外调查
在德宏州梁河县中营油茶基地开展油茶炭疽病害的调查工作,随机取100株油茶树,每株按东、西、南、北4个方向调查发病情况,病害分级标准参考表1进行划分,发病率和病情指数[6]计算方法见式(1)和式(2)。

表1 林木病害分级标准Table 1 Standard for forest disease classification

式中:R为发病率;R1为调查病株数;R2为调查植株总数。
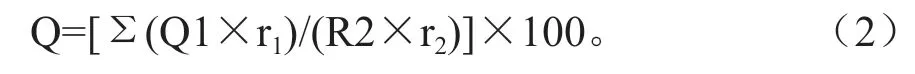
式中:Q为病情指数;Q1为各病级株数;r1各级代表值;R2为调查植株总数;r2为最高一级代表值。
1.2.2 油茶炭疽病原菌的分离和纯化
利用组织分离法[7]分离培养病原菌,即用刀片取病健交界处的小块组织。1)75%乙醇溶液消毒2~3 s,2)无菌水清洗,3)1‰升汞溶液浸泡1~6 min,4)无菌水清洗3遍以上,5)将组织块转移到PDA培养基中,25 ℃培养箱倒置培养,6)分离培养出的菌落进行2次以上纯化,直至获得纯培养的菌落,4 ℃斜面保存。
1.2.3 油茶炭疽病原菌的形态鉴定及ITS序列分析
形态鉴定将病原菌转接至PDA培养基上,观察记录菌落和分生孢子的形态特征。
ITS序列分析真菌DNA的提取参照真菌试剂盒方法进行。利用真菌通用引物18S[8]扩增ITS片段,反应后的PCR产物送硕擎生物有限公司进行测序,所得序列在NCBI数据库核酸BLAST进行比对分析和同源性搜索(网址:hhtp://www.ncli.nlm.nig.gov/),最后用Mega 6.0软件构建系统发育聚类图,明确菌株的分类地位。PCR反应体系(50 µL):25 µL Mix,20 µL ddH2O,1.5 µL ITS1,1.5 µL ITS4,2 µL DNA模板。PCR反应条件:94 ℃变性3 min,94 ℃变性30 s,56 ℃退火40 s,72 ℃延伸l min,共35个循环;72 ℃延伸10 min,4 ℃保存。
1.2.4 病原菌致病性测定及复合侵染
致病性验证采用柯赫氏法则[9]将培养获得的病原菌回接油茶叶片以检测其致病性。取健康的油茶叶片,用无菌水冲洗叶片,接着用75%的乙醇进行表面消毒,再次用无菌水冲洗3遍以上,最后用接种针在叶片中央刺伤4个小孔,备用。纯培养病原菌于25 ℃培养箱活化培养5~7 d后,用打孔器制成直径5 mm的菌饼,接种在叶片刺伤位置处,每处理3重复。复合侵染在同一叶片的刺伤位置先接种2.5 mm大小的病原菌块(菌株DHYC14),再接种2.5 mm大小的病原菌块(菌株DHYC30);反之,先接种2.5 mm大小的病原菌块(菌株DHYC30),再接种2.5 mm大小的病原菌块(菌株DHYC14),每处理3个重复。待叶片发病,病斑扩大,菌丝生长后,再次对病原菌进行鉴定,检测是否为最初接种的菌株。
1.2.5 病原菌生物学特性研究
1)不同培养基类型及PDA培养基上温度、pH和光照对病原菌的影响
用打孔器将病原菌纯培养菌落制成6 mm大小的菌丝块,分别移至新的PDA、PSA、OA培养皿中央,25 ℃培养箱倒置培养;PDA培养基分别设置5、10、15、20、25、30、35、40 ℃共8个温度梯度;用1 mol/L HCl 和1 mol/L NaOH溶液调节PDA培养基的酸碱度,分别设置5、7、9、11、13共5个处理,25 ℃培养箱倒置培养;设置连续光照、连续黑暗和光照黑暗12 h交替3个处理,25 ℃培养箱倒置培养;以上每处理5重复,培养5 d后用十字交叉法[10]测量菌落的直径大小。
2)不同碳源和氮源对病原菌生长的影响
以Czapek培养基为基础培养基[11]。以等量的葡萄糖、甘露醇、可溶性淀粉替换蔗糖,无碳源为对照,制成不同碳源培养基;以等量的蛋白胨、牛肉膏、甘氨酸替换硝酸钠,无氮源为对照,制成不同氮源培养基;以上每处理5重复,25 ℃培养箱倒置培养,5 d后用十字交叉法[10]测量菌落的直径大小。
1.3 数据处理与分析
采用Microsoft Excel 2010软件处理数据及制作图表,SPSS Statistics 17.0软件进行单因素ANOVA Duncan’s多重显著性分析,差异水平为P<0.05。
2 结果与分析
2.1 油茶炭疽病害调查结果
调查结果显示,随机抽取的100株油茶植株的发病率和病情指数分别为84%和33,可以看出该地区油茶炭疽病害发生严重。调查期间,主要危害叶片。多于叶缘或叶尖处发生,初期有褐色小斑点出现,随着时间的递增,逐渐扩大为不规则的褐色大病斑,并呈现出不规则的轮纹斑(图1A~B);后期病斑中央变成灰褐色,着生小黑点,叶背面隆起(图1C)。

图1 油茶炭疽病林间发病症状Fig.1 The symptoms of C.oleifera anthracnose in forest
2.2 病原菌的分离、形态特征及ITS基因系统发育聚类图
从疑似炭疽病的叶片中共分离到23株病原菌,选择菌落形态不同的代表菌株DHYC14和DHYC30做为供试菌株,用于完成后续分析。
形态学鉴定两株病原菌在PDA培养基上的菌落及分生孢子的形态特征均不同,结果见图2和图3。
由图2可以看出,菌株DHYC14在PDA培养基上,菌落呈圆形,初期气生菌丝白色,棉花状,菌落正反面有明显的轮纹圈;生长后期,菌丝变为浅灰色,背面中央处有黑褐色色素沉淀,且菌落边缘有橘黄色的油滴状外渗物,为分生孢子液滴(图2A);病原菌分生孢子盘蝶形、散生,未观察到刚毛,分生孢子梗光滑,无色,长短不一(图2B);分生孢子无色,卵圆或长圆形,大小为(15.1~18.0) µm × (4.4~5.8) µm(图2C)。

图2 菌株DHYC14菌落及分生孢子形态特征Fig.2 Morphological characteristics of colony and conidia for strain DHYC14
图3显示,菌株DHYC30在PDA培养基上,菌落圆形,初期菌丝白色,絮状,正反面有明显的轮纹圈;后期,菌落逐渐变为橘黄色,菌落中央有淡黄色透明渗出物,为分生孢子液滴(图3A)。病原菌分生孢子盘垫状,分生孢子梗简短,光滑,无色,见黑褐色刚毛着生(图3B);分生孢子卵圆形,单孢,无色,两端钝圆或一端略尖,大小为(11.0~15.1) µm × (3.1~5.0) µm(图3C)。

图3 菌株DHYC30菌落及分生孢子形态Fig.3 Morphological characteristics of colony and conidia for strain DHYC30
通过NCBI中核酸BLAST比对分析病原菌的ITS基因发育系统,发现菌株DHYC14与菌株jpsk12、YC07、XJ-1-4、P-35、HNJF-3的序列相似性均为100%,且与Colletotrichum fructicola种的菌株聚为一支,结合形态学(图2)将菌株DHYC14鉴定为果生炭疽菌(C.fructicola)。菌株DHYC30与菌株CBS 125378和C1276.1的序列相似性均为99.7%,且与C.siamense种的菌株聚为一支,结合形态学(图3)将菌株DHYC30鉴定为暹罗炭疽菌(C.siamense)。
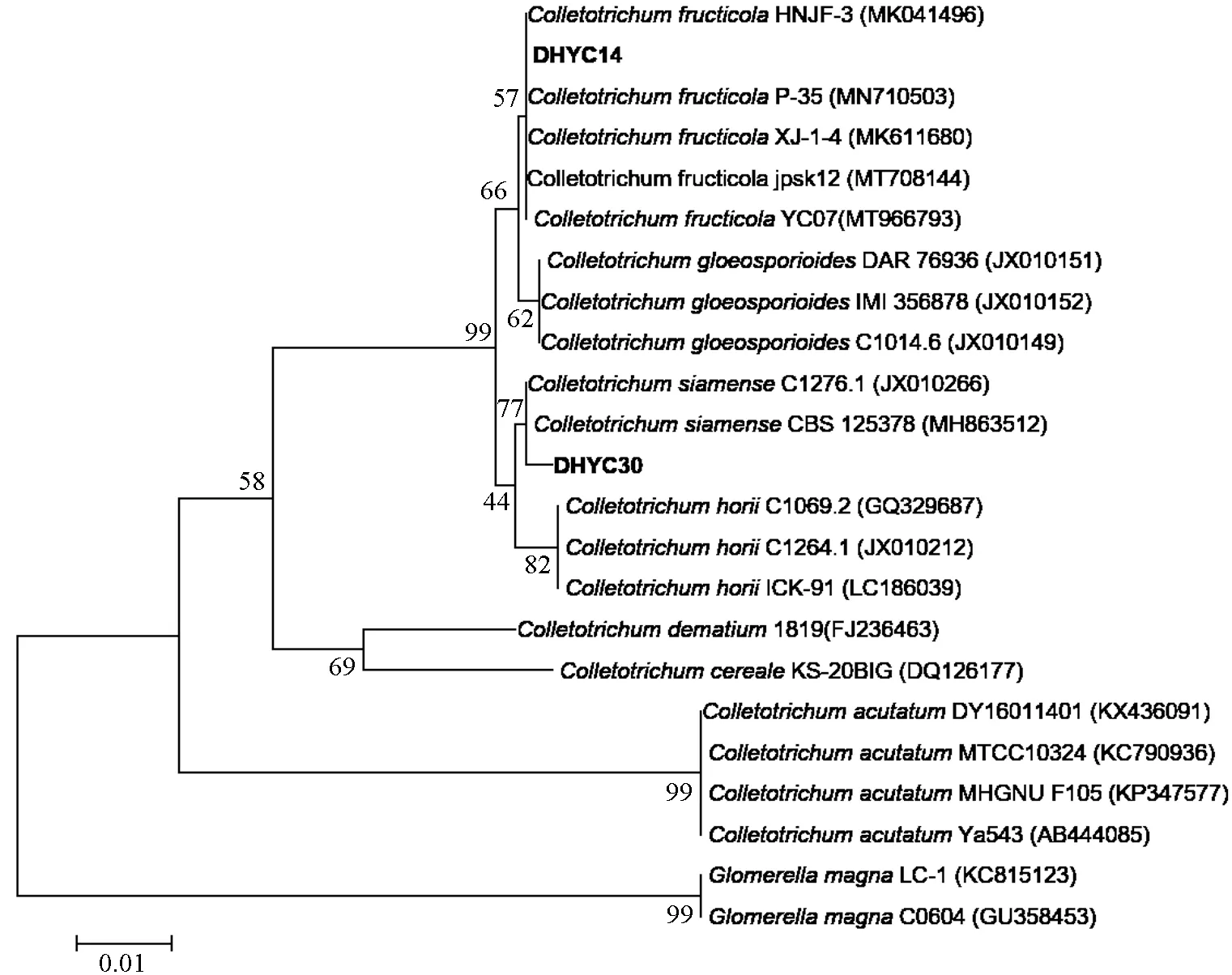
图4 两株病原菌的ITS基因系统发育分析Fig.4 Phylogenetic tree of Colletotrichum strains based on ITS genes

图5 病原菌回接油茶离体叶片效果Fig.5 The effects of different pathogen inoculation on detached leaves of C.oleifera
2.3 病原菌的致病性测定及复合侵染
两株病原菌回接后均能引起健康叶片产生轮纹状病斑,且与林间发病的症状相似,而对照在回接的整个过程均未发病,颜色仍未亮绿色,说明两株病原菌都是致病菌。回接第5 d,菌株DHYC14产生的病斑为6.17 mm,显著高于菌株DHYC30的病斑5.00 mm,说明前者的致病力强于后者。复合侵染显示,接种DHYC14+DHYC30产生的病斑为2.25 mm,接种DHYC30+DHYC14产生的病斑为2.17 mm(图6),可以看出混合接种病原菌所产生的病斑明显小于单独接种病原菌的。对回接后的病原菌再次进行分离培养,经鉴定仍为最初接种的菌株,完成科赫氏法则验证。

图6 病原菌回接油茶叶片的病斑大小Fig.6 The lesion diameter of C.oleifera leaves inoculated with pathogens
2.4 病原菌生物学特性研究
2.4.1 不同培养基类型对病原菌生长的影响
图7显示,两株病原菌在3种培养基上的生长表现不同。菌株DHYC14和DHYC30在PDA培养基上菌丝生长速率最快,分别为14.47、12.27 mm/d,PSA培养基次之,分别为13.77、12.1 mm/d,但两株病原菌在PDA和PSA培养基上的生长均无显著性差异;OA培养基上,两株菌的生长明显受到抑制,且培养基上菌落稀疏,菌丝颜色极浅,菌株DHYC14和DHYC30的菌落直径分别为49.67、53.67 mm。

图7 培养基类型对病原菌丝生长的影响Fig.7 The effects of different culture medium on the growth of pathogens
2.4.2 温度、pH和光照对病原菌生长的影响
图8可以看出,10~35 ℃范围内,两株病原菌均能正常生长。菌株DHYC14的最适生长温度是25 ℃,此时菌落直径最大,为72.67 mm,继续升高温度后,菌丝生长受限变得明显,40 ℃时,菌丝不生长,转移到25 ℃后,仍然不能生长,认为40 ℃为该菌株的致死高温;5 ℃时,未观察到菌丝生长,转移至25 ℃培养箱,菌丝能正常生长,认为5 ℃只是抑制了菌丝的生长,并非致死低温。菌株DHYC30的最适生长温度是30 ℃,菌落直径最大,达65.83 mm。同样发现,40 ℃是该菌株的致死高温,5 ℃仍未为抑制低温,而非致死低温。

图8 不同温度条件对病原菌丝生长的影响Fig.8 The effects of different temperature conditions on the growth of pathogens
图9显示,连续光照和连续黑暗对菌株DHYC14的菌丝生长无影响,而12 h光暗交替处理的菌落直径最小,为77.00 mm;光照不影响菌株DHYC30的生长,其菌落直径在63.67~64.00 mm范围内波动。

图9 不同光照条件对病原菌丝生长的影响Fig.9 The effects of different light conditions on the growth of pathogens
不同酸碱度处理(图10)表明,两株病原菌在pH 5~13范围内均能正常生长,但最适pH条件不同。菌株DHYC14在pH 5~7之间,菌落直径为70.17~71.00 mm,显著大于其他处理组。相反,菌株DHYC30则是在一定碱性环境下表现出较好的生长势,pH 11为最适生长条件,菌落直径达58.50 mm,pH 13时,菌落直径表现出下降的趋势。
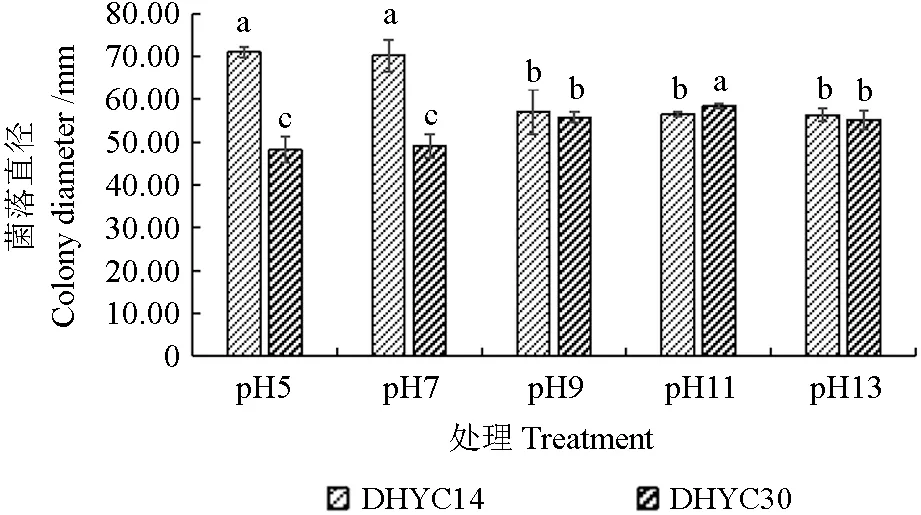
图10 不同pH值对病原菌丝生长的影响Fig.10 The effects of different pH values on the growth of pathogens
2.4.3 不同碳源和氮源对病原菌生长的影响
如图11所示,两株病原菌在不同碳源培养基上的生长势各不相同。菌株DHYC14在无碳源(CK)上生长最差,该培养基上菌落十分稀疏,颜色极浅;蔗糖、淀粉、甘露醇作为碳源时,该病原菌丝的生长无显著差异,直径在70.83~74.17 mm之间;当葡萄糖作为碳源时,菌落的直径显著低于其他处理组(CK除外),为66.33 mm。菌株DHYC30在无碳源(CK)上生长最差,菌落极其稀疏,颜色极浅;甘露醇为碳源时,生长最快,直径为64.17 mm,葡萄糖为碳源时,直径为59.00 mm,显著低于甘露醇,而蔗糖和淀粉为碳源的培养基上,菌落直径介于二者之间。

图11 不同碳源培养基对病原菌丝生长的影响Fig.11 The effects of different carbon sources on the growth of pathogens
如图12所示,菌株DHYC14在蛋白胨和甘氨酸为氮源的条件下,生长速率最快,菌落直径分别为71.17、70.83 mm,且菌丝较为密集,显著优于在牛肉膏和硝酸钠培养基上的生长;无氮源(CK)条件下,菌落十分稀疏,颜色极浅,但菌丝直径达67.5 mm。菌株DHYC30在以蛋白胨和硝酸钠为氮源时,病原菌的生长显著优于其他氮源处理,牛肉膏为氮源条件下,菌落直径最小,为48.33 mm;无氮源(CK)时,菌落直径虽为65.83 mm,但菌落极其稀疏,菌丝颜色极浅,生长势最弱。
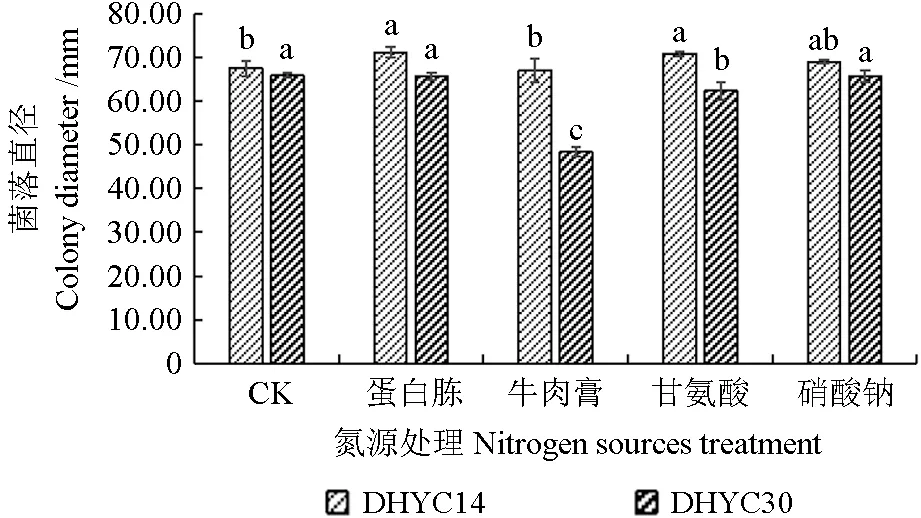
图12 不同氮源培养基对病原菌丝生长的影响Fig.12 The effects of different nitrogen sources on the growth of pathogens
3 结论与讨论
3.1 结 论
本次研究通过形态学结合分子生物学的方法明确了德宏州油茶炭疽病的病原是果生炭疽菌(C.fructicola)和暹罗炭疽菌(C.siamense)。回接油茶叶片发现,两株病原菌都能引起健康油茶叶片发病,认为二者均为致病菌,且菌株DHYC14(C.fructicola)的致病力比菌株DHYC30(C.siamense)的强。此外,两株病原菌在生物学特性方面存在差异。菌株DHYC14(C.fructicola)的最适培养基是PDA,连续黑暗条件下生长最好,最适生长温度为25 ℃,喜弱酸性环境pH 5~7,在以蔗糖为碳源、蛋白胨为氮源的培养基上长势最优。DHYC30(C.siamense)的最适培养基是PDA,光照对该病原菌丝生长无显著性影响,最适生长温度为30 ℃,喜弱碱性环境pH 11,最佳碳、氮源培养基分别为甘露醇、蛋白胨和硝酸钠。
3.2 讨 论
炭疽菌寄生范围十分广范,危害世界各地的作物,经济损失严重。油茶炭疽病是影响油茶产量和品质的主要及重要病害之一,但未见德宏州油茶炭疽病病原研究的相关报道。明确病害的病原是研究其发病规律和制定有效防治措施的前提。所以,本研究通过形态学结合分子生物学的方法明确了德宏州油茶炭疽病的病原是果生炭疽菌(C.fructicola)和暹罗炭疽菌(C.siamense),前人研究表明油茶炭疽病的病原菌多为这两种菌群,如李杨等[12]共分离获得海南省油茶炭疽病病原34株,其中19株为果生炭疽菌(C.fructicola),14株为暹罗炭疽菌(C.siamense);李河等[13]报道了湖南和广西油茶炭疽病的病原均为暹罗炭疽菌(C.siamense);李河等[14]对湖南省9个油茶主产区的炭疽病病原进行研究发现,果生炭疽菌(C.fructicola)的分离率最高,为64.5%,且在8个主产区均有分布,暹罗炭疽菌(C.siamense)的分离率次之,为14.5%,在6个采集地中都有分离到。这与诸多学者认为胶孢炭疽菌(C.gloeosporioides)才是引起油茶炭疽病的结论略有不同[15],但也可能是因地理来源不同而存在差异。
显微形态观察发现,两株病原菌的分生孢子中间都有油滴。菌株DHYC14(C.fructicola)的分生孢子无色、长圆形,无隔,大小在(15.1~18.0) µm×(4.4~5.8) µm,与学者研究相吻合[16];菌株DHYC30(C.siamense)的分生孢子卵圆形,单孢,无色,两端钝圆或一端略尖,大小为(11.0~15.1) µm×(3.1~5.0) µm,与Carbone等[17]的研究结果相符。致病性测定结果显示,两株病原菌都能引起健康油茶叶片发病,均为致病菌,且菌株DHYC14(C.fructicola)的致病力比菌株DHYC30(C.siamense)的强,这与李向阳[18]研究结果相一致,也有学者认为炭疽菌种类多样,部分形态、致病性、致病力存在较大的差异[19-20];单独接种病原菌产生的病斑明显大于混合接种的,这与廖旺姣等[21]发现的规律相一致,本文认为同属不同种之间的病原菌可能存在拮抗作用,有待进一步研究。
通过对果生炭疽菌(C.fructicola)和暹罗炭疽菌(C.siamense)的生物学特性研究明确了菌株DHYC14(C.fructicola)最佳培养基是PDA;最适温度为25 ℃,温度为5 ℃或40 ℃时菌丝均无法正常生长,这与宋丽丽等[22]对草莓果生炭疽菌(C.fructicola)生物学特性研究略有差异,该学者认为病原菌(C.fructicola)的最适生长温度是25~30 ℃,但菌株DHYC14的菌丝在25 ℃的长势优于30 ℃;最适pH为7,适宜在弱酸性环境(pH 5~7)生长,与刘倩丽等[16]、李沛利等[23]研究结果相似;连续黑暗条件下更有利于该病原菌丝的生长,与刘倩丽等[16]研究结果相反;碳源以蔗糖为最适,氮源以蛋白胨为最适,与李沛利等[23]的结果相符。菌株DHYC30(C.siamense)的最适培养基为PDA,最不适合OA培养基;最适温度为30 ℃,5 ℃或40 ℃条件下,菌丝均无法正常生长;适宜弱碱性环境(pH 9~11),最适pH为11;光照不影响病原菌丝的生长;可以利用多种碳、氮源,特别对碳源的营养要求不高,以甘露醇为最适;氮源以蛋白胨和硝酸钠为最适,这与罗敦文[24]研究结果相符。上述结果与前人研究结果略有不同之处的原因可能是与菌株的地理来源、分离的部位及不同菌株特性不同等有关。
本文明确了德宏州油茶炭疽病的病原种类,而生物学特性方面笔者只从种间的病原菌角度出发探讨了温度、pH值、光照、不同培养基、不同碳源和氮源对德宏州油茶炭疽病原菌丝生长的影响,存在一定的局限性,但是,这为德宏州油茶炭疽病的预测和防治提供了重要的理论依据。下一步工作将从油茶炭疽病的发生发展规律、炭疽病原菌的侵染过程及致病机理等方面深入开展,同时,种内不同地理来源病原菌的生物学特性及致病力有待进一步研究。通过本次研究结果可推测林间条件的变化与油茶炭疽病的流行有着密切的关系,德宏州夏季高温多雨为炭疽病的流行蔓延创造了条件,因此,在病害发生前期,应加强营林管理措施,保证林间的通风透光,尽量减少因病害造成的经济损失。
