新疆野苹果抗寒生理生化机制研究
2022-01-14刘立强乌仁其米格
张 博,刘立强,秦 伟,乌仁其米格
(新疆农业大学 a.资环学院;b.园艺学院,新疆 乌鲁木齐 830052)
新疆野苹果Malus sieversii(Ledeb)M.Roem是蔷薇科Rosaceae苹果属Malus植物,属于濒危二级重点保护植物[1],也是苹果遗传育种中的优良抗逆种质资源[2],国内主要分布在新疆伊犁河谷地区和准葛尔盆地西部,具有抗寒、抗旱、耐病虫和耐盐碱等优良抗逆性状[3]。有关苹果抗寒生理的研究报道很多:刘兴禄等[4]在对苹果抗寒砧木的研究中发现,抗寒性强的砧木品种能保持较高的酶活性;闫忠业等[5]比较分析低温下不同品种苹果的生理指标后发现,抗寒品种苹果枝条中的MDA含量低且较稳定、POD活性高、脯氨酸含量稳定;王贺等[6]在对苹果的研究中发现,低温下SOD和POD活性,抗寒性弱的品种低于抗寒性强的品种;邵静等[7]的研究结果表明,可溶性糖含量能够反映出苹果枝条受到低温胁迫,1—5月不同时期苹果1年生枝条中的可溶性糖含量与环境温差呈正相关,而与环境温度呈负相关;王飞雪[8]在对自然越冬的苹果砧木实生后代枝条生理指标的研究中发现,其枝条中的保护酶活性随着温度的降低而增强,而其可溶性蛋白、可溶性糖、MDA的含量却随着温度的降低均增大;闫娟娟等[1]在对新疆野苹果28个种下类型叶片解剖结构的研究中发现,小黄酸野苹果的叶片厚度、表皮厚度均最大,其栅栏组织和海绵组织均发达,而香酸野苹果的叶片厚度与栅海比均最小,对其各形态指标的综合评价结果表明,小黄酸野苹果的抗寒性显著强于香酸野苹果的抗寒性。然而,关于新疆野苹果抗寒性强的生理机制的研究报道少见。为给新疆野苹果抗寒性表达的生理机制研究提供理论依据,本研究在前人[1]研究的基础上,分别选用抗寒性相对强的小黄酸野苹果和抗寒性相对弱的香酸野苹果作为研究对象,对其1年生枝条各项抗寒生理指标进行了测定与分析,确定与新疆野苹果抗寒性紧密相关的生理学指标,以揭示新疆野苹果抗寒性强的生理机制。
1 材料与方法
1.1 供试品种
选取原生境中抗寒性相对强的小黄酸野苹果Malus sieversiif.luteolusD.F.Cui et L.Wang forma nov.和抗寒性相对弱的香酸野苹果Malus sieversif.aromaticusD.F.Cui et L.Wang forma nov.,以引种资源圃中相同种下类型的小黄酸野苹果M.sieversiif.luteolusD.F.Cui et L.Wang forma nov.和香酸野苹果M.sieversif.aromaticusD.F.Cui et L.Wang forma nov.作为对照。
1.2 取样的时间与地点和试材的采集
分别于2020年的10月8日、12月24日和2021年的3月28日即新疆野苹果处于其自然越冬过程中的休眠前期、休眠期、解除休眠期进行采样。生长于原生境中的供试材料其采样地点分别为霍城县大西沟乡野果林(东经80°46′42.00′′,北纬44°25′51.95′′)、巩留县库尔德宁镇大莫乎乡小莫乎沟野果林(东经82°47′53.28′′,北 纬43°11′56.16′′),生长于引种资源圃中的供试材料其采样地点为伊犁哈萨克自治州农业科学研究所资源圃(东经81°23′15.00′′,北纬43°55′55.4′′)。
每个采样地点选取1棵定点采样树,每个时期采样分别选取定点采样树的东、南、西、北这4个方位、生长均匀健壮且无病虫害的1年生枝条共40枝为试验材料,用湿润的无纺布将所采集的枝条样品包裹好,放入恒温箱带回实验室,以备相关生理指标测定之用。
1.3 测定指标与测定方法
采用电导法测定膜透性[9];采用考马斯亮蓝法测定可溶性蛋白含量,采用蒽酮比色法测定可溶性糖含量;采用茚三酮显色法测定脯氨酸含量,采用硫代巴比妥酸显色法测定丙二醛含量;采用愈疮木酚法测定过氧化物酶的活性,采用NBT光化还原法测定超氧化物歧化酶活性[10]。
1.4 数据处理与分析
采用Excel 2019软件进行初步的数据处理,采用SPSS 26.0软件进行显著性分析和主成分分析。
2 结果与分析
2.1 两个种下类型新疆野苹果在不同休眠时期的电导率的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条的电导率见表1。由表1可知,在原生境中,休眠前期的相对电导率,小黄酸野苹果的为0.27,香酸野苹果的为0.33,前者显著低于后者(P<0.05);休眠期与解除休眠期的相对电导率,小黄酸野苹果的分别为0.28和0.37,香酸野苹果的分别为0.32和0.39,前者均低于后者,但其差异均不显著(P>0.05)。在引种资源圃中,休眠前期的相对电导率,小黄酸野苹果的为0.27,香酸野苹果的为0.34,前者亦显著低于后者(P<0.05);休眠期与解除休眠期的相对电导率,小黄酸野苹果的分别为0.28和0.37,香酸野苹果的分别为0.31和0.38,前者均低于后者,但其差异也都不显著(P>0.05)。比较分析可知,无论是在原生境中还是在引种资源圃中,小黄酸野苹果在休眠前期的相对电导率均显著低于香酸野苹果在休眠前期的相对电导率,但其在休眠期和解除休眠期的相对电导率均无显著差异。
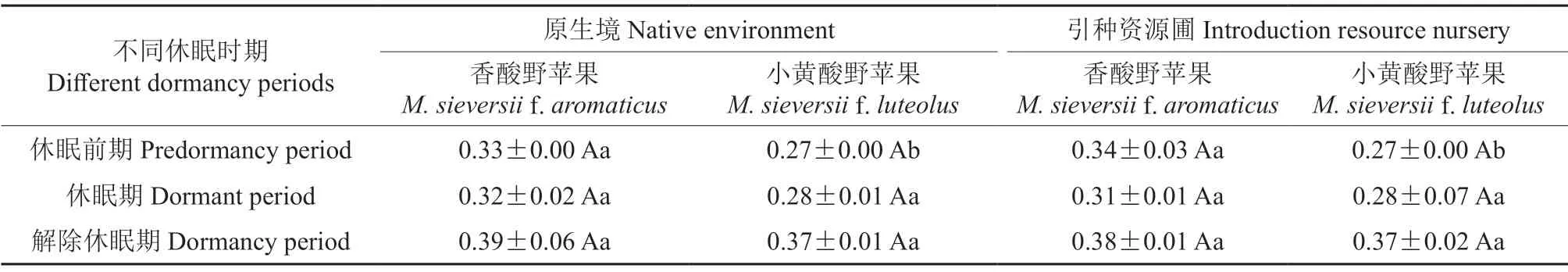
表1 不同休眠时期小黄酸野苹果和香酸野苹果枝条的电导率的差异分析结果†Table 1 Analysis results of the electrical conductivity difference of branches in different dormancy periods of M.sieversii f.luteolus and M.sieversii f.aromaticus
2.2 两个种下类型新疆野苹果在不同休眠时期的可溶性蛋白含量的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条中的可溶性蛋白含量见表2。由表2可知,在原生境中,休眠前期、休眠期和解除休眠期小黄酸野苹果和香酸野苹果枝条中的可溶性蛋白含量均无显著差异(P>0.05);进入休眠期后,小黄酸野苹果枝条中的可溶性蛋白含量增加了0.91 mg/g,香酸野苹果枝条中的可溶性蛋白含量增加了0.66 mg/g,前者明显高于后者。在引种资源圃中,休眠前期与休眠期小黄酸野苹果和香酸野苹果枝条中的可溶性蛋白含量均无显著差异(P>0.05);进入休眠期后,小黄酸野苹果枝条中的可溶性蛋白含量增加了0.56 mg/g,香酸野苹果枝条中的可溶性蛋白含量增加了0.25 mg/g,前者明显高于后者;在解除休眠期,小黄酸野苹果枝条中的可溶性蛋白含量(1.41 mg/g)极显著地小于香酸野苹果枝条中的可溶性蛋白含量(1.69 mg/g)。无论是在原生境中还是在引种资源圃中,小黄酸野苹果与香酸野苹果在其休眠前期和休眠期枝条中的可溶性蛋白含量均无显著差异,而在解除休眠期其含量却有差异。
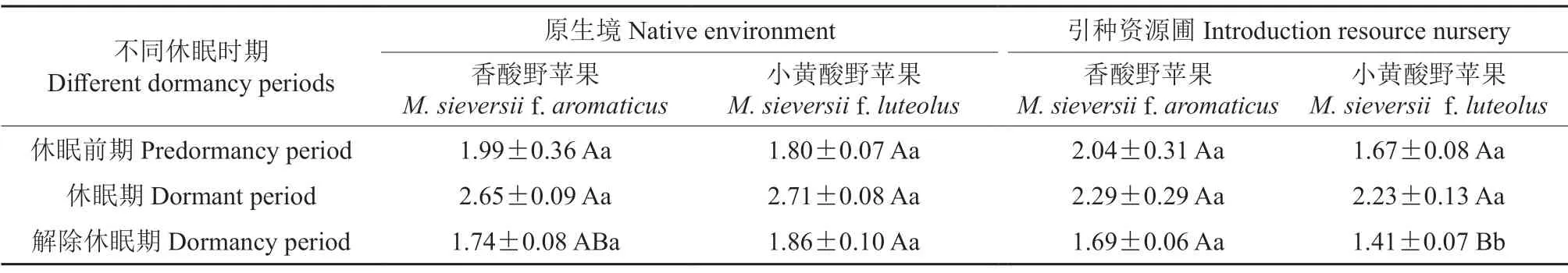
表2 不同休眠时期小黄酸野苹果和香酸野苹果枝条中可溶性蛋白含量的差异分析结果Table 2 Analysis results of soluble protein content in branches of M.sieversii f.luteolus and M.sieversii f.aromaticus at different dormancy periods mg/g
2.3 两个种下类型新疆野苹果在不同休眠时期的可溶性糖含量的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条中的可溶性糖含量见表3。由表3可知,在原生境中,休眠前期与解除休眠期小黄酸野苹果和香酸野苹果枝条中的可溶性糖含量均无显著差异(P>0.05);休眠期小黄酸野苹果的可溶性糖含量(5.22%)显著低于香酸野苹果的可溶性糖含量(5.63%,P<0.05)。在引种资源圃中,休眠期与解除休眠期小黄酸野苹果和香酸野苹果的可溶性糖含量均无显著差异(P>0.05);休眠前期小黄酸野苹果的可溶性糖含量(2.57%)极显著地小于香酸野苹果的可溶性糖含量(2.92%,P<0.01)。比较分析可知,引种资源圃中的小黄酸野苹果和香酸野苹果,在其休眠前期,枝条中可溶性糖的含量差异极显著(P<0.01);原生境中的小黄酸野苹果和香酸野苹果,在其休眠期,枝条中可溶性糖的含量差异显著(P<0.05);在其解除休眠期,无论是引种资源圃中还是原生境中的小黄酸野苹果和香酸野苹果,枝条中的可溶性糖含量均无显著性差异。

表3 不同休眠时期小黄酸野苹果和香酸野苹果枝条中可溶性糖含量的差异分析结果Table 3 Analysis results of soluble sugar content in branches of M.sieversii f.luteolus and M.sieversii f.aromaticus at different dormancy periods %
2.4 两个种下类型新疆野苹果在不同休眠时期的游离脯氨酸含量的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条中的游离脯氨酸含量见表4。由表4可知,在原生境中,休眠前期小黄酸野苹果的游离脯氨酸含量(142.21 µg/g)显著高于香酸野苹果的游离脯氨酸含量(122.03 µg/g,P<0.05);休眠期小黄酸野苹果的游离脯氨酸含量(83.71 µg/g)极显著高于香酸野苹果的游离脯氨酸含量(45.54 µg/g,P<0.01);解除休眠期小黄酸野苹果的游离脯氨酸含量(183.64 µg/g)极显著低于香酸野苹果的游离脯氨酸含量(298.45 µg/g,P<0.01)。在引种资源圃中,休眠前期小黄酸野苹果的游离脯氨酸含量(60.32 µg/g)极显著低于香酸野苹果的脯氨酸含量97.23 (µg/g,P<0.01);休眠期小黄酸野苹果的游离脯氨酸含量(55.74 µg/g)极显著高于香酸野苹果的脯氨酸含量(33.89 µg/g,P<0.01);解除休眠期小黄酸野苹果的游离脯氨酸含量(146.49 µg/g)极显著低于香酸野苹果的脯氨酸含量(357.47 µg/g,P<0.01)。比较分析可知,小黄酸野苹果和香酸野苹果枝条中的游离脯氨酸含量,原生境中的明显高于引种资源圃中的。

表4 不同休眠时期小黄酸野苹果和香酸野苹果枝条中游离脯氨酸含量的差异分析结果Table 4 Analysis results of free proline content in branches of M.sieversii f.luteolus and M.sieversii f.aromaticus at different dormancy periods µg/g
2.5 两个种下类型新疆野苹果在不同休眠时期的丙二醛(MDA)含量的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条中的丙二醛(MDA)含量见表5。由表5可知,在原生境中,休眠前期小黄酸野苹果的MDA含量(21.37 µmol/g)极显著高于香酸野苹果的MDA含量(17.54 µmol/g,P<0.01);休眠期小黄酸野苹果和香酸野苹果的MDA含量无显著差异(P>0.05);解除休眠期小黄酸野苹果的MDA含量(7.85 µmol/g)极显著高于香酸野苹果的MDA含量(2.91 µmol/g,P<0.01)。在引种资源圃中,休眠前期小黄酸野苹果和香酸野苹果的MDA含量无显著差异(P>0.05);休眠期小黄酸野苹果的MDA含量(11.46 µmol/g)极显著高于香酸野苹果的MDA含量(4.3 µmol/g,P<0.01);解除休眠期小黄酸野苹果的MDA含量(5.36 µmol/g)极显著高于香酸野苹果的MDA含量(4.65 µmol/g,P<0.01)。比较分析可知,小黄酸野苹果和香酸野苹果的MDA含量,只有在原生境中休眠期和引种资源圃中休眠前期的差异不显著,而在其他休眠时期的差异均极显著。
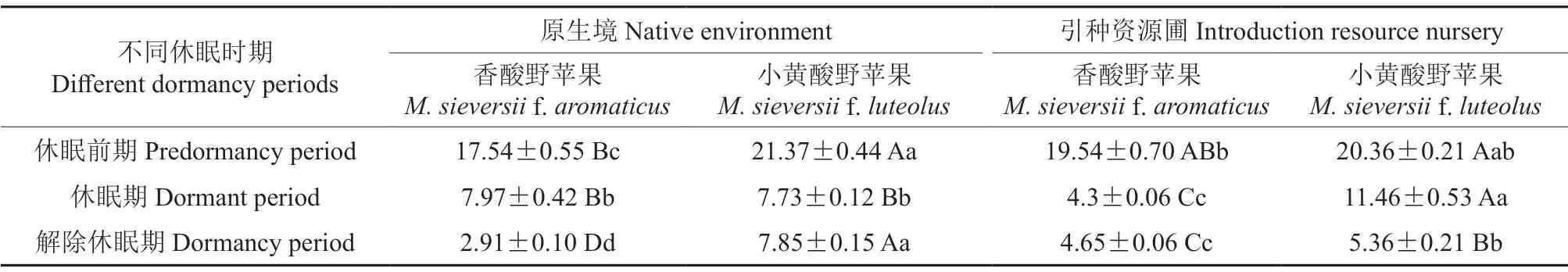
表5 不同休眠时期小黄酸野苹果和香酸野苹果枝条中丙二醛(MDA)含量的差异分析结果Table 5 Analysis results of malondialdehyde (MDA) content in branches of M.sieversii f.luteolus and M.sieversii f.aromaticus at different dormancy periods µmol/g
2.6 两个种下类型新疆野苹果在不同休眠时期的超氧化物歧化酶(SOD)活性的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条的超氧化物歧化酶(SOD)活性见表6。由表6可知,在原生境中,休眠前期、休眠期、解除休眠期小黄酸野苹果和香酸野苹果的SOD活性均无显著差异(P>0.05)。在引种资源圃中,休眠期小黄酸野苹果的SOD活性为47.1 U/(g·h),香酸野苹果的SOD活性为44.98 U/(g·h),前者极显著高于后者(P<0.01);在休眠前期与解除休眠期,小黄酸野苹果和香酸野苹果的SOD活性均无显著差异(P>0.05)。比较分析可知,仅有引种资源圃中处于休眠期的小黄酸野苹果和香酸野苹果其SOD活性存在差异,而原生境中不同休眠时期两个品种新疆野苹果的SOD活性均无显著差异。

表6 不同休眠时期小黄酸野苹果和香酸野苹果枝条的超氧化物歧化酶(SOD)活性的差异分析结果Table 6 Analysis results of superoxide dismutase (SOD) activity of branches from Different dormancy periods of Malus sieversii f.luteolus and Malus sieversii f.aromaticus U/(g·h)
2.7 两个种下类型新疆野苹果在不同休眠时期的过氧化物酶(POD)活性的差异分析
不同休眠时期小黄酸野苹果和香酸野苹果1年生枝条的过氧化物酶(POD)活性见表7。由表7可知,在原生境中,休眠前期小黄酸野苹果的POD活性为53.75 U/(g·min),香酸野苹果的POD活性为70.2 U/(g·min),前者极显著低于后者(P<0.01);休眠期小黄酸野苹果和香酸野苹果的POD活性无显著差异(P>0.05);解除休眠期小黄酸野苹果的POD活性为206.19 U/(g·min),香酸野苹果的POD活性为236.37 U/(g·min),前者极显著低于后者(P<0.01)。在引种资源圃中,休眠前期小黄酸野苹果的POD活性为47.53 U/(g·min),香酸野苹果的POD活性为86.27 U/(g·min),前者极显著低于后者(P<0.01);休眠期小黄酸野苹果的POD活性为188.23 U/(g·min),香酸野苹果的POD活性为295.17 U/(g·min),前者极显著低于后者(P<0.01);解除休眠期小黄酸野苹果的POD活性为168.96 U/(g·min),香酸野苹果的POD活性为240.7 U/(g·min),前者极显著低于后者(P<0.01)。比较分析可知,只有在原生境中休眠期的小黄酸野苹果和香酸野苹果其POD活性的差异不显著。

表7 不同休眠时期小黄酸野苹果和香酸野苹果枝条的过氧化物酶(POD)活性的差异分析结果Table 7 Analysis results of POD activity of branches in different dormancy periods of Malus sieversii f.luteolus and Malus sieversii f.aromaticus U/(g·min)
2.8 两个种下类型新疆野苹果在不同休眠时期的抗寒性的综合评价
本研究选取7个能够反映新疆野苹果抗寒性的生理指标,其分别为电导率(X1)、可溶性蛋白含量(X2)、可溶性糖含量(X3)、脯氨酸含量(X4)、丙二醛(MDA)含量(X5)、超氧化物歧化酶(SOD)活性(X6)、过氧化物酶(POD)活性(X7),使用SPSS软件对所测原始数据经标准化处理后的数据进行主成分分析,从中提取出2个主成分,其分别为Y1、Y2,根据2个主成分的系数,得到下列Y1、Y2的线性组合:
Y1=0.43X1-0.43X2-0.32X3+0.46X4-0.21X5+0.51X6+0.04X7;
Y2=0.14X1+0.33X2+0.45X3+0.06X4-0.54X5+0.11X6+0.59X7。
这2个主成分的特征向量见表8,得到的2个主成分能够代表各项生理指标的86.3%的信息。其中,主成分1的特征值为3.399,其贡献率为48.6%;主成分2的特征值为2.641,其贡献率为37.7%。
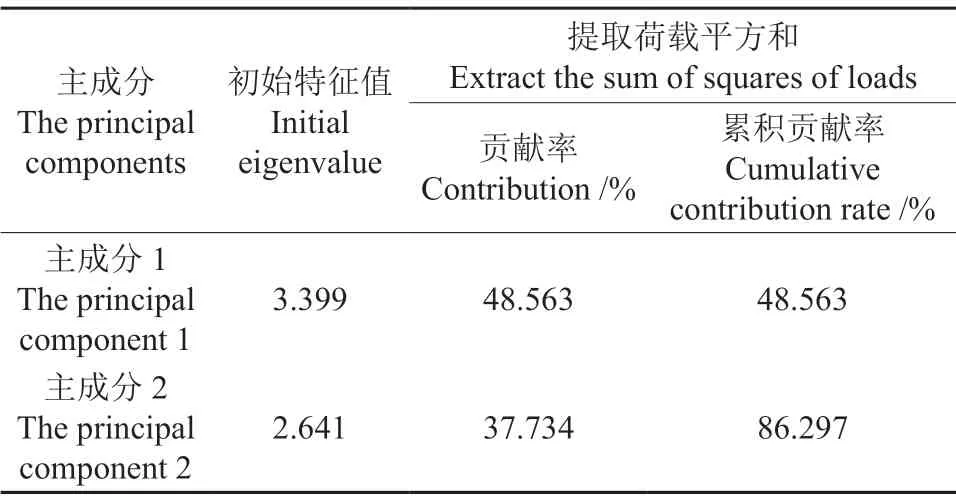
表8 主成分的特征向量Table 8 Eigenvectors of principal components
这2个主成分的载荷矩阵见表9。主成分1主要反映的是超氧化物歧化酶(SOD)活性(X6)、脯氨酸(X4)、相对电导率(X1)的信息,主成分2主要反映的是过氧化物酶(POD)活性(X7)、丙二醛(MDA)含量、可溶性糖含量的信息。
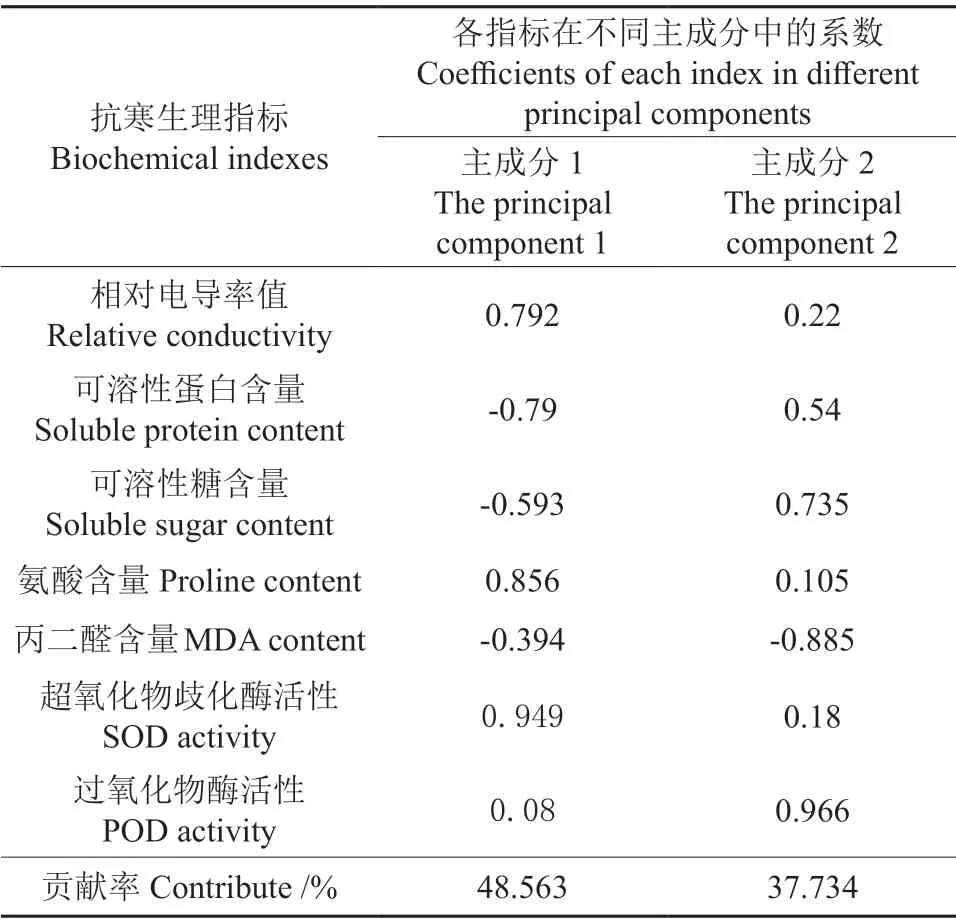
表9 主成分的荷载矩阵Table 9 Load matrix of principal component
3 讨 论
3.1 膜透性与抗寒性的关系
相对电导率是一种较为直观地表示植物在低温下细胞质膜透性变化情况的指标[11]。前人有关苹果[12]抗寒性的研究结果表明,植物在受到低温伤害时,抗寒性强的品种其膜结构稳定,而其相对电导率低。欧欢等[13]的研究结果表明,从11月中旬开始的整个越冬期间,随着温度降低,扁桃电解质渗透率增加,且在1月中旬出现最大值,之后随着温度回暖,其电解质渗透率逐步下降,同时丙二醛含量也呈现先上升后下降的变化趋势。本研究结果表明,在越冬过程中的不同休眠时期,小黄酸野苹果的相对电导率始终低于香酸野苹果的,这与前人的观点基本一致。此外,在自然越冬过程中,小黄酸野苹果的电导率从休眠前期进入休眠期先缓慢下降,而在解除休眠期又上升;其丙二醛含量从休眠前期进入休眠期先快速下降然后维持相对稳定,这与欧欢等[13]的研究结果不一致。这可能与试验材料新疆野苹果与扁桃存在较大差异、供试样品所在地的温度相对更低、采样时间和频次不同等都有一定的关系;其次可能与新疆野苹果长期适应环境形成了独特的抗寒反馈机制,当枝条进入休眠期后能通过自身保护物质分解过量的丙二醛含量以保护膜质的相对稳定有关。对此问题还需在后续的研究中作进一步的探讨。张瑜[14]对菲油果的研究结果表明,质膜透性与菲油果的抗寒性密切相关,这与本研究得出的相对电导率可作为抗寒的主要测定指标的观点相同。
3.2 渗透调节物质与抗寒性的关系
可溶性蛋白、可溶性糖和脯氨酸均为重要的渗透调节物质,对于维持细胞膜结构的完整发挥着重要作用[15-18]。刘大林[19]的研究结果表明,抗寒性强的土种番石榴通过增加可溶性蛋白含量来提高其细胞液的浓度,以维持膜结构的稳定。林玉友[20]的研究结果表明,抗寒性较强的野生种芽中糖含量在整个越冬期间的变化幅度较小。李叶云等[21]有关茶的研究结果表明,越冬前期其可溶性蛋白、可溶性糖含量均呈上升趋势,其最大值都大致出现在12月,进入越冬后期其可溶性蛋白、可溶性糖含量均呈下降趋势。
本研究结果表明,在自然越冬过程中,不同种下类型小黄酸和香酸野苹果的可溶性蛋白、可溶性糖含量的变化趋势与前人的研究结果均一致;此外,在休眠前期进入休眠期的过程中,其脯氨酸含量均呈下降趋势,其最小值均出现在休眠期;进入解除休眠期,其脯氨酸含量均出现急剧升高的趋势。这一结果与前人研究的结果不同,其原因可能是,小黄酸野苹果和香酸野苹果在休眠前期主要依靠快速积累可溶性蛋白和可溶性糖含量以用于增强自身的抗寒能力,此阶段脯氨酸的积累速率比可溶性蛋白和可溶性糖的积累速率要小。解除休眠期游离脯氨酸含量急剧增加,这可能是植物为保护膜结构的稳定性以应对解除休眠期因高浓度的H2O2而形成的特殊抗寒机制。在解除休眠期,小黄酸野苹果可溶性蛋白含量的最小值为1.41 mg/g,显著低于香酸野苹果的最小值1.69 mg/g。这一结果与前人研究的结果不一致,这可能与倒春寒有密切联系,面对解除休眠期突如其来的低温,抗寒性强的小黄酸野苹果分解出更多的可溶性蛋白,以用于提高细胞渗透压,从而更快地应对外界的伤害。引种资源圃中,休眠前期的可溶性糖含量,小黄酸野苹果显著低于香酸野苹果。这一结果与前人研究的结果也不一致,其原因可能是,小黄酸野苹果对逐渐下降的气温的敏感性强于香酸野苹果,其能分解出更多的可溶性糖以满足低温驯化所需能量。
3.3 保护酶活性与抗寒性的关系
SOD、POD作为酶促反应的重要组成成分能够清除植物体内积累的活性氧等有害物质,维持膜结构的稳定性[22]。吴建慧等[23]的研究结果表明,随着胁迫温度的下降,玉米幼苗叶片的POD活性整体呈现出先升高后降低的变化趋势。李叶云等[21]有关茶树和韩浩章等[24]有关香樟的研究结果都表明:自然越冬时期的不同阶段其SOD活性整体均呈休眠期先增加而解除休眠期又降低的变化趋势。司剑华等[25]对柽柳的研究结果表明,品种的抗寒性与SOD的活性呈正相关。
本研究结果表明,随着自然越冬时期的推移,小黄酸野苹果和香酸野苹果在原生境与引种资源圃中其POD活性整体均呈先升高后降低的变化趋势,这与前人研究得出的观点基本一致;其SOD活性整体均呈现出休眠期先降低而解除休眠期又大幅增加的变化趋势,这跟李叶云等[21]有关茶树的研究结果不同。本研究结果与前人研究结果不一致的原因可能是,新疆野苹果经过长期对环境的适应而形成了特殊的越冬机制,解除休眠期其SOD大量增加以有效清除氧化物质H2O2从而保证其安全越冬。此外,在引种资源圃中休眠期苹果枝条中的SOD活性,小黄酸野苹果显著高于香酸野苹果,这一结果与前人研究得出的品种抗寒性与其SOD活性呈正相关的结果相同,此结论只在对引种资源圃内新疆野苹果的研究中得出,而在对原生境新疆野苹果的研究中无法得到验证,对此问题尚需进一步的研究。
新疆野苹果的抗寒性与其独特的地理区域环境密切相关,抗寒性的表现受到基因和环境的共同影响,本研究重点关注了新疆野苹果在生理生化方面的表现,同时试验样品、采样时间采样地点、生理指标的测定方法、试验样品个体间差异等因素对其抗寒生理机制的研究均有影响,为了完善新疆野苹果抗寒性机制的研究,后续研究有待于从分子水平进一步阐明新疆野苹果抗寒性分子机理。
4 结 论
通过主成分分析可知,超氧化物歧化酶(SOD)活性、脯氨酸含量、相对电导率可作为新疆野苹果抗寒性的主要测定指标。由所测数据可初步推断出,脯氨酸、POD、可溶性糖在小黄酸野苹果休眠前期,脯氨酸、SOD、POD、丙二醛在其休眠期,脯氨酸、可溶性蛋白、POD、丙二醛在其解除休眠期的抗寒中均发挥着主要作用。
