外源茉莉酸甲酯处理对梨果实青霉病和贮藏品质的影响
2022-01-14肖刘华赵显阳李树成王印宝陈金印向妙莲
吴 帆,肖刘华,赵显阳,李树成,王印宝,陈金印,2,向妙莲*
(1.江西农业大学 农学院/江西省果蔬采后处理关键技术与质量安全协同创新中心/江西省果蔬保鲜与无损检测重点实验室,江西 南昌 330045;2.萍乡学院,江西 萍乡 337055)
【研究意义】‘翠冠’梨(Pyrus pyrifoliacv.‘Cuiguan’)属于呼吸跃变型果实,由于其采收期为七月中上旬,正值盛夏高温多雨,呼吸代谢旺盛,果实极易发生软化腐烂,品质下降。其中由扩展青霉(Penicillium expansum)引起的青霉病是造成梨果实腐烂的重要致病因子[1]。目前主要通过化学药剂控制该病害[2],但随着消费者对食品安全的日益关注,寻找一种安全绿色的途径控制梨果实采后青霉病,延缓贮藏期间‘翠冠’梨贮藏品质的下降已成为亟待解决的问题。【前人研究进展】茉莉酸甲酯(Methyl jasmonate,MeJA)是一种重要内源物质,广泛分布于植物体中。MeJA 作为信号物质参与植物对外界逆境胁迫的应答反应和信号传递,或对病原菌有直接抑制作用[3],或诱导寄主产生免疫反应[4],减缓病害的发生。前人研究表明,1 μmol/L MeJA 处理显著降低豇豆低温贮藏期间冷害的发生[5],并调控相关因子诱导番茄[6]和采后蓝莓果实抗灰霉病[7]。此外,MeJA 可有效延缓果蔬贮藏期品质的下降,延长货架期。Liu 等[8]发现MeJA 处理樱桃番茄果实可以延缓果实贮藏期间硬度的下降,有效维持果实中类胡萝卜素和番茄红素的积累,同时保持可滴定酸和可溶性固形物含量。采前一个月用0.50 mmol/L MeJA 浸果处理对猕猴桃软腐病防控效果可达77.70%,且可有效改善果实外观品质[9]。【本研究切入点】本项目组前期研究试验表明,0.1 mmol/L MeJA 采后处理可有效降低猕猴桃果实的腐烂率、失重率和丙二醛(MDA)含量,提高可溶性固形物含量,延缓可滴定酸的降解速率[10]。目前关于MeJA 处理对梨果实抗采后青霉病及贮藏品质影响的报道较少。【拟解决的关键问题】本研究以‘翠冠’梨果实为试验材料,通过分析不同的MeJA 处理对梨果实抗青霉病的诱导效应,进一步探索MeJA 处理对梨果实品质的影响,为MeJA 应用于果实贮藏保鲜提供理论参考。
1 材料与方法
1.1 试验材料
试验用果:‘翠冠’梨果实采自江西省峡江县金坪乡果园,于当日采摘运抵实验室,挑选无病虫害、大小统一的果实,放置24 h 充分散去田间热,用0.1%次氯酸钠溶液浸泡果实1~2 min 消毒,自来水冲洗干净,室温晾干后保鲜袋单果套袋,入库备用(冷库温度4~5 ℃)。
供试菌株:扩展青霉(P.expansum),由江西农业大学植物病理实验室提供,-80 ℃保存,试验前培养5~7 d,用无菌水洗脱孢子,经无菌脱脂棉过滤后用血球计数板计数,配置浓度为1.0×106spores/mL 孢子悬浮液,备用。
供试试剂:茉莉酸甲酯(Methyl Jasmonate,MeJA):购自美国Sigma公司,先使用微量0.1%Tween80和少许乙醇混合均匀,后加无菌水配置为浓度1 mmol/L的MeJA溶液,保存于4 ℃冰箱备用。
1.2 试验方法
1.2.1 不同MeJA 处理方法对梨果实抗青霉病的影响 处理1(注入法):取大小、成熟度一致的试验用果,用体积分数75%酒精擦拭梨表面消毒,用无菌接种针在果实表面两侧各刺一个3.0 mm×5.0 mm 的孔,将20 μL 100 μmol/L 的MeJA 溶液注入孔内,对照组CK 用等量含0.1%的Tween80 无菌水代替。将处理好的果实置塑料盒密封后于25 ℃恒温培养箱36 h,在果实孔内注入20 μL 1.0×106spores/mL 青霉孢子悬浮液。每处理10 个果,3 次重复。
处理2(熏蒸法):将待处理果实置于熏蒸盒(体积6 L)内,中央放置灭菌滤纸(直径9.0 cm),将适量MeJA 滴在灭菌滤纸上使盒内MeJA 浓度达到100 μmol/L,迅速密封,对照组用含0.1% Tween80 无菌水。其它处理同处理1。
以上处理后逐日观察梨果实发病情况,采用十字交叉法测量病斑直径,按以下公式计算诱导效果:
诱导效果=(对照病斑直径—处理组病斑直径)/对照病斑直径×100%。
1.2.2 MeJA处理与接种顺序对梨果实抗青霉病的影响 分以下4组处理:处理1,先用100 μmol/L MeJA熏蒸36 h后接种;处理2,用100 μmol/L MeJA 熏蒸同时接种青霉病菌,36 h后停止熏蒸;处理3,梨果实先接种,36 h 后再用100 μmol/L 的MeJA 熏蒸;处理4(对照组CK),接种。接种方法同1.2.1,每组处理10 个果,3次重复。
1.2.3 MeJA 处理对梨果实贮藏品质的影响 将1.1 中梨果实置于熏蒸盒(6 L)中,容器内MeJA 浓度为100 μmol/L,25 ℃熏蒸处理36 h;对照组置于相同环境内不作任何处理,处理结束后果实于超净工作台通风2 h,置冷藏库[湿度90%~95%,温度(3±1)℃]贮藏,每处理3 次重复,每重复50个果实。处理后于第0,7,14,21,35,42,49天测定腐烂率和失重率。并采用混合法取样,果实去皮后沿赤道部周围取果肉,切碎液氮冻样,置-80 ℃超低温冰箱保存,待用。
1.2.4 腐烂率和失重率的测定 腐烂率:以梨果实发生软化、汁液外漏作为腐烂标准。每处理100 个果实,3 次重复。腐烂率=腐烂个数/总数×100%。失重率:随机选取20 个梨果实并编号称量果实质量。失重率=(贮藏前质量-贮藏后质量)/贮藏前质量×100%,每7 d测量一次指标并统计数据。
1.2.5 可溶性固形物含量(TSS)的测定 采用手持数字糖度计(RA250-WE)测定,均匀取果实赤道部果肉研磨出汁,混匀后取3~4滴用于测定,结果以%表示。
1.2.6 可滴定酸(TA)、维生素C(Vc)和总糖含量的测定 可滴定酸含量测定参考曹建康等[11]方法,采用酸碱滴定法,结果以%表示;总糖含量采用蒽酮比色法[11],结果以%表示。维生素C(Vc)含量采用2,6-二氯靛酚滴定法测定[10],结果以mg/100 g表示。
1.2.7 果实硬度和呼吸速率的测定 使用TA.XT Plus 型质构仪(英国SMS 公司)测定果实硬度,每个果实随机均匀取果实赤道部附近去果皮测定5 个点,每组处理测定10 个果实,3 次重复。使用果蔬呼吸测定仪(GHX-3051H)测定梨果实呼吸速率,脱CO2的空气为载气,以标准CO2(1 040 μL/L)校准。
1.2.8 总酚含量和MDA 含量测定 MDA 含量测定参考Wang 等[12]的方法并稍微改动。取1.2.2 冷冻待用梨果肉1 g 与8 mL 100 g/L 三氯乙酸(TCA)混匀在研钵中研磨匀浆,以10 000 r/min 离心25 min。将2 mL 上清液与2 mL 0.67%(w/v)硫代巴比妥酸(TBA)混合均匀后加热煮沸1 h,用自来水冲洗快速冷却,2 500 r/min 离心20 min。重复离心3 次后,分别在波长450,532,600 nm 处测量上清液的OD 值。空白对照使用TBA 溶液。根据以下公式计算MDA 的含量:MDA(mmol/g)=[6.452×(A532-A600)-0.559×A450]×Vt/(Vs×W),Vt:提取物总体积(mL);Vs:用于测量的提取物的体积(mL);W:样品的鲜质量(g);A532,A600和A450分别代表在532,600,450 nm处的吸光度值。
总酚含量根据Folin-Ciocalteu 法测定参考Singleton 等[13]的方法并稍作改进。使用8 mL 甲醇和1 g梨果实混匀放置在研钵中充分研磨成匀浆转移至10 mL 离心管中,于50 ℃超声波萃取30 min,然后4 ℃下离心20 min,上清液即为总酚提取液。将反应混合物(0.5 mL 上清液,0.5 mL Folin-Ciocalteu 和5 mL 蒸馏水)在黑暗中放置10 min,然后在室温下与1 mL 10%Na2CO3混合60 min,测定反应液在波长765 nm 处吸光度值,以没食子酸作标准曲线计算总酚含量,样品的总酚含量换算为每100 g 鲜质量样品没食子酸的含量。
1.3 数据分析
试验数据利用Excel2003 和SPSS16.0 统计分析,使用Duncan’s 新复极差法分析各处理间的差异显著性。
2 结果与分析
2.1 MeJA诱导梨果实抗青霉病的效应
如表1 所示,MeJA 通过注入和熏蒸处理均能诱导梨果实抗釆后青霉病,但二者诱导效果不尽相同。熏蒸法处理诱导效果更好,诱导效果最高达15.60%,注入法诱导效果为12.38%,前者为后者的1.26 倍,且在接种后第120 h和第144 h,熏蒸处理诱导效果显著高于注入处理(P<0.05)。
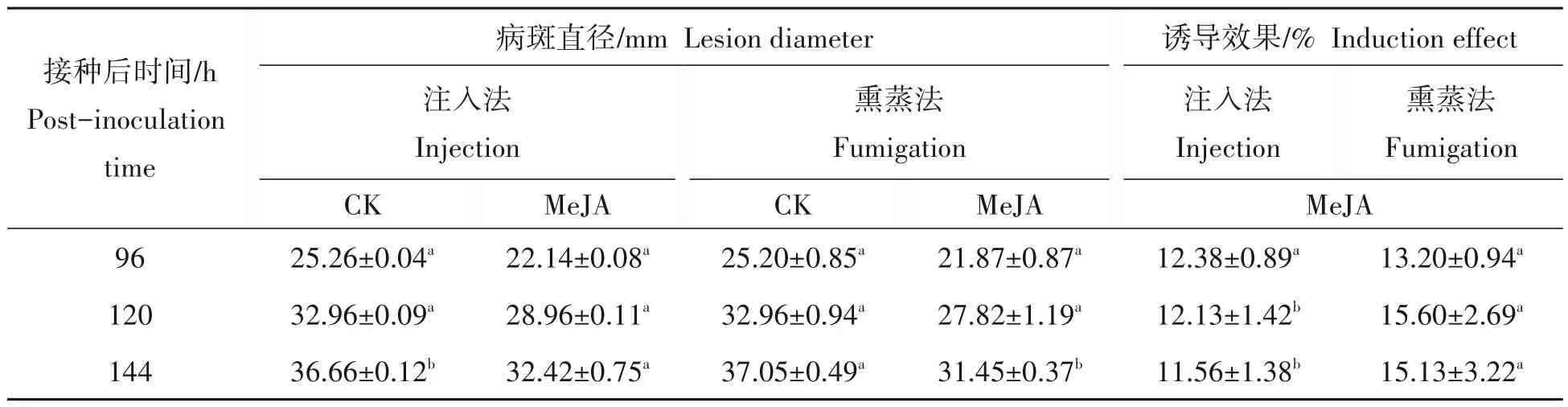
表1 MeJA不同处理方法对诱导梨果实抗青霉病的影响Tab.1 Effects of different treaments of MeJA on induced resistance of pear fruit to blue mold
2.2 MeJA处理与接种顺序对梨果实抗青霉病的影响
不同MeJA 处理均可在一定程度上具有诱导梨果实抗青霉病的作用如表2。处理1(先MeJA 处理后接种)诱导效果最好,为16.14%,处理2(MeJA 与接种同时处理)组次之,诱导效果达14.21%,处理3(先接种后使用MeJA 处理)诱导效果最低为4.87%,处理1 诱导效果为处理3 的3.38 倍,差异达显著水平(P<0.05)。

表2 MeJA处理与接种顺序对梨果实抗青霉病的影响Tab.2 Effects of MeJA and inoculation sequence on induced resistance of pear fruit to blue mold
2.3 MeJA处理对贮藏期梨果实腐烂率和失重率的影响
如图1A所示,低温冷藏期间梨果实腐烂率随贮藏时间延长呈不断增大的趋势,第35天时MeJA处理组果实腐烂率较对照组降低16.52%,差异达显著水平,其它时间点MeJA 处理组与对照组之间果实腐烂率均无显著区别。失重率如图1B 所示,随时间延长呈不断增大趋势,但MeJA 处理对梨果实失重率无显著性影响(P<0.05)。
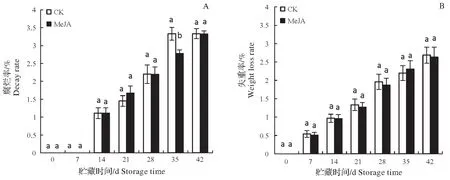
图1 MeJA处理对梨果实低温贮藏期间腐烂率(A)和失重率(B)的影响Fig.1 Effect of MeJA on the decay rate(A)and weight loss rate(B)of pear fruits during cold storage
2.4 MeJA处理对贮藏期梨果实硬度和呼吸强度的影响
由图2A可知,在低温贮藏期间‘翠冠’梨果实硬度随时间延长呈不断下降的趋势,且MeJA处理对‘翠冠’梨果实硬度无显著性影响。MeJA处理对果实呼吸作用的影响如图2 B所示,MeJA处理组和对照组果实呼吸强度随时间的延长均呈先增大后降低的趋势。第14天前,MeJA处理组呼吸强度高于对照组,差异不显著,第14天后,对照组呼吸强度逐渐高于MeJA组,两者在21~35 d差异达显著水平(P<0.05)。

图2 MeJA处理对低温贮藏期间梨果实硬度(A)和呼吸强度(B)的影响Fig.2 Effect of MeJA on the firmness(A)and respiratory intensity(B)of pear fruits during cold storage
2.5 MeJA处理对梨果实TSS和总糖含量的影响
由图3 A可知在低温贮藏期间MeJA 处理组和对照组TSS不断降低,在贮藏21~42 d期间和对照相比MeJA 处理提高了果实TSS 含量,除42 d 外均有显著性差异。总糖含量变化如图3B 所示,在整个贮藏期先上升后下降,与对照相比贮藏14 d内MeJA处理可以显著提高果实总糖含量(P<0.05)。
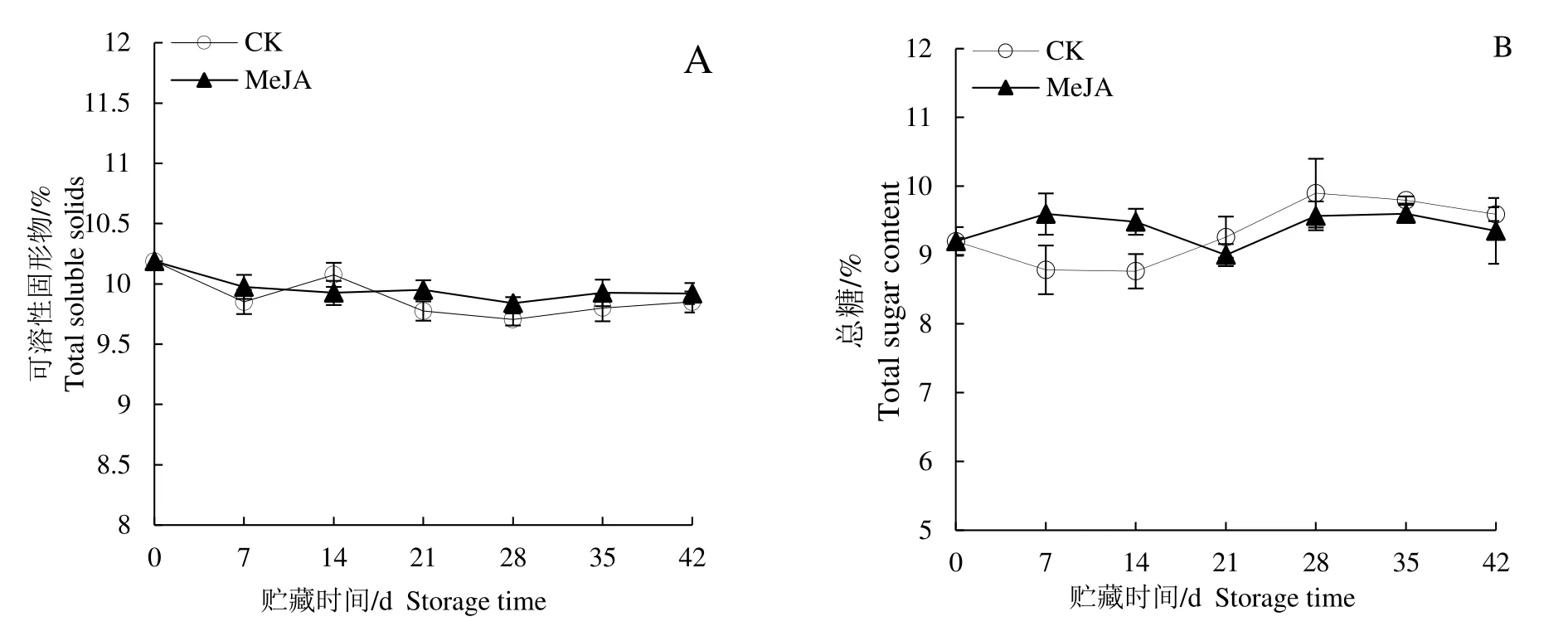
图3 MeJA处理对低温贮藏期间梨果实TSS(A)和总糖含量(B)的影响Fig.3 Effect of MeJA on the TSS(A)and total sugar(B)content of pear fruits during cold storage
2.6 MeJA处理对梨果实TA和Vc含量的影响
在低温贮藏期间MeJA 处理对果实TA 含量的影响如图4A 所示,随时间的延长MeJA 处理组和对照组果实均呈先上升后降低的趋势,且均在贮藏第14 天TA 含量达到最高,分别为0.14%和0.12%。在第14 天和28~42 天MeJA 处理显著提高了果实TA 含量,其中第35 天MeJA 处理组TA 含量为对照组的1.25倍。MeJA 处理对果实Vc 含量影响如图4B 所示,随时间延长MeJA 处理组和对照组果实Vc 含量均呈不断下降的趋势。与对照相比,MeJA 处理组在第7,14,42 天显著提高了果实Vc 含量(P<0.05),分别为4.38、4.21和3.72 mg/100 g,依次为对照组的1.21、1.18和1.19倍。
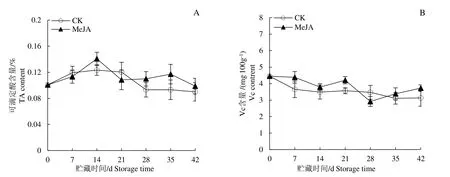
图4 MeJA处理对低温贮藏期间梨果实TA(A)和Vc含量(B)的影响Fig.4 Effect of MeJA on the TA(A)and Vc(B)content of pear fruits during cold storage
2.7 MeJA处理对梨果实MDA和总酚含量的影响
如图5A所示,低温贮藏期间,MeJA处理组和对照组梨果实MDA含量不断增加。和对照组相比,Me-JA 处理在第21天和42天MDA 含量分别降低了22.94%和24.30%,差异达显著水平。由图5B可知,对照组梨果实总酚含量变化较为平稳,呈略微下降的趋势,而MeJA 处理组果实总酚含量则呈现先上升后降低的趋势,在贮藏第28~42 天MeJA 处理可以显著提高果实总酚含量,其中第35 天出现峰值,最高达191.03 mg/100 g,是对照组的1.27倍(P<0.05)。
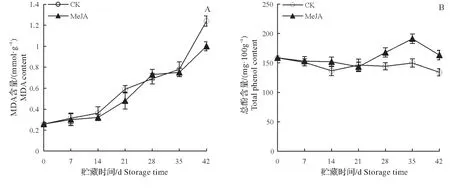
图5 MeJA处理对低温贮藏期间梨果实MDA(A)和总酚含量(B)的影响Fig.5 Effect of MeJA on the MDA(A)and total phenol(B)content of pear fruits during cold storage
3 讨论
MeJA 作为内源信号分子具有提高植物抵御病原菌侵入和抵抗逆境胁迫的能力[3]。本试验结果表明,100 μmol/L MeJA 熏蒸处理和注入处理均能在一定程度上诱导‘翠冠’梨抗青霉病,但是两者作用效果不同,熏蒸法诱导效果更佳。使用MeJA 溶液浸果处理的方法也可以控制香蕉釆后腐烂,提高香蕉对炭疽病抗性[14],于萌萌等[15]通过MeJA真空渗透的方法提高了番茄果实对灰葡萄孢霉(Botrytis cinerea)、扩展青霉(Penicillium expansum)和链格孢霉(Alternaria solani)等病菌的抗性。
果实在釆后贮藏期间由于自身生理代谢的进行,其品质会发生下降,商品价值降低。近年诸多试验表明MeJA 处理可以有效保持贮藏期间果实营养品质,延长果实货架期。如李天等[16]发现使用浓度为1 μmol/L 的MeJA 溶液浸泡处理芹菜可以延缓贮藏期鲜切芹菜的可溶性蛋白、纤维素和叶绿素的降低,保持其较好的生理品质;本项目组在前期试验中发现0.1 mmol/L 的MeJA 熏蒸处理可以显著降低贮藏期间猕猴桃果实腐烂率和失重率,有效延缓果实可滴定酸和可溶性固形物的下降[17-18];另有研究表明MeJA 处理组显著降低豇豆的锈斑指数,呼吸强度,水溶性果胶含量,细胞膜相对渗透率和丙二醛含量,维持较高的原果胶含量[19]。本试验发现梨果实经100 μmol/L MeJA处理可以显著提高低温贮藏期间果实TSS、可溶性固形物、总糖含量及维生素C 含量。这可能与MeJA 有效抑制了梨果实呼吸作用,降低果实代谢活动有关。这一结果与前人在马铃薯[20]、尖椒[21]和石榴[22]中结论类似。
呼吸作用作为釆后果实的主要代谢活动,对调控果实釆后的衰老起至关重要的作用。近年来多项研究指出MeJA 可以调控多种釆后果实的呼吸作用,且受MeJA 浓度和果实种类影响。魏征等[23]研究认为1~100 μmol/L 的MeJA 雾化熏蒸均能有效抑制冬枣果实贮藏期间的呼吸强度,有效延缓其衰老进程,保持冬枣果实品质,上述结论与本试验中MeJA 应用于梨果实结论相同。梨果实含有大量酚类物质如总酚类黄酮等具有清除自由基的作用,起到重要的抗氧化效果[24]。本试验研究表明MeJA处理在低温贮藏期间可以显著提高梨果实总酚含量,使其维持在较高水平,提高了贮藏期间梨果实抗氧化能力。
本试验初步探究了MeJA 处理诱导梨果实抗釆后青霉病的效应及其对梨果实贮藏品质的影响,但如何从能量代谢、转录组学和蛋白组学等角度阐述MeJA 调控梨果实抗病机制及对果实品质和贮藏性能的影响有待后续试验进一步研究。
