Sr2+交换调控ETS-4分子筛选择性吸附CH4中N2性能
2022-01-14陈永灏彭祺龙沈本贤李文龙刘英杰
陈永灏,彭祺龙,姜 豪,孙 辉,沈本贤,张 健,李文龙,刘英杰,郭 龙
(1.华东理工大学 化工学院 石油加工研究所,上海 200237;2.中国石化 西北油田分公司,新疆 乌鲁木齐 830011)
天然气中通常含有一定量的N2,而过高的N2含量会导致产品天然气热值低、液化困难、输送成本升高等一系列问题[1],因此需要对天然气中高含量的N2进行有效脱除。变压吸附(PSA)技术因能耗低、通量高、工艺流程简单等原因应用广泛[2],是极具工业前景的实现天然气中CH4和N2分离的工艺技术。其中,高性能吸附剂是PSA技术的核心,传统吸附材料通常以CH4为强吸附组分,适用于CH4含量较低的井下煤层气等气体混合物中CH4的分离回收,而对于处理CH4含量较高、N2含量较低的天然气时,由于吸附剂容量的限制,导致吸附装置尺寸大、经济效益不佳[3]。因此,开发从CH4中选择性吸附N2的吸附材料是PSA技术实现天然气高效脱氮的关键。
ETS-4(Engelhard titanosilicate-4)是Engelhard开发的一种钛硅分子筛,骨架结构中[010]方向上的八元环是ETS-4分子筛的主孔道,该八元环的尺寸很大程度上决定了分子筛的分离特性[4]。在分子筛活化过程中,伴随着结构水的脱除,八元环上氧原子发生位移,进而实现对孔径尺寸的精确调节,以达到分离尺寸相近分子的目的,即所谓的“分子门”效应[5]。对ETS-4分子筛的合成及改性以达到理想的分离性能是国内外学者关注的热点,Pavel等[6]研究了ETS-4分子筛结晶过程,详细讨论了结晶场、pH值对结晶动力学的影响。Braunbarth等[7]对ETS-4骨架结构的研究发现,由于[100]、[001]方向上存在结构缺陷,导致十二元环被完全堵塞,气体分子只能通过[010]方向上的八元环进入骨架内部。Marathe等[8]发现通过合适的离子交换可以提高ETS-4的热稳定性;Majumdar等[9]研究发现,经Ba2+交换的ETS-4分子筛在400 ℃下热处理后N2/CH4的动力学选择性显著提高。已有的研究均表明,通过离子交换可调变ETS-4分子筛的热稳定性和吸附性能,但离子交换度对其吸附分离N2/CH4性能的影响规律尚不清楚。
为此,笔者通过离子交换的方法制备了一系列不同Sr2+交换度的Sr-ETS-4样品,采用多种表征手段相结合的方法对其进行分析表征;并通过吸附测试与分子模拟相结合的方法,研究不同离子交换度ETS-4样品吸附N2和CH4性能。以期揭示Sr2+交换改性对ETS-4分子筛吸附分离N2/CH4性能的影响及调控规律,为天然气脱氮高性能吸附材料开发及吸附分离工艺设计提供理论基础。
1 实验部分
1.1 原料和试剂
三氯化钛(TiCl3),正硅酸四乙酯(C8H20O4Si),均为分析纯,阿拉丁试剂(上海)有限公司产品;二水合氟化钾(KF·2H2O),分析纯,上海柯灵斯试剂有限公司产品;氢氧化钠,分析纯,上海麦克林生化技术有限公司产品;六水合氯化锶(SrCl2·6H2O),分析纯,上海泰坦科技有限公司产品;工业氮气,体积分数大于99.2%,上海上农气体有限公司产品;氦气、甲烷,体积分数均大于99.99%,上海伟创标准气体有限公司产品;实验用水均为去离子水。
1.2 实验步骤
1.2.1 Na-ETS-4分子筛合成
采用水热法[10]制备ETS-4分子筛材料,将13.1 g氢氧化钠溶于115.5 g去离子水中,缓慢加入28 g正硅酸四乙酯后剧烈搅拌4 h至完全水解,再加入24 g三氯化钛与4.5 g二水合氟化钾搅拌1 h至均匀,将最终的溶液转移至200 mL自压釜中,于180 ℃下晶化12 h。晶化结束后,将产物过滤分离并用2 L去离子水洗涤,再于100 ℃下干燥24 h待用。
1.2.2 ETS-4分子筛的离子交换与热处理改性
(1)离子交换改性:称取15 g前述合成的Na-ETS-4分子筛,分别加入500 mL不同摩尔浓度的SrCl2溶液,于85 ℃下回流搅拌1 h。将产物过滤分离并用2L去离子水洗涤,再于100 ℃下干燥24 h,记作Sr-ETS-4-c(c为所用SrCl2溶液的摩尔浓度,分别为0.02、0.05、0.07、0.10 mol/L)。
(2)热处理改性:取一定条件下Sr2+交换后的样品Sr-ETS-4-c于马弗炉中,以5 ℃/min的速率升温至270 ℃后维持16 h,待样品冷却后密封保存,记作Sr-ETS-4-c-270。
1.2.3 吸附速率与吸附量测定
通过容量法测定ETS-4分子筛的吸附性能,测试温度为288 K,吸附速率测定压力为100 kPa,吸附装置如图1所示。将一定量ETS-4样品置于吸附装置的样品室C2中,关闭阀门V4,打开V5、V6,使用旋叶式真空泵在200 ℃下脱气6 h,通过氦气标定分子筛骨架所占体积后抽去氦气。关闭V5、V6,打开V4,向参比室C1中充入一定压力的待测气体(N2/CH4),并通过计算机记录压力信号,记作p0,关闭V4;打开参比室与样品室间的阀门V5,气体从参比室流入样品室,同时开始每间隔1 s采集一次压力信号,记作pi(i=1,2,…,t-1,其中t为达到吸附平衡的时间,s);至压力信号不再变化,即达到吸附平衡,此时信号值记作pt。重复操作,改变初始压力,得到一定温度条件下的吸附等温线。基于R-K方程(式(1)和装置体积可计算出不同压力信号pi所对应的气体物质的量,Δni=n0-ni(i=1,2,…,t),Δni为在i时刻与平衡时ETS-4材料的N2或CH4吸附物质的量。在进行吸附速率测定时,吸附压力约为100 kPa。将吸附量对时间、压力作图,并通过拟二级动力学模型(式(2))对吸附速率曲线进行拟合,通过L-F模型(式(3))对吸附等温线进行拟合。
(1)
式中:p为气体压力,Pa;R为理想气体常数;T为吸附温度,K;Vm为压力p下的气体摩尔体积,m3/mol;a、b为测试气体所对应的R-K方程常数。
(2)
式中:q为t时刻时的待测气体(N2/CH4)吸附量,mmol/g;qe为待测气体(N2/CH4)的平衡吸附量,mmol/g;k为拟二级动力学模型吸附速率常数,g/(mmol·s);t为达到吸附平衡的时间,s。
(3)
式中:qmax为饱和吸附量,mmol/g;pe为平衡压力,kPa;u为L-F模型吸附平衡常数,1/kPa;r表示吸附剂表面位点的均匀程度。

V1-V6:High pressure solenoid valve;M1:Pressure transmitter;C1:Gas storage chamber;C2:Sample chamber;P1:Rotary vane vacuum pump图1 容量法测定气体吸附速率、吸附容量装置示意图Fig.1 Schematic diagram of the device for determining the adsorption rate and capacity of gases by volumetric method
1.3 表征方法
ETS-4材料的XRD分析在德国Bruker仪器公司生产的D8 Advance X射线衍射仪上进行,使用CuKα(λ=0.15418 nm)作为X射线源,扫描范围2θ=5°~80°,扫描速率10 °/min,步长0.02°。
SEM分析在美国Fei仪器有限公司生产的Nova Nano SEM 450型场发射扫描电镜上进行,波束电流10 nA,加速电压15 kV,在进行分析前先对样品进行喷铂处理。
XRF分析在荷兰帕纳科公司生产的同时式波长色散型X射线荧光光谱仪上进行,无介质矫正、支撑膜矫正。
TGA-DSC分析在德国Netzsch公司生产的STA 449 F3型热重-差热同步热分析仪上进行,空气氛围,测试范围室温至800 ℃。
拉曼光谱分析在法国HORIBA Jobin Yvon公司生产的LabRAM HR型激光共焦拉曼光谱仪上进行,激光波长785 nm,扫描范围4000~100 cm-1,光谱分辨率1.14 cm-1,光栅2400 lines/mm。
1.4 模拟计算
采用Materials Studio 2017模拟平台进行模拟计算,首先依据Nair等[11]所报道的结构参数(如表1所示)分别建立Na-ETS-4和Sr-ETS-4结构模型(如图2所示),按Sr2+与Na+原子个数比分别为4、2.5、1.5、1负载金属离子,分别记作Sr4-ETS-4、Sr2.5-ETS-4、Sr1.5-ETS-4、Sr1-ETS-4,计算时采用2×4×4超晶胞。通过Forcite模块进行能量最小化与几何构型优化计算。能量优化与吸附计算采用Universal力场,静电相互作用采用Ewald法进行计算,范德瓦尔斯力采用Atom based方法,截断长度采用最小晶胞结构参数的一半[12]。同时使用Charges模块通过形式电荷自动计算原子电荷,采用智能算法和超精细精度,在周期性边界条件下进行计算。

表1 ETS-4晶胞结构参数Table 1 Cell parameters of ETS-4 samples
2 结果与讨论
2.1 XRD表征
Na-ETS-4和Sr-ETS-4-0.1的XRD分析结果如图3(a)所示。由图3(a)可知:Na-ETS-4在2θ为7°、13°和30°左右处检测出ETS-4特征衍射峰;Sr-ETS-4-0.10 样品在相同的位置也出现了类似的特征衍射峰。表明,经Sr2+交换改性后,分子筛的骨架结构并没有发生显著改变。
不同离子交换度Sr-ETS-4样品经270 ℃热处理后的XRD表征结果如图3(b)所示。由图3可知:与热处理前的样品相比,热处理后样品的特征衍射峰强度均减弱;且随着Sr2+交换度的增加,相同条件下热处理后样品的特征衍射峰强度逐步增加,结晶度损失逐步降低。这是因为相较于Na+,Sr2+半径更大,与分子筛骨架中水分子的结合作用更强,在热处理后更不易失去结构水。
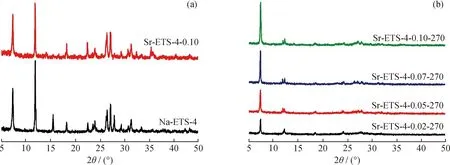
图3 不同ETS-4样品的XRD谱图Fig.3 XRD patterns of different ETS-4 samples(a)Na-ETS-4 and Sr-ETS-4-0.1;(b)Thermally-treated Sr-ETS-4 samples with different exchange degrees
2.2 SEM表征
ETS-4样品的SEM分析结果如图4所示。由图4可知:合成的Na-ETS-4样品呈现片状堆叠的晶体结构,单个晶体尺寸在20 μm左右,与文献中报道的一致[8]。经不同浓度SrCl2溶液改性后的4种样品的微观形貌均没有发生明显的变化。

图4 不同ETS-4样品的SEM照片Fig.4 SEM images of ETS-4 samples(a)Na-ETS-4;(b)Sr-ETS-4-0.10;(c)Sr-ETS-4-0.07;(d)Sr-ETS-4-0.05;(e)Sr-ETS-4-0.02
2.3 XRF表征
不同ETS-4样品的XRF分析结果如表2所示。由表2的元素分析结果可知,随着离子交换所用SrCl2溶液摩尔浓度的上升,离子交换度逐渐增加;且当SrCl2溶液摩尔浓度为0.10 mol/L时,离子交换度达到最大,Sr-ETS-4-0.10分子筛中Sr2+质量分数达到总金属离子(Na+、K+、Sr2+)含量的87%。

表2 不同ETS-4样品的XRF分析结果Table 2 XRF analysis results of different ETS-4 samples w/%
2.4 TGA-DSC表征
ETS-4样品的TGA-DSC表征如图5所示。由图5可知,Na-ETS-4在148 ℃与215 ℃处出现2个吸热峰,Sr-ETS-4-0.10在125 ℃与346 ℃处出现 2个吸热峰,均分别对应游离水与结构水的脱除,相较于Na-ETS-4,Sr-ETS-4-0.10游离水脱除的温度有所下降,但是结构水脱除的温度显著上升。离子交换后Sr-ETS-4-0.10样品的热稳定性优于Na-ETS-4,这是因为ETS-4水合度较高,结构水作为骨架的一部分,除去后导致结构稳定性变差。相较于Na+,Sr2+的离子势较大,与水分子的相互作用更强[5],因此提高了ETS-4样品的热稳定性。

图5 Na-ETS-4、Sr-ETS-4-0.10的TGA-DSC分析结果Fig.5 TGA-DSC analysis results of Na-ETS-4 and Sr-ETS-4-0.10
2.5 Raman表征
ETS-4样品的Raman谱图如图6所示。由图6可知:相较于Na-ETS-4,Sr-ETS-4-0.1在238 cm-1处的Si-O-Ti弯曲峰、440 cm-1处的Si1-O3-Ti1链峰、510 cm-1处的Ti1-O3-Si1-O3-Ti1链峰、758 cm-1处的Ti1-O4-Ti1-O4链峰和905 cm-1处的Si-O伸缩峰[13]均未发生明显改变,进一步表明Sr2+交换对ETS-4骨架结构未产生明显的影响。

图6 Na-ETS-4和Sr-ETS-4-0.10的拉曼谱图Fig.6 Raman spectra of Na-ETS-4 and Sr-ETS-4-0.10
2.6 不同ETS-4样品的N2/CH4吸附速率比较
不同ETS-4材料上N2和CH4的吸附速率测定结果分别如图7(a)和图7(b)所示,采用式(2)拟二级吸附动力学模型拟合,结果如表3和表4所示。由实验测定和拟合结果可知:与Na-ETS-4样品相比,经Sr2+交换与热处理后的Sr-ETS-4样品具有更低的CH4和N2吸附速率和平衡吸附量,这是因为经热处理后,ETS-4会逐渐失去结构水,八元环收缩,从而导致吸附速率与吸附容量的降低。但值得注意的是,经Sr2+交换、热处理改性后,Sr-ETS-4-0.10样品在吸附动力学上呈现出对CH4更显著的抑制作用,其N2/CH4吸附速率常数之比(42.27)远高于未经改性的Na-ETS-4的吸附速率常数之比(6.25)。随着Sr2+交换度的上升,经相同条件热处理后样品对N2的吸附速率显著增加,吸附动力学模型拟合得到的N2吸附速率常数,由Sr-ETS-4-0.02-270样品的0.0623 g/(mmol·s)增加至Sr-ETS-4-0.10-270样品的2.046 g/(mmol·s),提高了约32倍;相比之下,离子交换对CH4的吸附速率无明显影响。且随着Sr2+交换度的增加,热处理后样品N2的平衡吸附量增加,但CH4的平衡吸附量变化不大。表明离子交换和热处理对ETS-4分子筛孔径的精细化调控显著提升了N2/CH4的平衡及动力学选择性,有助于实现天然气中N2的选择性吸附分离。

表3 N2在不同ETS-4样品上的吸附速率曲线拟合结果Table 3 Fitting results of adsorption rate curves of N2 on different ETS-4 samples

表4 CH4在不同ETS-4样品上的吸附速率曲线拟合结果Table 4 Fitting results of adsorption rate curves of CH4 on different ETS-4 samples

图7 N2/CH4在不同ETS-4样品上的吸附速率曲线Fig.7 Adsorption rate curves of N2/CH4 on different ETS-4 samples(a)N2;(b)CH4
2.7 N2和CH4在ETS-4分子筛上的平衡吸附容量比较
不同ETS-4材料上N2和CH4的吸附等温线分别如图8(a)和图8(b)所示,L-F模型拟合的模型参数列于表5和表6。由图8和表5、表6可知:Sr2+交换与热处理后ETS-4分子筛样品的CH4吸附量均显著下降,吸附平衡常数u由Na-ETS-4样品的2.17×10-2kPa-1降至Sr-ETS-4-0.10-270样品的1.53×10-4kPa-1;与CH4吸附相比,经Sr2+交换与热处理改性后的4种样品的N2平衡吸附性能变化较小,吸附平衡常数u由Na-ETS-4样品的4.82×10-3kPa-1降至Sr-ETS-4-0.10-270样品的2.58×10-3kPa-1。随着样品交换度的增加,N2吸附容量逐步提高,在800~900 kPa的N2压力条件下,Sr-ETS-4-0.10-270样品的平衡吸附量最大,为0.43 mmol/g,也高于相近分压条件下CH40.31 mmol/g的平衡吸附量,表明通过Sr2+交换和热处理改性有利于提高ETS-4分子筛的N2/CH4的热力学吸附选择性。

图8 N2/CH4在不同ETS-4材料上的吸附等温线Fig.8 Adsorption isotherms of N2/CH4 on different ETS-4 samples(a)N2;(b)CH4

表5 N2在不同ETS-4样品上的吸附等温线拟合结果Table 5 Results of isotherm fitting for the adsorption of N2 on different ETS-4 samples

表6 CH4在不同ETS-4材料上的吸附等温线拟合结果Table 6 Results of isotherm fitting for the adsorption of CH4 on different ETS-4 samples
2.8 N2在ETS-4分子筛上平衡吸附的分子模拟
采用分子模拟的方法,计算了不同吸附压力下,N2在Na-ETS-4与不同Sr2+交换度的Sr-ETS-4上静态吸附容量并拟合吸附等温线,结果如图9所示。通过Sorption模块计算得到的Sr-ETS-4上N2的吸附密度值如图10所示。由图9可知,仅经过Sr2+交换改性后,Sr-ETS-4较Na-ETS-4分子筛对N2的吸附量上升,在2000 kPa的较高压力下,Sr-ETS-4分子筛N2吸附量较Na-ETS-4分子筛提升了1倍以上。图8(a)中实验测定的改性Sr-ETS-4样品N2的平衡吸附量与Na-ETS-4样品相比差别不大,主要是因为实验测定的改性Sr-ETS-4样品除离子交换外,还经历了热处理改性,而热处理在调控孔径、提高N2/CH4吸附选择性的同时,也降低了各改性分子筛样品对N2和CH4的吸附量。从图10吸附密度值结果可知,ETS-4分子筛骨架上N2的吸附位点均在8元环内,与文献报道相符[7]。此外,模拟计算结果也证实了2.7节中的实验结果,随着Sr2+交换度的升高,Sr-ETS-4样品对N2的吸附量增加。
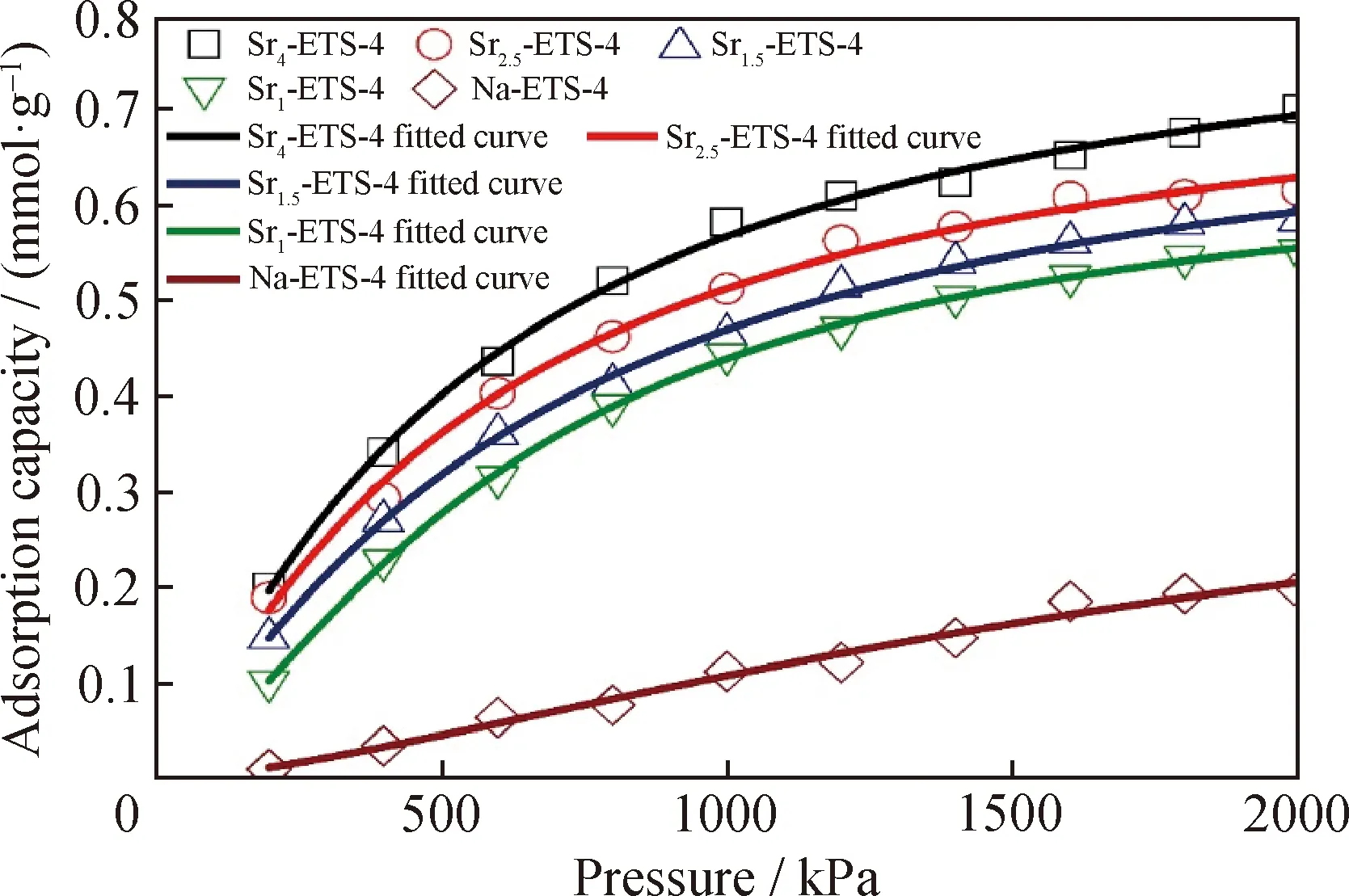
图9 模拟计算的N2在Na-ETS-4和Sr-ETS-4上的吸附等温线Fig.9 Simulated adsorption isotherms of nitrogen on Na-ETS-4 and Sr-ETS-4
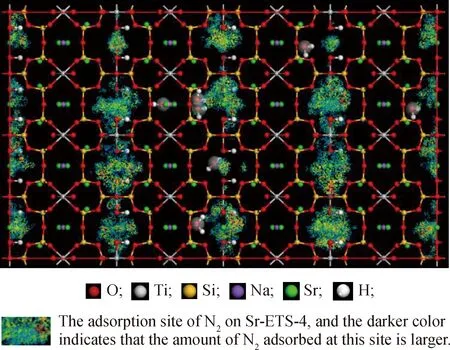
图10 Sr4-ETS-4上的N2吸附密度值Fig.10 Nitrogen adsorption density values on Sr4-ETS-4
混合组分气体(p(Methane)=5000 kPa,p(Nitrogen)=1000 kPa)在不同Sr2+交换度的Sr-ETS-4结构模型上的吸附计算结果如表7所示,其中,混合气体吸附分离因子α由式(4)计算。
(4)
式中:xN2、xCH4为吸附相中组分N2、CH4的摩尔分数,%;yN2、yCH4为气相中组分N2、CH4的摩尔分数,%;qN2、qCH4为吸附剂上组分N2、CH4的吸附量,mmol/g。
由表7可知,随着Sr2+交换度的升高,分离因子α逐渐增大,这与2.7节中测定的结果相符,其中,Sr4-ETS-4样品表现出最大的分离因子α,为1.256。
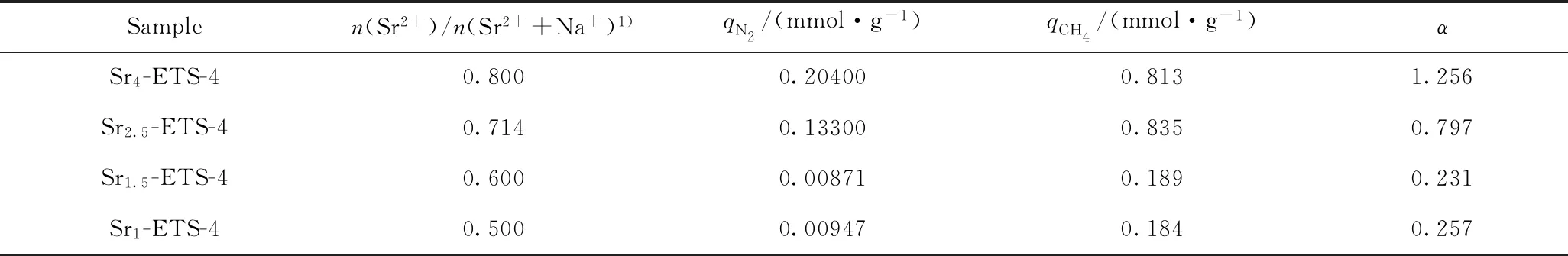
表7 混合气体在不同Sr2+交换度的Sr-ETS-4结构模型上的吸附计算结果Table 7 Simulated adsorption results of mixed components on Sr-ETS-4 s with different ion exchange degrees
3 结 论
(1)采用水热法合成Na-ETS-4分子筛,通过Sr2+交换和热处理获得一系列不同Sr2+交换度的Sr-ETS-4样品,SEM分析显示所合成的5种ETS-4样品均呈现片状堆叠的晶体结构,XRF结果表明Na-ETS-4经SrCl2溶液交换后可获得质量分数达85%以上的高Sr2+交换度;TGA-DSC结果表明,Sr2+的引入可以显著提高ETS-4分子筛的热稳定性。
(2)吸附动力学研究结果表明,与Na-ETS-4样品相比,经热处理后的Sr-ETS-4样品具有更低的CH4和N2吸附速率和平衡吸附量;随着Sr2+交换度的增加,经相同条件热处理后样品吸附N2的速率常数由Sr-ETS-4-0.02-270样品的0.0623 g/(mmol·s)增加至Sr-ETS-4-0.10-270样品的2.046 g/(mmol·s),增加了约32倍;相比之下,吸附CH4的速率常数由Sr-ETS-4-0.02-270样品的0.0724 g/(mmol·s)增加至Sr-ETS-4-0.10-270样品的0.204 g/(mmol·s),仅增加了约2倍。
(3)Sr2+交换与热处理后样品的CH4吸附量显著下降,CH4吸附平衡常数由Na-ETS-4样品的2.17×10-2kPa-1降至Sr-ETS-4-0.10-270样品的1.53×10-4kPa-1;N2吸附平衡常数由Na-ETS-4的4.82×10-3kPa-1降至Sr-ETS-4-0.10-270的2.58×10-3kPa-1。
(4)模拟计算结果表明,Sr2+交换改性可以增加ETS-4分子筛对N2的吸附容量与吸附分离因子,离子交换度对吸附性能的影响规律的模拟计算结果与实验相符。
