GPSM1在结直肠癌中的表达及意义
2022-01-13陈阳冉雯雯王璐宋瑶琳李广起邢晓明
陈阳,冉雯雯,王璐,宋瑶琳,李广起,邢晓明
(青岛大学,山东 青岛 266071 1 基础医学院病理学系;2 附属医院病理科)
结直肠癌(CRC)是胃肠道常见的恶性肿瘤之一,是全球范围内的第四大恶性肿瘤[1]。CRC起病隐匿,侵袭转移能力强,晚期转移是多数病人死亡的主要原因,但其转移的分子机制目前尚不明确[2]。G蛋白信号调节蛋白1(GPSM1)为G蛋白信号激活蛋白家族Ⅱ(AGSⅡ)的成员,是1999年由英国科学家在对酵母进行遗传学筛查时发现的一种蛋白质,该蛋白由N末端的7个四肽重复序列(TPR)和C末端的4个G蛋白调节模体(GPR)组成[3-4]。GPSM1在神经组织、睾丸组织中广泛分布,作为鸟嘌呤核苷酸解离抑制剂参与G蛋白信号通路的调节,以及神经元分化和纺锤体形成等多种生物学进程[3-8]。近年来研究显示,GPSM1在人食管鳞状细胞癌、前列腺癌组织中异常表达并影响肿瘤细胞的增殖、转移及凋亡[9-10]。GPSM1也参与CRC细胞系HT29巨自噬的早期调控[11],但GPSM1在CRC中的表达及作用尚不明确。大鼠肉瘤病毒(RAS)基因突变是癌症最易发生的突变之一,约42%的CRC病人伴RAS基因突变[12]。RAS基因属于原癌基因家族,编码KRAS、NRAS和HRAS,其中KRAS突变率最高(约占85%)[13]。RAS基因突变可使细胞信号传导异常激活,持续传递有丝分裂信号,诱导细胞增殖分化,促进肿瘤发生[14]。美国肿瘤联合会(AJCC)第8版癌症分期系统明确指出,KRAS和NRAS是影响CRC预后的关键因素[15]。本研究旨在通过检测GPSM1在CRC组织中的表达,探讨GPSM1表达与KRAS、NRAS突变及病人临床病理特征的相关性,以期为CRC防治提供新的分子标志物及治疗靶点。
1 资料与方法
1.1 一般资料
收集2015年4月—2016年4月青岛大学附属医院收治的150例CRC病人的石蜡组织样本及临床病理资料,临床病理资料包括病人性别、年龄、肿瘤部位、肿瘤大小、分化程度、TNM分期、浸润深度、淋巴结转移、KRAS和NRAS突变情况等。所有病人均为原发性CRC,术前未行放化疗和靶向治疗。对150例CRC病人定期进行电话和门诊随访,随访截止日期为2020年3月。150例病人均有完整的随访资料,其中52例病人死亡,9例病人发生了术后转移复发。本研究经青岛大学附属医院伦理委员会批准。
1.2 实验方法
1.2.1组织芯片制备 由两名病理医师对所有蜡块进行复片,光学显微镜下选取典型区域并标记,使用Pathology Devices TMAjrTM组织芯片点样仪制作孔径为2.0 mm的组织芯片,4 μm切片。
1.2.2GPSM1免疫组织化学检测 采用PV-6000法进行免疫组织化学染色。组织芯片经脱蜡、水化后,使用体积分数0.03的过氧化氢灭活内源性过氧化物酶10 min,高压修复2 min(枸橼酸盐pH值6.0);滴加GPSM1一抗(1∶200,NBP1-91968,NOVUS,美国),以PBS代替一抗作为阴性对照,4 ℃孵育过夜;滴加通用型二抗(北京中杉金桥生物技术有限公司),37 ℃孵育30 min;DAB显色3 min,使用苏木精复染,脱水、封片。
每张切片由两名资深病理医师随机选择5个高倍视野,判读GPSM1染色结果。GPSM1阳性染色定位于细胞浆。根据染色强度及阳性细胞率进行半定量评分。染色强度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞率评分:≤5%为0分,6%~25%为1分,26%~50%为2分,51~75%为3分,>75%为4分。两项评分相乘,≥4分为高表达,<4分为低表达[16]。
1.2.3KRAS及NRAS基因突变的检测 使用石蜡包埋组织DNA提取试剂盒(TIANGEN公司,DP331-02,中国)提取150例CRC石蜡组织切片中的DNA,然后应用KRAS、NRAS突变检测试剂盒(上海源奇生物制药有限公司)检测其突变情况。使用ABI7500实时荧光定量PCR系统(Thermo Fisher Scientific Inc,美国)进行扩增。KRAS基因突变扩增程序为:42 ℃、5 min;94 ℃、3 min;94 ℃、15 s,60 ℃、60 s;共40个循环;于60 ℃下采集荧光信号。NRAS基因突变扩增程序为:42 ℃、5 min;94 ℃、3 min;94 ℃、45 s,60 ℃、80 s;共40个循环;于60 ℃下采集荧光信号。
1.3 统计学分析
使用SPSS 23.0软件对数据进行统计学处理。GPSM1表达与KRAS、NRAS突变及临床病理特征的关系分析采用Pearsonχ2检验;GPSM1表达与病人术后生存时间的关系分析采用Kaplan-Meier生存分析和Log rank检验,生存曲线的绘制采用GraphPad Prism 7软件。以P<0.05为差异具有统计学意义。
2 结 果
2.1 GPSM1在CRC组织中的表达
免疫组织化学检测结果显示,GPSM1在CRC组织细胞浆中呈高表达,在癌旁组织细胞浆呈低表达或不表达(图1)。在CRC组织中,108例呈高表达,42例呈低表达;在癌旁组织中,21例呈高表达,129例呈低表达。GPSM1在CRC组织与癌旁组织中的表达差异具有统计学意义(χ2=102.938,P<0.001)。
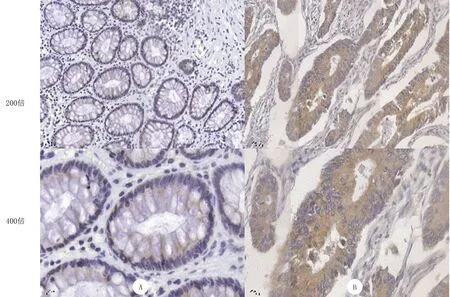
A:GPSM1在癌旁组织中呈阴性表达;B:GPSM1在CRC组织中呈高表达。免疫组织化学染色。
2.2 KRAS及NRAS基因突变情况
实时荧光定量PCR检测结果显示,CRC组织KRAS及NRAS突变率分别为44.00%(66/150)和3.33%(5/150)。
2.3 GPSM1表达水平与CRC病人临床病理特征的关系
GPSM1在CRC组织中的高表达与淋巴结转移(χ2=5.429,P=0.020)以及KRAS突变(χ2=4.030,P=0.045)相关,而与性别、年龄、肿瘤部位、肿瘤大小、分化程度、TNM分期、浸润深度、远处转移、NRAS突变等均无相关性(P>0.05)。见表1。
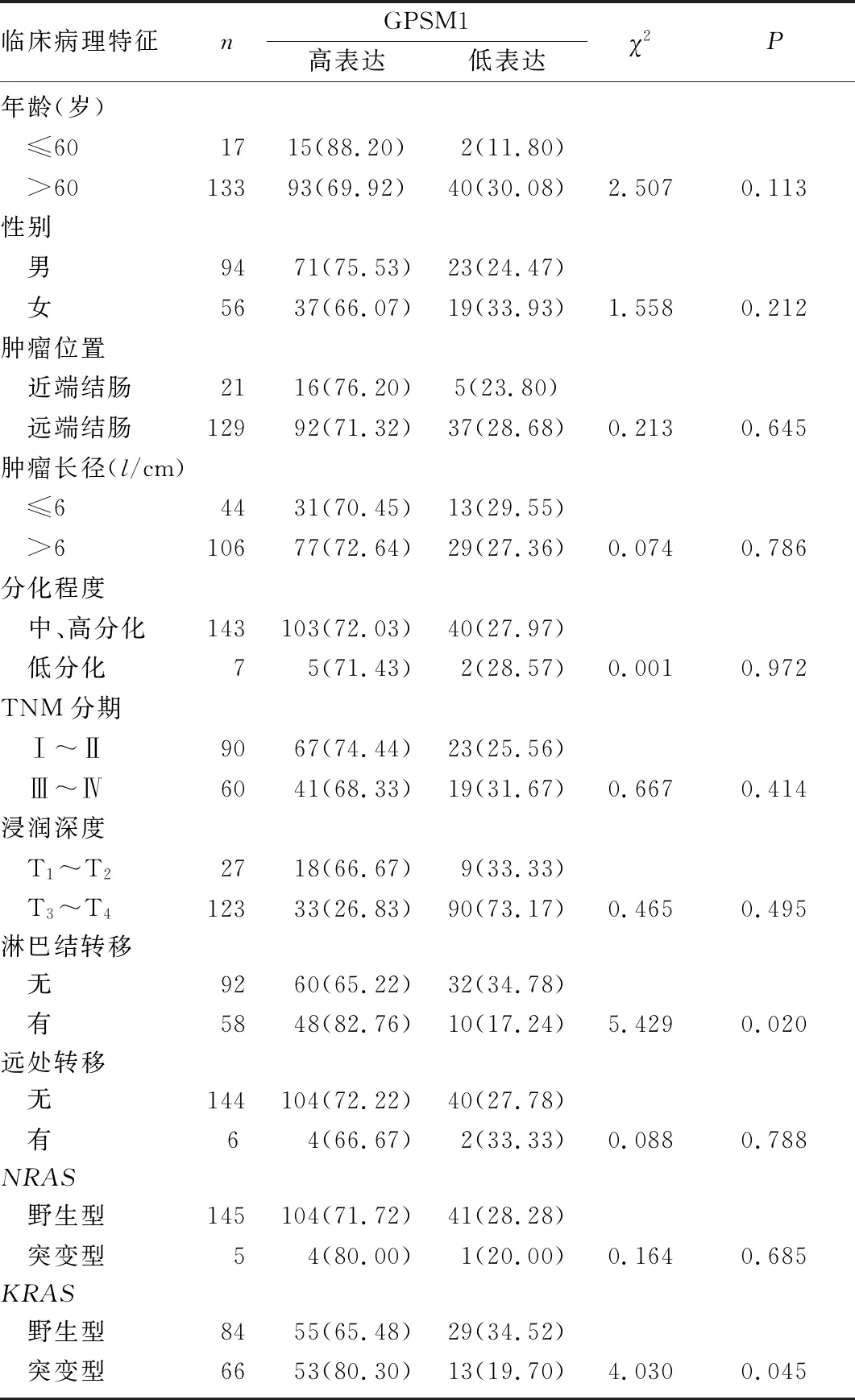
表1 GPSM1表达与CRC病人临床病理特征的关系(例(χ/%)
2.4 GPSM1表达与CRC病人预后的关系
根据GPSM1在CRC组织中的表达水平将CRC病人分为GPSM1高表达和低表达组,Kaplan Meier生存分析显示,GPSM1高表达组(n=108)CRC病人的无病和总体生存期较GPSM1低表达组(n=42)明显缩短(P=0.046、0.036)。见图2。
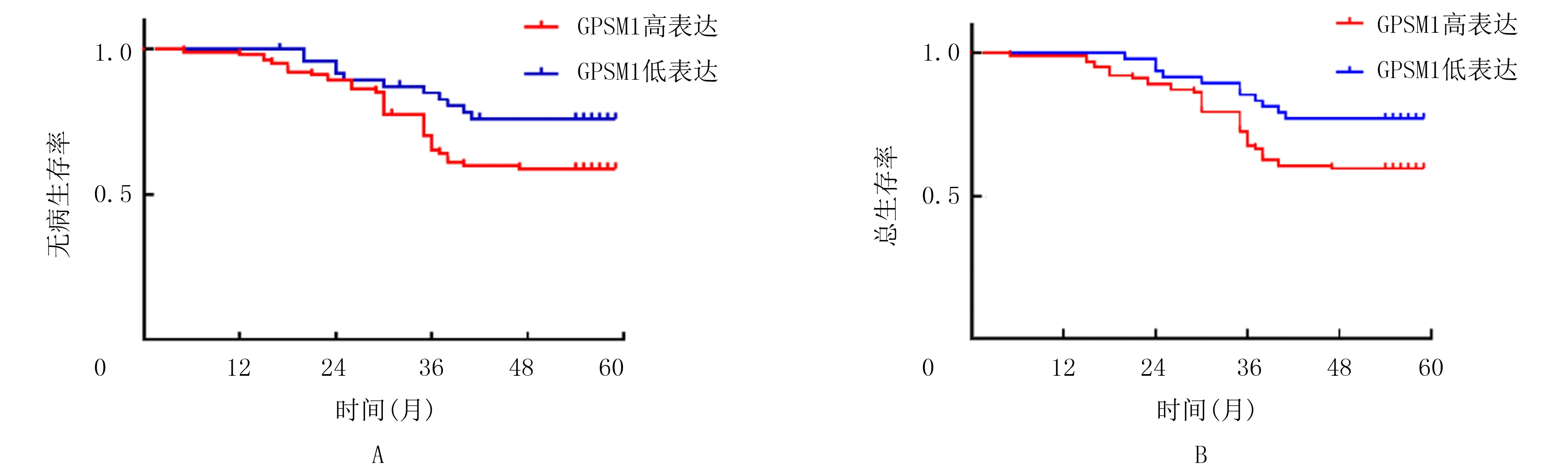
A:不同GPSM1表达水平病人无病生存曲线;B:不同GPSM1表达水平病人总体生存曲线。
3 讨 论
GPSM1是调节G蛋白信号转导系统的重要蛋白之一,生理状态下其主要作用是介导G蛋白信号转导通路的调控,参与神经元分化以及纺锤体形成[3-5]。近年的研究发现,GPSM1在多种肿瘤组织中异常表达,包括人食管鳞状细胞癌、胃癌、前列腺癌等,并且与肿瘤恶性程度及细胞增殖和侵袭性相关[9-10,17]。但GPSM1在CRC组织中的表达及意义尚缺乏相关研究。本研究通过免疫组织化学染色检测显示,GPSM1在CRC组织中的表达水平较其在癌旁组织明显升高,且是CRC病人预后不良的指标,提示GPSM1可能参与了CRC的发生发展。
目前研究表明,GPSM1与多种肿瘤的发生密切相关。SHI等[9]研究显示,食管鳞状细胞癌组织中GPSM1的低表达状态与肿瘤的分级呈正相关,GPSM1高表达的病人生存时间更长,GPSM1是食管鳞状细胞癌病人独立的预后因素;并且过表达GPSM1能够明显抑制食管鳞状细胞癌细胞的增殖。ZHANG等[17]研究证实,GPSM1的DNA甲基化可能参与胃癌的侵袭和转移,并且与癌症病人的预后显著相关。ADEKOYA等[10]的研究结果表明,GPSM1在前列腺癌中表达水平明显增高,前列腺癌细胞中过表达GPSM1可促进体内、体外肿瘤细胞的增殖。本研究对CRC组织中GPSM1表达与病人临床病理特征的相关性进行分析,结果显示,CRC组织高表达GPSM1的病人更容易发生淋巴结转移,而GPSM1表达与病人年龄、性别、肿瘤部位、肿瘤分化程度等均无关。进一步分析GPSM1表达与CRC病人预后关系显示,GPSM1高表达病人预后较差,提示GPSM1可能参与了CRC的侵袭转移,是CRC预后不良的预测指标。
目前,GPSM1在CRC中作用的分子机制及相关信号转导通路尚未阐明。研究表明,Notch信号通路参与了CRC的上皮间质转化过程并调控肿瘤干细胞的形成,可促进CRC转移以及肿瘤形成[18]。Wnt/β-catenin信号通路在肠隐窝底部激活、结直肠稳态维持及肿瘤形成过程中均发挥至关重要的作用[19]。另外,核因子κB(NF-κB)、表皮生长因子受体(EGFR)、RAS等信号通路在调控CRC细胞凋亡、增殖、转移方面均发挥重要作用[20-22]。
KRAS突变是常见的致癌性突变,以12、13位密码子突变最为多见。突变型KRAS能够摆脱上游信号分子EGFR的调控,促进RAS-RAF-MEF-ERK信号通路的激活,增强肿瘤细胞对机体的适应性,促进肿瘤发生发展[23-24]。多项研究结果显示,KRAS突变与CRC转移显著相关,是CRC转移的潜在生物标志物[25-26]。本研究结果显示,CRC组织中GPSM1表达水平与KRAS突变显著相关。表明GPSM1可能与KRAS协同作用,促进CRC的发生与演进,或可作为临床检测CRC转移的补充指标。KRAS突变可影响下游信号通路传导,使肿瘤细胞对西妥昔单抗产生耐药,且KRAS与GPSM1均可调控鸟嘌呤核苷酸的水解与结合,二者在功能上具有相似性[27-29]。这提示GPSM1可能与KRAS一同在西妥昔单抗的耐药机制中发挥作用,或可成为西妥昔单抗耐药的潜在指标。
综上所述,GPSM1在CRC中呈高表达状态,与CRC病人淋巴结转移及KRAS突变存在相关性,并与不良预后相关,可作为CRC诊断、治疗及预后判断的潜在指标。
