不同发酵菌种对白及多糖提取率及发育毒性的影响
2022-01-12邱皓璞李卓航潘洁尘马世宏张锋伦束成杰
邱皓璞,李卓航,潘洁尘,马世宏,张锋伦,傅 雷,束成杰*
(1.南京市产品质量监督检验院,江苏南京210019;2.南京野生植物综合利用研究所,江苏南京211111)
白及[Bletilla striata(Thunb. ex Murray)Rchb.F.,B. striata]为兰科植物白及的干燥块茎,其性微寒,味苦、干涩[1],药用历史悠久,具有收敛止血、清热利湿、消肿生肌的功效[2],主要用于治疗咯血、外伤出血、烧烫伤、口腔溃疡、皮肤皴裂等疾病[3]。白及主要含有联苄类、联菲类及其衍生物、糖苷类、萜类、多糖等化学成分[4-5]。现代药理研究表明,白及多糖可以调节小鼠的免疫功能[6],对于糖尿病溃疡创面能促进愈合[7]。在生物医学材料领域,白及多糖也具有非常大的应用前景。作为一种天然的增稠剂,白及多糖成膜性能较好、易和机体组织混融,机体可缓慢地降解吸收白及多糖,且不具有致热原形和抗原性[8]。白及多糖对皮肤刺激性较小且可以延缓皮肤衰老,因此在日化产品中,白及多糖被广泛使用。如何提高白及多糖的释放一直以来都是研究白及资源的一大重要研究方向。
双向发酵技术指采用具有一定活性成分的植物作为养分机制来代替传统的培养基,并把经过优选的菌种加入其中进行微生物转化,最早出现于在上世纪80 年代,目前已逐步由食品、医药领域延伸到了化妆品领域[9]。研究表明,在发酵过程中,微生物代谢时产生的酶可以改变植物中的组织、成分,也可以富集植物中的一类或几类活性成分[10]。本试验通过双向发酵技术对白及块茎进行发酵,筛选出富集白及多糖效果更佳的工艺,并通过模式动物斑马鱼对白及发酵液在体内的安全性进行探究,为白及发酵产物在未来的原料开发与应用中提供理论依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料
白及由南京野生植物综合利用研究所提供;酿酒酵母菌、植物乳杆菌由扬州罗素生物技术有限公司馈赠;野生型AB系斑马鱼由广东药科大学引入。
1.1.2 试验仪器
KF-1209 电子天平(中国凯丰集团有限公司);FA2004HM 分析天平(万泰仪器有限公司);ControlD-183A 冰箱(荣事达有限公司);DS-1 组织粉碎机(北京华欣科创科技有限公司);T6 紫外可见分光光度计(北京普析通用仪器有限责任公司);涡旋震荡器(上海珂淮仪器有限公司);MQT-60R 摇床(上海旻泉有限公司);LDZX-50K 白及高压蒸汽灭菌锅(上海申安医疗器械厂);SPX-150B-Z 生化培养箱(上海博讯实业有限公司医疗设备厂);JW-25017HR 高速冷冻离心机(安徽嘉文仪器装备有限公司);GJB2000L/h-120Mpa 高压均质机(常州市超力均质泵厂);OlympusBX41 奥林巴斯显微镜(南京艾朗仪器有限公司);PHSJ-4F型PH计(上海仪电科学仪器股份有限公司);wya-2w 阿贝折光仪(上海市光学仪器厂);电热恒温鼓风干燥箱(上海跃进医疗器械厂);NDJ 旋转式粘度计(上海精晖仪器设备有限公司);Z-A-D5 五层单排独立养殖单元(上海海圣生物试验设备有限公司);SZ680 连续变倍体式显微镜(重庆奥特光学仪器有限公司);ZXSD-A1090生化培养箱(上海智城分析仪器制造有限公司);SQP 万分之一天平赛多利斯科学仪器(北京有限公司);FA2004HM 电子天平(常州万泰仪器有限公司)。
1.1.3 试验试剂
硫酸、无水乙醇,南京化学试剂有限公司;氯化镁、盐酸、氯仿、乙醚、苯酚、氯化钠,国药集团化学试剂有限公司;琼脂、蛋白胨、牛肉膏、乳糖、猪胆盐、麦芽汁培养基,日本制药株式会社;葡萄糖标准品,上海源叶生物科技有限公司;乙醚、丙酮,国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 酵母菌发酵方法
白及块茎准确称量后粉碎,过100 目筛,按1:100 的料液比加入去离子水,在121℃,0.1 Mpa 条件下灭菌20 min后,调pH为6.0~6.5。按照1‰投料比例接种菌体浓度达到108CFU/mL 的酿酒酵母菌,搅拌均匀。发酵罐设定温度37℃,发酵时间48 h,发酵完成后在8 000 r/min 条件下离心,取上清液在1 150~1 200 Bar 条件下完成破壁,冷却后通过0.45µm微孔滤膜过滤除渣,得发酵产物。
1.2.2 乳杆菌发酵方法
与1.2.1发酵方法相同,所使用菌种为浓度达到108CFU/mL的植物乳杆菌。
1.2.3 多糖含量测定方法
1.2.3.1 标准曲线 精确称取葡萄糖标准品10.0 mg,转入100 mL 容量瓶中,用适量超蒸馏水溶解并稀释至刻度,充分摇匀,得葡萄糖标准品溶液。依次稀释成浓度为0.01,0.02,0.03,0.04 和0.05 mg/mL 的溶液,分别精密吸取20 µL 标准液依照2.2.1.3 方法测定多糖提取率,得线性关系良好的回归方程。
1.2.3.2 含量测定 本试验采用苯酚-硫酸法[11]测定多糖提取率,加足量纯水充分溶解样品后,取100µL 稀释液加入试管中,再依次加入1 900µL 纯水,1 mL 8%苯酚溶液,5 mL浓硫酸,沸水浴20 min后放入冰水中,在A490nm处测定最大吸光值。
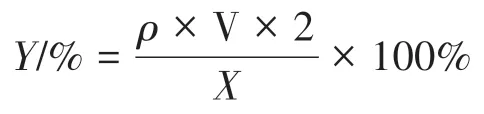
(其中,Y 为多糖提取率,%;ρ 为多糖的浓度,mg/mL;V 为溶解多糖所消耗的纯水的体积,mL;X为提取多糖所用的白及块茎质量,g)。
1.2.4 相关指标测定方法
分别对两种产物的pH 值、折光率、比重、固形物含量、粘度进行测试,然后分别依照《化妆品安全技术规范(2015 版)》[12]和《中国药典(2020 版)》[13]的要求对两种产物的微生物含量与重金属含量进行检测。
1.2.5 发育毒性测定方法
1.2.5.1 试验用鱼及其受精卵的采集 将性成熟斑马鱼雌雄分缸饲养于斑马鱼养殖单元中。水温:26±2℃;pH 7.2;电导率:520 µs/cm;光照/黑暗周期:14 h:10 h。暴露试验开始前一天将雌雄以1:2 配对,自然交配产卵[14]。
1.2.5.2 暴露试验 挑选发育至0~3 hpf(hours postfertilization)的健康斑马鱼鱼胚置于6 孔细胞培养板中,20 尾/孔,每孔加入5 mL 样品溶液。以斑马鱼养殖水为空白对照组。分别于24 hpf、48 hpf 和72 hpf时在体视显微镜下观察并统计鱼胚或幼鱼的孵化、畸形和死亡数量。其中畸形形态包括:头部畸形、心包水肿、卵黄囊水肿、血液堵塞、脊柱弯曲、尾部弯曲、发育迟缓等;死亡状态判断为:卵黄囊凝结、心跳停止[15]。

1.2.6 统计分析
所有数据均为平均值±平均标准误差(S.E.M)。数据分析使用SPSS 19.0软件完成。
2 结果与讨论
2.1 标准曲线
计算得知,两种白及发酵产物的峰面积与其质量浓度呈线性关系,并且经过数据的归纳和分析,得到回归方程为 y=14.179x-0.067 6,R2=0.996 9(y为吸光度,x 为质量浓度,r 为相关因数)。通过该结果,我们可以分析出,当吸光度实际测量值处在0.01~0.79的范围时,其呈现的线性关系良好。
2.2 各项指标检测结果
通过《技术规范》第五章中微生物检验方法对两种样品的菌落总数以及各类菌种进行检测,结果发现:
在菌落总数的微生物含量检验试验中,各个稀释度均无菌生长,故按照规范记为<10 CFU/mL;
在霉菌和酵母菌的微生物含量检验试验中,各个稀释度均无菌生长,故按照规范记为<10 CFU/mL;
在金黄色葡萄球菌的微生物含量检验试验中,平板上无可疑菌落生长,且未检测出革兰氏阳性菌,故按照规范未检出金黄色葡萄球菌;
在铜绿假单胞菌的微生物含量检验试验中,平板上无可疑菌落生长,且未检测出革兰氏阴性杆菌,故按照规范未检出铜绿假单胞菌;
在耐热大肠菌群的微生物含量检验试验中,并未出现产酸产期现象,平板上无可疑菌落生长,且未检测出革兰氏阴性短杆菌,故按照规范未检出耐热大肠菌群。
依据检测结果绘制表1,白及植物乳杆菌发酵液中的多糖含量显著高于白及酿酒酵母发酵液中的多糖含量,表明植物乳杆菌相较于酿酒酵母更易富集白及块茎中的多糖。同时,在颜色和气味上,白及的植物乳杆菌发酵液较白及的酿酒酵母菌发酵液更浅。此外,乳杆菌发酵产物与酵母菌发酵产物中均未检出重金属,不含金黄色葡萄球菌、铜绿假单胞菌和耐热大肠菌群,且菌落总数及霉菌和酵母菌总数均符合《技术规范》的规定。
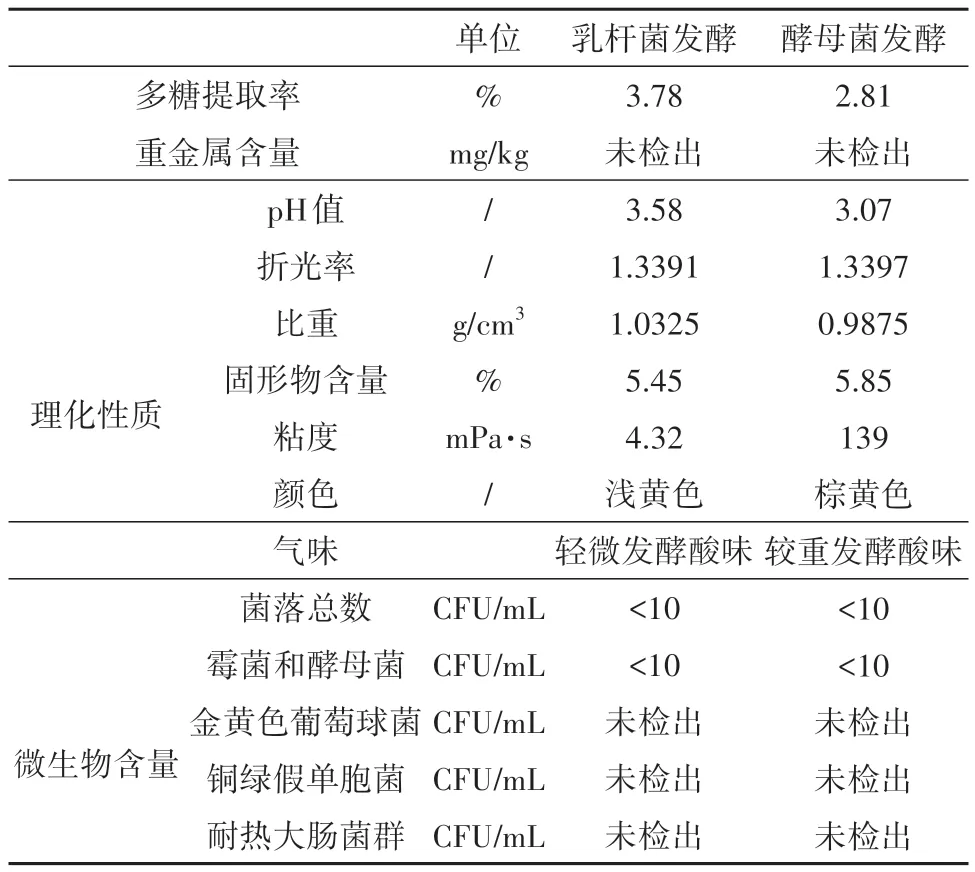
表1 两种发酵液相关指标检测结果Table 1 Two kinds of fermentation broth index detection results
上述试验表明,白及植物乳杆菌发酵液检测结果优于酿酒酵母发酵液,因此选择植物乳杆菌发酵液进行发育毒性测试,该试验选择斑马鱼胚胎进行检测。
2.3 发育毒性结果对比
本试验利用斑马鱼胚胎对白及植物乳杆菌发酵液进行安全性评价,白及植物乳酸发酵液发育毒性试验结果如表2~4 和图1 所示。在试验条件下,空白对照组处理鱼胚72 h 时死亡率、孵化率和畸形率分别为:0.0±0.0、98.3±2.9 和 0.0±0.0。从表 2 可知,在4 mg/mL 样品的试验浓度下,斑马鱼胚胎在24 h、48 h、72 h 的死亡率均为 0,与空白对照组相比无显著差异(P>0.05),而8、16 mg/mL 浓度下,斑马鱼胚在48h 时出现大量死亡,其中16 mg/mL 给药48h 死亡率为100%,相较于空白对照组出现极显著差异(P<0.001),表明低于4 mg/mL 的样品不会引起斑马鱼鱼胚死亡,而浓度高于4 mg/mL 的样品均会导致斑马鱼鱼胚大量死亡。
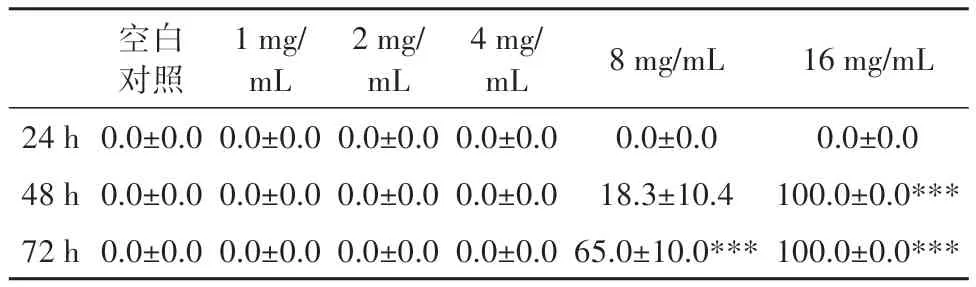
表2 白及发酵产物对鱼胚死亡率的影响Table 2 Effects of B. striata fermentation products on mortality of fish embryos (%)
由表 3 可知,8 mg/mL 和 16 mg/mL 给药时,斑马鱼鱼胚均未孵化,相较于空白对照出现极显著降低(P<0.001)。
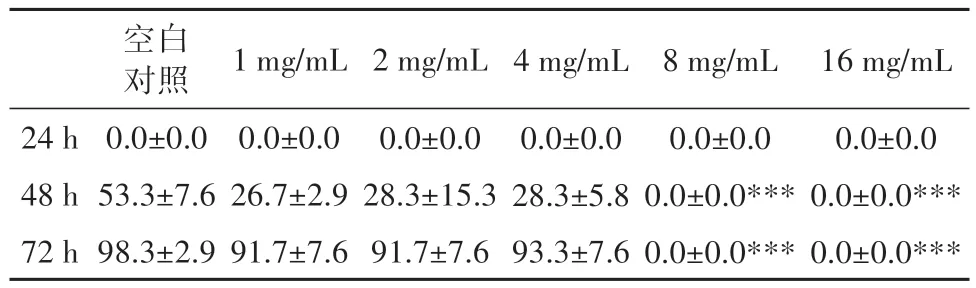
表3 白及发酵产物对鱼胚孵化率的影响Table 3 Effects of B. striata fermentation products on hatchability of fish embryos (%)
白及植物乳杆菌发酵液对鱼胚畸形率的影响见图1和表4。4 mg/mL及以下浓度的样品处理72 h时对鱼胚无显著致畸效应,而8 mg/mL 和16 mg/mL的样品处理组均未孵化。本次试验条件下,白及植物乳杆菌发酵液处理斑马鱼鱼胚后的安全浓度范围为≤4 mg/mL。
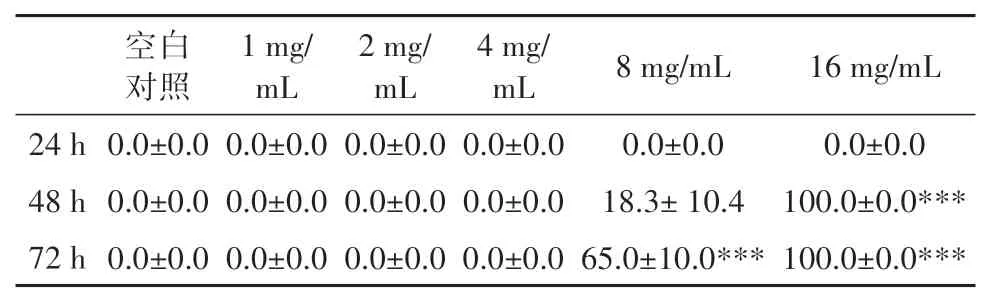
表4 白及发酵产物对鱼胚畸形率的影响Table 4 Effects of B. striata fermentation products on deformity rate of fish embryos (%)

图1 白及发酵产物对鱼胚发育毒性的影响Fig. 1 Effects of B. striata fermentation products on developmental toxicity of fish embryos
3 结论
试验结果表明,植物乳杆菌发酵得到的白及发酵液多糖含量为3.78%,高于酿酒酵母菌发酵所得的发酵液中的多糖含量,且相关指标大多优于酵母菌发酵产物。乳杆菌发酵产物的安全浓度最大为4 mg/mL。本试验利用双向发酵技术对白及块茎进行发酵,对白及发酵产物的多糖含量及各项理化性质等指标进行检测,借助斑马鱼探究白及发酵产物的体内发育毒性,可为白及的发酵产品提供参考,提高植物资源的高值利用。
目前,对发酵过程中微生物与植物或者中药材之间的作用较多地停留在体外功效和活性物质的研究上,随着皮肤微生态研究领域的发展,还需要进一步考虑发酵产物对人体皮肤微生态的影响。
虽然植物发酵技术在应用中也存在着各种问题,但随着相关理论和技术的不断深入和完善,植物生物发酵技术会在化妆品中有更光明的应用前景。生物双向发酵技术把我国传统的中医药优势与现代发酵技术相结合,将为我们进行独具中国特色的民族化妆品的开发提供一个新的思路。
