Cd胁迫下木槿两年生苗的生理及富集特征
2022-01-12曹琼月孙佳柠尹雨桐黄静雯周蓓蓓周晓丽
曹琼月,孙佳柠,尹雨桐,黄静雯,周蓓蓓,周晓丽
(盐城师范学院海洋与生物工程学院,江苏盐城224007)
近几十年来,工业化快速发展,随之而来的重金属污染也成为了全球性的环境污染问题。据2014 年《全国土壤污染状况调查公报》显示[1],全国土壤总超标率为16.1%,无机污染物超标点位数占全部超标点位的82.8%,其中重金属镉(Cd)超标点位数高达7%,居无机污染物点位超标第一位。据估算,我国受Cd 等重金属污染的耕地面积达2000 万公顷,受到重金属污染的粮食年均1200 万吨[2]。重金属污染土壤修复的技术有很多,例如隔离/密封技术、土壤清洗/冲洗技术、电动力学修复等,但是这些以工程为基础的技术大部分不适合大面积污染土壤的修复[3]。而污染土壤的植物修复技术因其成本低、高效、环境友好以及可就地适用的特点,正成为全世界研究和开发的热点[4]。目前在植物修复方面研究较多的是超积累植物,它们可以在污染土壤上正常生长,从土壤中提取重金属并将其累积在植物可收割部分[5-6]。然而,许多超积累植物主根系不发达、生长缓慢、生物量低、景观价值不高,限制了其在土壤重金属污染修复实践中的应用[7],因此选择合适的植物是高效利用植物修复技术的关键。
近年来研究显示,锦葵科(Malvaceae)木槿属(Hibiscus)多种植物对干旱、瘠薄、盐碱等不良土壤条件表现出较好的适应性,是一类极具开发潜力、抗逆性强的植物类群。木槿(Hibiscus syriacus)因其较高的园艺观赏、药用和食用价值在热带和亚热带地区应用颇为广泛。以往研究发现,木槿能在一定程度上抵御盐碱、铝的胁迫,而且不同品种对干旱、低温等恶劣环境的耐受性有差异[8]。王小雪、邓勇先后对木槿同属植物海滨木槿(Hibiscus hamabo)、红麻(Hibiscus cannabinus)进行Cd 胁迫研究,发现它们具有较强的耐Cd能力[9-10]。植物受到重金属胁迫时,植物细胞会产生大量的活性氧自由基,过量的活性氧能导致膜脂过氧化、蛋白质和DNA 分子的氧化损伤[11]。此时,植物细胞会启动清除活性氧的保卫系统,包括各种酶类抗氧化剂和非酶类抗氧化剂,从而提高植物的耐受能力[12]。但是,目前尚未有木槿(H. syriacus)耐Cd 能力的相关研究和报道。为此,本研究以木槿为试验材料,研究不同浓度Cd胁迫对木槿叶片的质膜完整性、抗氧化酶活性的影响,探究木槿对Cd 的吸收特性,评估木槿对Cd 的富集能力,以期为木槿应用于Cd污染土壤修复提供理论依据。
1 材料与方法
1.1 供试材料
木槿(Hibiscus syriacus),为锦葵科木槿属落叶灌木,是庭园中常见的灌木花种。试验材料为长势相同的两年生木槿,苗木由江苏宿迁绿杨园艺公司提供。2020 年8 月将植株移栽至塑料花盆中(盆高22 cm,上、下直径分别为23 cm和18 cm),每盆1株,盆底放置浅壁托盘。栽培基质由黄土、泥炭土和珍珠岩按体积比5 :3 :1 混合而成,每盆装基质5 kg(DW),苗木恢复正常生长以后开始Cd 胁迫处理。整个试验在江苏省盐城师范学院新长校区实验室内进行。
1.2 试验设计与处理
参考前人的研究和《土壤环境质量标准》(GB15618-1995),将 Cd 浓度设置为 0、1.0、2.5 和5.0 mg/kg(以每千克干重土壤含量计),以CdCl2·2.5H2O 配置不同浓度的盐溶液。采用浇灌法,逐次加入盐溶液以平衡蒸发的水分,具体处理过程如下:1.0 mg/kg 处理组仅加 Cd 溶液 1 次、2.5 mg/kg 处理组分 2 次加入 Cd 溶液、5.0 mg/kg 处理组分 3 次加入Cd 溶液,使各处理组土壤中Cd 的最终质量浓度分别达到1.0、2.5、5.0 mg/kg,对照处理以蒸馏水代替。每次间隔2 d加入Cd 溶液,并尽可能保证Cd 与土壤混合均匀。单盆为一个处理,每个处理3 个重复,共12盆植株,胁迫时间为45 d(从第一次加入Cd溶液计算)。试验期间定期浇水,浇水后将托盘中渗出的溶液重新倒入盆中,以保持各处理Cd 含量,避免水分及Cd的流失。
1.3 植物样品的采集及测定方法
1.3.1 丙二醛含量及抗氧化酶活性的测定
胁迫处理45 d 后,收集新鲜的木槿叶片样品,用超纯水反复冲洗叶片表面,擦干,准确称取0.3 g新鲜叶片,测定丙二醛(Malondialdehyde,MDA)含量及抗氧化酶活性。MDA 含量用硫代巴比妥酸(Trichloroacetic acid-thiobarbituric acid,TCA-TBA)显色法测定,用氮蓝四唑(Nitro-blue tetrazolium,NBT)光还原法测定超氧化物歧化酶(Superoxide dismutase,SOD)活性,使用愈创木酚法测定过氧化物酶(Peroxidase,POD)活性,使用过氧化氢法测定过氧化氢酶(Catalase,CAT)活性,使用抗坏血酸法测定抗坏血酸过氧化物酶(Ascorbateperoxidase,APX)活性。
1.3.2 Cd含量的测定
将木槿根部用乙二胺四乙酸二钠(Ethylene diamine tetraacetic acid disodium salt,EDTA-Na2)溶液浸泡30 min,以去除根表吸附的重金属离子Cd,再用超纯水反复清洗3 ~5 遍。用剪刀将植株根、茎、叶剪成1 cm 小段,恒温干燥箱40℃烘干至恒重,用液氮研磨成粉末,再次烘干至恒重,过200 目筛,装入信封保存备用。
称取 0.50(±0.0005)g 植物样品,转移至 50 mL的三角烧瓶中,加入8 mL 高氯酸(HClO4)和2 mL 硝酸(HNO3)进行“湿法灰化”,时间持续48 h,用电热板加热消煮至溶液澄清,冷却后加入2 mL 稀硝酸(HNO3:H2O =1:1),再次加热消煮至白色烟雾消失,冷却后用蒸馏水润洗至25 mL 容量瓶中定容[13]。每个样品均做3 个重复处理,并采用国家标准物质茶叶(GSB-7)、柑橘叶(GSB-11)进行质量监控。样品消煮均设置相应硝化的混合酸作为空白对照,以达到消除硝化和测定过程中可能产生的误差。处理好的样品用电感耦合等离子体质谱(Inductively coupled plasma mass spectrometry,ICP-MS)测定其中的Cd含量。
1.3.3 计算方法
重金属 Cd 富集系数(Bioconcentration factors,BCF)= 根部或地上部 Cd 含量/土壤中 Cd 含量。转运系数(Translocation factor,TF)= 植物地上部分Cd含量/地下部分Cd含量。
1.4 数据处理
采用 Microsoft Office Excel 2010 和 SPSS 19.0对数据进行统计分析,采用新复极差法(Duncan)检验各数据组间的差异显著性,P<0.05 为差异显著。实验数据用平均值±标准差表示。
2 结果与分析
2.1 不同浓度Cd 胁迫下木槿叶片MDA 含量的变化
图1 为不同浓度Cd 胁迫下木槿叶片MDA 含量的变化。与对照相比,Cd胁迫处理增加了木槿叶片内MDA的含量,随着Cd处理浓度的增加,MDA含量表现出先上升后下降的趋势。在1.0 和2.5 mg/kg Cd 胁迫下,木槿叶片MDA 含量显著高于对照,分别提高了38%和58%。在5.0 mg/kg Cd 胁迫下,木槿叶片MDA 含量与对照相比提高了3.3%,无显著差异。

图1 Cd胁迫对木槿叶片MDA含量的影响Fig.1 Effects of Cd stress on H. syriacus leaf MDA content
2.2 不同浓度Cd胁迫下木槿叶片抗氧化酶活性的变化
图2 为不同浓度Cd 胁迫对木槿叶片SOD 活性的影响。随着Cd处理浓度的增加,木槿叶片SOD酶活性呈现先上升后下降的趋势。与对照相比,1.0和2.5 mg/kg Cd 胁迫处理显著增加了木槿叶片SOD酶活性,分别提高了29.4%和9.9%。而5.0 mg/kg Cd胁迫处理下,木槿叶片SOD 酶活性显著低于对照,降低了30.2%。

图2 Cd胁迫对木槿叶片SOD活性的影响Fig.2 Effects of Cd stress on H. syriacus leaf SOD activity
图3为不同浓度Cd胁迫对木槿叶片POD活性的影响。与对照相比,Cd胁迫处理增加了木槿叶片内POD 的活性,随着 Cd 处理浓度的增加,POD 活性呈现先上升后下降的趋势。在1.0和2.5 mg/kg Cd胁迫下,木槿叶片POD 活性显著高于对照,分别提高了128%和75%。在5.0 mg/kg Cd 胁迫下,木槿叶片POD活性与对照相比提高了0.18%,无显著差异。

图3 Cd胁迫对木槿叶片POD活性的影响Fig.3 Effects of Cd stress on H. syriacus leaf POD activity
图4 为不同浓度Cd 胁迫对木槿叶片CAT 活性的影响。随着Cd处理浓度的升高,木槿叶片CAT活性逐渐降低。在1.0 mg/kg Cd胁迫下,木槿叶片CAT活性与对照相比提高了3.75%,无显著差异。在2.5和5.0 mg/kg Cd 胁迫下,木槿叶片CAT 活性显著低于对照,分别下降了22.4%和81.6%。
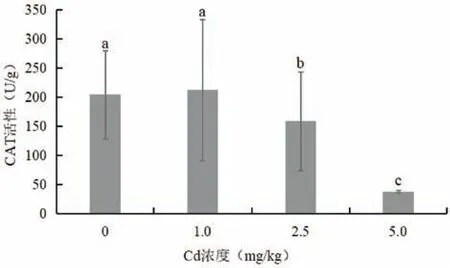
图4 Cd胁迫对木槿叶片CAT活性的影响Fig.4 Effects of Cd stress on H. syriacus leaf CAT activity
图5 为不同浓度Cd 胁迫对木槿叶片APX 活性的影响。随着Cd 处理浓度的升高,木槿叶片APX活性呈现出先升高后降低的趋势。在1.0 和2.5 mg/kg Cd 胁迫下,木槿叶片CAT 活性显著高于对照,分别提高了46%和367%。在5.0 mg/kg Cd 胁迫下,木槿叶片APX 活性显著低于对照,下降了37%。该研究结果表明,在较低Cd 浓度胁迫下,木槿叶片APX活性增加,说明其增强了清除氧自由基的能力,但其活性在较高Cd浓度胁迫下开始下降,指示其抗性保护能力是有一定限度的。
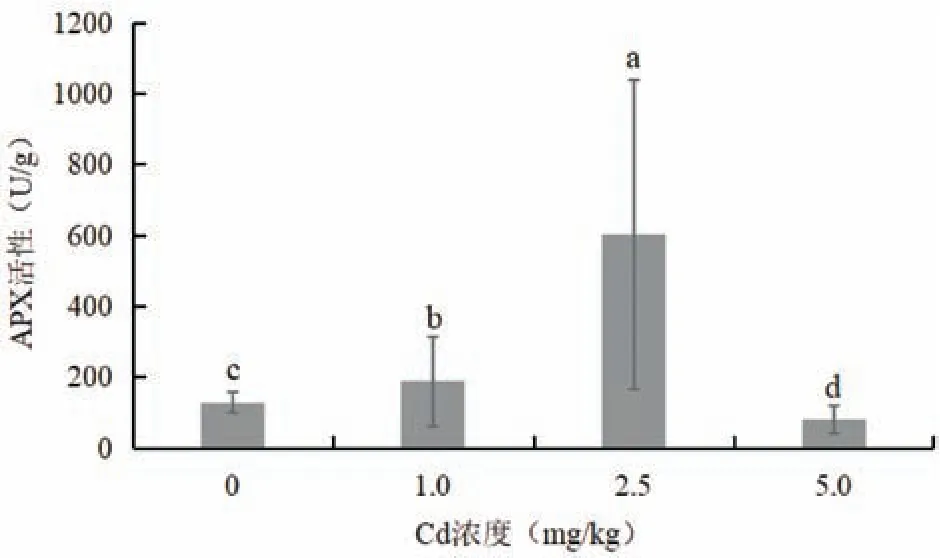
图5 Cd胁迫对木槿叶片APX活性的影响Fig.5 Effects of Cd stress on H. syriacus leaf APX activity
2.3 主成分分析
将不同浓度Cd 胁迫下测得的木槿叶片5 个生理指标进行主成分分析,提取出特征值大于1的2个主成分和生理指标主成分特征向量(表1)。从表1 可知,前2 个主成分的累计贡献率达到91.276%,基本能反应原5个指标的绝大部分信息。第一主成分特征值3.416,贡献率达到68.313%,SOD、POD、MDA这3个特征向量的值较大,均与耐Cd胁迫呈正相关。第二主成分特征值1.148,贡献率达到22.962%,CAT、APX 这2 个特征向量的值较大,其中CAT 与耐 Cd 胁迫呈负相关,APX 与耐 Cd 胁迫呈正相关。归纳可知,细胞的保护酶对木槿的耐Cd胁迫发挥着重要作用。

表1 主成分规格化特征向量、特征值和贡献率Table 1 The principal component normalized eigenvectors,eigenvalues and variance contribution
2.4 不同浓度Cd胁迫下木槿对Cd的累积特征
2.4.1 不同浓度Cd胁迫下木槿各部位的Cd含量
图6 为不同浓度Cd 胁迫下木槿各部位的Cd 含量。通过对木槿不同部位Cd 含量的测定,不难发现,木槿根部Cd 积累量随着Cd 处理浓度的增大而显著增加,与对照相比,根部Cd 含量分别提高了271%、436%和655%,即木槿根部对Cd 的富集能力呈显著增加趋势。对木槿茎部而言,不同浓度Cd处理显著增加了茎部Cd 含量,与对照相比,分别提高了64%、59%和33%。在1.0和2.5 mg/kg Cd胁迫下,木槿茎部对Cd 的富集能力相似,无显著差异,而在5.0 mg/kg Cd 胁迫下,木槿茎部对Cd 的富集能力显著低于前两种情况。在1.0 和2.5 mg/kg Cd 胁迫下,木槿叶部对Cd 的积累量显著高于对照,分别提高57%和300%,但在5.0 mg/kg Cd胁迫下,木槿叶部对Cd 的积累量显著低于对照,下降了70%。总体来看,木槿不同部位对Cd 的累积量表现为根>叶>茎,说明地下部分比地上部分具有更强的Cd 富集能力。
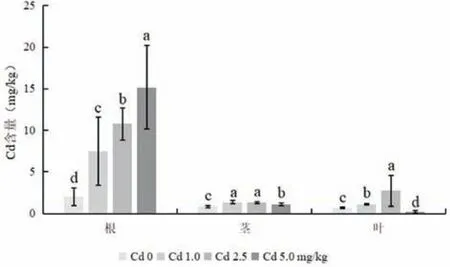
图6 不同浓度Cd胁迫下木槿各营养器官Cd的含量Fig.6 The Cd concentrations in different organs of H. syriacus under Cd stress
2.4.2 不同浓度Cd 胁迫下木槿各部位对Cd 的富集系数与转运系数
植物从土壤中提取重金属的能力可用富集系数表示,而重金属在植物体内的迁移与累积情况可用转移系数表示,转移系数越大,说明重金属在植物地上部分的累积越多。
由表2 可知,不同浓度Cd 胁迫下,木槿根对Cd的富集系数为10.65 ~17.30,均大于1,在1.0 mg/kg Cd胁迫下,木槿根对Cd的富集能力最强,而Cd胁迫浓度为2.5 mg/kg 时,木槿根对Cd 的富集能力最弱。除了Cd 胁迫浓度为5.0 mg/kg 时,木槿叶片对Cd 的富集系数小于1,其余Cd 胁迫条件下,木槿茎、叶对Cd 的富集系数均大于1,只是茎、叶对Cd 的富集系数要远远小于根对Cd的富集系数。

表2 木槿对Cd的富集和转运系数Table 2 Enrichment and transport coefficient of Cd in H. syriacus
从转运系数看,不同浓度Cd胁迫条件下木槿对Cd的转运系数均小于1,说明木槿由根向茎、叶转运Cd 的能力较弱,木槿将大部分Cd 积累在根部,限制Cd向上转移。
3 讨论
生物体内自由基作用于脂质发生过氧化反应的最终产物是MDA,它的含量是衡量植物逆境生长的重要指标,可以反映植物遭受逆境伤害的程度[14]。张凤琴等[15]指出重金属会诱变脂质过氧化,重金属浓度越高,植物体内脂质过氧化产物MDA积累越多。在本试验中,被胁迫的木槿叶片MDA含量明显上升,说明木槿叶片在重金属胁迫下受到明显的氧化伤害。随着Cd胁迫浓度的增加,不断积累的活性氧使植物受到的氧化损伤程度增大,其细胞膜组成发生变化,结构遭到破坏。但是,在最大浓度Cd(5.0 mg/kg)胁迫下,木槿叶片MDA 含量与对照相比无显著差异,可能与MDA 在叶片内的累积有关系。
在重金属胁迫下,细胞膜受到损伤时,植物自身具有的抗氧化酶系统能够维持自由基在植物体内产生和清除的动态平衡。一般认为,植物耐受重金属胁迫的物质基础之一是SOD、POD、CAT、APX等活性的维持和提高。SOD是防护氧自由基对细胞膜伤害的一种重要保护酶,主要功能是清除活性氧,作为植物抗氧化保护系统的第一道防线,适度提高其活性可以增强植物的抗逆能力[16]。POD 是植物体内的另一种保护酶,主要作用是清除线粒体或细胞质中产生的低浓度H2O2,从而提高植物的抗逆能力[16]。植物遭遇逆境条件后能否正常生长与酶促防御系统有关,其中CAT 是关键酶之一,它与SOD 和POD 协同作用,清除植物体内过剩的自由基,提高抗逆能力[16]。细胞内自由基的组成和水平直接受到胞内抗氧化酶的活性水平及相对大小的影响,只有各种酶协同配合才能有效清除细胞内的活性氧,使细胞免于氧化损伤[17]。本研究中,在1.0和 2.5 mg/kg Cd 处理下,木槿叶片 SOD、POD 活性均显著高于对照,表明Cd 胁迫下激发了木槿叶片SOD、POD 活性,能够有效清除多余的O2•-和 H2O2。但是,随着Cd 处理浓度的进一步增大,木槿叶片SOD、POD 活性显著低于或与对照无显著差异。相似地,罗洁文[18]等的研究同样发现,Cd胁迫下,类芦(Neyraudia reynaudiana)POD 活性随 Cd 浓度增加而降低。木槿叶片APX 活性表现出与SOD 和POD 相同的变化,都呈现出先升高后降低的趋势。所以,可以认为,植物抗氧化物酶活性的增加是植物的一种保护机制,但是高浓度的Cd胁迫能导致植物抗氧化酶系统遭到破坏,酶活性降低,影响植物正常生长。本研究中,随着Cd 处理浓度的增加,木槿叶片CAT 活性一直呈现下降趋势,可能是由于CAT 降解速度快导致的。
生物富集系数表示植物对元素吸收和贮存的能力[19],植物体不同器官对重金属的富集系数是不同的。本研究显示,木槿不同器官对Cd的富集能力表现为根>茎>叶,木槿将大部分Cd 富集在根部,这与冯莲莲等[20]和娄腾雪等[21]发现水稻和盐角草体内的Cd 主要富集在根部的研究结论相同。大多数植物吸收的Cd 主要积累在根系,而地上部含量较低[22],可能是Cd进入根皮层细胞后被多种有机物质结合沉积[23],根部累积了大量的Cd,阻止其向地上部转移,缓解了Cd对地上部的毒害作用[24]。转移系数是衡量Cd从地下部向地上部转运效率的指标[19],Cd 进入根细胞后,部分Cd 被储存在根细胞的液泡中,但有一部分通过木质部被转运至植物体的地上部分。本研究结果显示,从土壤中吸收的Cd大部分被保留在木槿的根部,只有少量的Cd被转运到地上部,其转运系数均小于1,这与王新和吴燕玉[25]对水稻的研究结果类似。木槿可能通过控制Cd 向地上部转运来降低Cd 胁迫对其生长的影响,提高其对Cd 的耐性。此外,虽然只有少部分的Cd 被运转至地上部茎叶,但由于木槿地上部的生物量大,地上部仍然可以积累大量的Cd,不失为污染土壤植物修复的良好选择。
4 结论
重金属Cd胁迫使木槿叶片受到氧化损伤,对叶片抗氧化酶具有一定影响,木槿通过调节其在体内的水平,增强植物对Cd 的耐性,降低重金属胁迫对其产生的毒害作用,但是高浓度Cd抑制了木槿叶片抗氧化酶的活性。随着Cd 胁迫浓度的增加,木槿根、茎、叶对Cd 的累积量显著增加,其中根部对Cd的富集能力最强,木槿将大部分Cd累积在根部。本研究结果为利用木槿改良Cd 污染土壤的植物修复技术,开发适合Cd污染土壤种植的优良树种提供了新思路。
