腌韭菜根中五种腐败菌菌液OD值与其活菌数相关性研究*
2022-01-11张廷辉汤承浩王晓铭胡秀虹钟艳子张海兰
张廷辉,汤承浩,王晓铭,胡秀虹▲,钟艳子,张海兰
(1黔东南州食品药品检验检测中心,贵州 凯里 556011;2凯里学院大健康学院,贵州 凯里 556011)
韭菜根是百合科葱属多年生宿根性植物——宽叶韭(AlliumhookeriThwaites)的肉质根,主要产于云贵川和西藏[1-2]。腌韭菜根是贵州黔东南的一款本土特色食品,因其丰富的营养成分、独特的风味及保健功效,深受当地少数人们的喜爱。不过,韭菜根原料水分含量高又营养丰富,极易造成袋装产品在贮存过程中的腐败。研究表明,腌制蔬菜的变质在一定程度上与其腐败微生物的数量密切相关[3]。课题组研究发现致使腌韭菜根腐败变质的主要微生物是细菌[4-5]。
目前,测定细菌菌液浓度的方法主要有比浊法[6-7]、平板计数法[8]和显微镜计数法等。显微镜计数法虽然快速,但不能做出宏观、全面的反应;平板计数法重复性、平行性好但速度慢、工作量大;比浊法测定的一般为细菌总数(活菌数+死菌数),具有简单、快速等优点,对无色素产生、菌液颜色较浅的细菌而言,是一个不错的选择[9]。严佩峰、曹国珍等[10-11]研究发现,在细菌培养至对数期的某一菌液浓度范围内,细菌菌液的吸光度与菌液浓度呈正相关性。近年来,也有研究进一步证实,可采用比浊法结合平板计数法得到菌液活菌数与OD600值的线性关系,进而通过吸光度测定能够快速获得菌液活菌数[12-14]。本文以腌韭菜根中分离获得的五种腐败菌为研究对象,采用比浊法与平板计数法探究菌液活菌数与OD值之间的相关性,以期在腐败菌的后期腐败特性、生长特性及防控等研究中为菌液活菌数的测定提供依据。
1 材料与方法
1.1 材料
1.1.1 菌种与试剂
试验用的细菌菌种见表1。常用试剂见表2。

表1 供试菌种Tab.1 Test strains

表2 试验用试剂Tab.2 Reagents for the test
1.1.2 仪器与设备
FA2004型电子天平,奥豪斯仪器(上海)有限公司;SW-CJ-2D型双人净化工作台,上海苏净实业有限公司;ZWY-CZ11D型恒温摇床培养振荡器,上海智诚分析仪器有限公司;BGZ-246型电热鼓风干燥箱、SPX-150B-Z型生化培养箱,上海博迅实业有限公司医疗设备厂;LDZX-50kbs型立式压力蒸汽灭菌器,上海申安医疗器械厂;BIO-BRI型酶标仪,成都百乐科技有限公司。
1.2 试验方法
1.2.1 菌悬液的制备
在无菌操作下,将4 ℃保藏的菌种,取2环接种到100 mL肉汤培养基中180 r/min、30 ℃恒温培养15~18 h。用移液管依次取菌液5 mL、4 mL、3 mL、2 mL、1 mL分别置于编号为A、B、C、D、E的五个试管中,并用生理盐水稀释至10 mL,得到同株菌五个不同浓度梯度的菌悬液。
1.2.2 菌液活菌计数
参照GB 4789.2—2010《食品安全国家标准食品微生物学检验菌落总数测定》标准中的菌落计数方法,测定腌韭菜根中各腐败细菌菌液的活菌数[15],以cfu/g表示。具体操作如下:将五个编号的离心管分别进行1∶10倍梯度稀释,分别吸取10-5、10-6、10-7稀释度菌液1 mL涂布于无菌平皿内,待干燥后倒置于(36±1)℃培养箱中培养48 h后进行菌落总数测定。以灭菌生理盐水作空白对照,平行实验三次。
1.2.3 菌液OD值测定
使用移液枪移取编号 A、B、C、D、E五个离心管中的各菌悬液200 μL置于专用96孔板中,用酶标仪在600 nm波长下测定其吸光度值。因菌悬液存在一定的浊度,使得它对光有一定的吸收,故可在特定波长下测量菌悬液的吸光度来体现细菌菌液的浓度[16]。
1.2.4 标准曲线的绘制
以菌液活菌数(cfu/mL)作为纵坐标,菌液的OD600值作为横坐标,绘制各腐败细菌的菌液活菌数与吸光度的标准曲线。
1.2.5 数据处理
试验数据利用Excel 2010进行处理与分析。
2 结果与分析
2.1 B2菌液OD值与活菌数的相关性
B2不同稀释菌液的OD600值、平板菌落数及菌落总数(活菌数)结果如表3所示。由表3可知,B2各稀释菌液的OD600均值在0.1003~0.3936,活菌数为6.1×107~13.8×107cfu/mL。

表3 B2各稀释菌液的OD600值与活菌数Tab.3 OD600 value and number of live bacteria of eachdiluted B2 bacterial solution
以B2菌悬液的OD600值为横坐标,活菌数为纵坐标,绘制OD600值与活菌数的线性关系图,如图1。由图1可知,B2菌悬液的OD600值与其活菌数呈现良好的线性关系,其线性方程为y=25.81x+3.25,R2=0.9842。

图1 B2菌液活菌数与OD600相关性标准曲线图Fig.1 Standard curve of correlation between number of livebacteria and OD600 value of B2 bacterial solution
2.2 B5菌液吸光度与活菌数的相关性
B5不同稀释菌液的OD600值、平板菌落数及菌落总数(活菌数)结果如表4所示:B5各稀释菌液的OD600均值在0.0734~0.3551,活菌数为3.4×107~8.5×107cfu/mL。

表4 B5各稀释菌液的OD600值与活菌数Tab.4 OD600 value and number of live bacteria of eachdiluted B5 bacterial solution
B5菌液OD600值与活菌数的相关性标准曲线如图2所示。由图2可知,线性方程为y=16.63x+2.64,R2=0.9357,表明B5菌悬液的OD600值与其活菌数线性关系良好。

图2 B5菌液活菌数与吸光度相关性标准曲线图Fig.2 Standard curve of correlation between number of livebacteria and OD600 value of B5 bacterial solution
2.3 B7菌液吸光度与活菌数的相关性
B7不同稀释菌液的OD600值、平板菌落数及菌落总数(活菌数)结果如表5所示:B7各稀释菌液的OD600均值在0.0886~0.3911,活菌数为0.8×108~5.9×108cfu/mL。

表5 B7各稀释菌液的OD600值与活菌数Tab.5 OD600 value and number of live bacteria of eachdiluted B7 bacterial solution
B7菌液OD600值与活菌数的相关性标准曲线如图3。由图3可知,线性方程为y=16.16x-0.0035,R2=0.9268,表明B7菌悬液的OD600值与其活菌数线性关系良好。

图3 B7菌活菌数与吸光度相关性标准曲线图Fig.3 Standard curve of correlation between number of livebacteria and OD600 value of B7 bacterial solution
2.4 B8菌液吸光度与活菌数的相关性
B8不同稀释菌液的OD600值、平板菌落数及菌落总数(活菌数)结果如表6所示: B8各稀释菌液的OD600均值在0.1067~0.6489,活菌数为1.1×106~4.9×106cfu/mL。

表6 B8各稀释菌液的OD600值与活菌数Tab.6 OD600 value and number of live bacteria of eachdiluted B8 bacterial solution
以菌悬液的OD600值为X轴,活菌数为Y轴,绘制B8菌液OD600值与活菌数的相关性标准曲线,见图4。从图4不难发现,标准曲线回归方程为y=7.25x+0.30,R2=0.9926,表明B8菌液OD600值与活菌数的线性关系良好。

图4 B8菌液活菌数与吸光度相关性标准曲线图Fig.4 Standard curve of correlation between number of livebacteria and OD600 value of B8 bacterial solution
2.5 B11菌液吸光度与活菌数的相关性
B11不同稀释菌液的OD600值、平板菌落数及菌落总数(活菌数)结果如表7所示: B11各稀释菌液的OD600均值在0.0673~0.3551,活菌数为3.1×107~15.1×107cfu/mL。

表7 B11各稀释菌液的OD600值与活菌数Tab.6 OD600 value and number of live bacteria of eachdiluted B11 bacterial solution
B11菌液OD600值与活菌数的相关性标准曲线如图5。由图5可知,线性方程为:y=40.31x+0.83,R2=0.9890,表明B11菌悬液的OD600值与其活菌数线性关系良好。
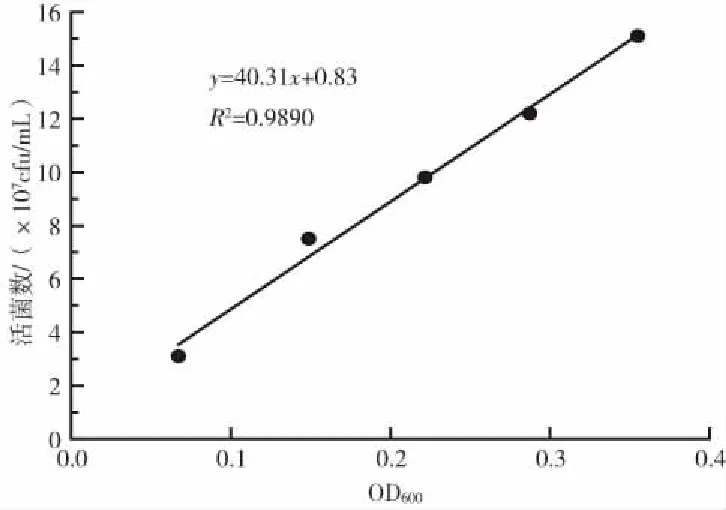
图5 B11菌液活菌数与吸光度相关性标准曲线图Fig.5 Standard curve of correlation between number of livebacteria and OD600 value of B11 bacterial solution
3 结论与讨论
相同条件下培养供试菌(土扬芽孢杆菌、巨大芽孢杆菌、莴苣不动杆菌、解淀粉芽孢杆菌和蜡样芽孢杆菌)特定时间,并依次按0.5、0.4、0.3、0.2、0.1的梯度对各供试菌菌悬液进行稀释,得到其OD600值的范围分别为:0.1003~0.3936、0.0734~0.3551、0.0886~0.3911、0.1067~0.6489和0.0673~0.3551;活菌总数范围为:6.1×107~13.8×107cfu/mL、3.4×107~8.5×107cfu/mL、0.8×108~5.9×108cfu/mL、1.1×106~4.9×106cfu/mL和3.1×107~15.1×107cfu/mL。对比不难发现,不同的菌种由于生长速度不同,其菌液浓度(吸光度及活菌总数)有很大的区别。
林静等[11]研究发现,在一定浓度范围内,菌液的吸光度与其活菌数成良好的线性关系,根据其线性方程测得吸光度就可得出相应菌液的活菌数,且计算所获得的活菌数的准确度越高,线性方程相关性系数(R2)需越接近1。本文进一步研究腌韭菜根中的5种供试菌菌液的OD600值与活菌数的相关性,得到其线性方程及相关性系数为:土扬芽孢杆菌:y=25.81x+3.25,R2=0.9842;巨大芽孢杆菌y=16.63x+2.64,R2=0.9357;莴苣不动杆菌y=16.16x-0.0035,R2=0.9268;解淀粉芽孢杆菌:y=7.25x+0.30,R2=0.9926;蜡样芽孢杆菌y=40.31x+0.83,R2=0.9890。该研究对腌韭菜根中的腐败菌的深入研究以及菌液浓度的快速测定具有十分重要的意义。
