PLK4基因在人食管鳞癌组织中的表达及对癌细胞增殖、侵袭迁移影响的研究
2022-01-11张进忠李悦淇
张进忠,李悦淇,石 科,杨 亮,郭 丹
1.河南医学高等专科学校检验系,河南 郑州 451191;
2.郑州大学医学院临床医学系,河南 郑州 450000
ESCC中mTOR/p70S6K信号转导通路高度激活,抑制mTOR/p70S6K信号转导通路的活性使下游靶蛋白p70S6K和4E-BP1的磷酸化水平下降,抑制细胞的增殖和迁移能力[7]。激活m-TOR改变有丝分裂细胞的中心体定位,影响细胞定向分裂促进肾囊肿的形成[8]。抑制mTORC1激酶的活性使有丝分裂纺锤体形成的关键调节因子的定位受损,导致纺锤体组装和胞质分裂缺陷[9]。研究[10]显示,在胶质母细胞瘤中敲低PLK4的表达可增强硼替佐米的抗肿瘤作用,可能由PTEN/PI3K/AKT/mTOR 信号转导通路介导,细胞凋亡和氧化应激过程被激活。然而,PLK4是否通过调节mTOR/p70S6K信号转导通路参与ESCC的进程鲜见报道。本研究通过检测ESCC细胞和组织中PLK4的表达水平,分析PLK4表达与临床病理学特征之间的关系,下调PLK4的表达检测ESCC细胞增殖及侵袭转移能力的变化,并探索其可能的分子机制,为ESCC诊断和治疗提供潜在的分子靶点。
1 材料和方法
1.1 主要试剂
胎牛血清、胰蛋白酶和RPMI-1640细胞培养基购自美国Gibco公司,TRIzol、反转录试剂盒和LipofectamineTM2000转染试剂购自美国Invitrogen公司,SYBR Green 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)试剂盒购自美国Thermo Fisher公司,PLK4抗体和β-actin抗体购自英国Abcam公司,mTOR抗体、p70S6K抗体、p-mTORSer2448抗体和p-p70S6KThr421/Ser424抗体购自美国Cell Signaling Technology公司,HRP标记羊抗鼠IgG购自武汉博士德生物工程有限公司,BCA蛋白浓度测定试剂盒和细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自上海碧云天生物技术有限公司,transwell小室购自美国Corning公司。
1.2 细胞株
正常食管上皮细胞Het-1A、人ESCC细胞系TE-1、TE-8和TE-13均购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。
1.3 病例资料
选取2017年1月—2019年12月河南医学高等专科学校附属医院93例经病理组织学检查确诊为ESCC患者的癌组织及其配对的癌旁组织(距原发灶边缘5 cm以上)。入选标准:ESCC为原发性肿瘤并无其他肿瘤病史;未经任何ESCC相关化疗、免疫治疗等;无食管手术治疗史。其中男性43例,女性50例,年龄(55.32±10.23)岁。手术后立即将新鲜标本进行液氮冻存。
1.4 方法
1.4.1 细胞培养
Het-1A细胞和ESCC细胞(TE-1、TE-8和TE-13)加入含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640细胞培养基,置于37 ℃,CO2体积分数为5%的细胞培养箱中培养。
小鼠经腹腔注射戊巴比妥钠(40 mg/kg)麻醉后,固定于平板上。75%酒精消毒颈部皮肤后,做1 c m长的切口,钝性分离并暴露气管,用1 mL注射器向肺内注射50μL生理盐水或LPS(5 mg/kg体重);将小鼠头向上摇晃小鼠,让液体在肺内均匀分布;随后将颈部切口缝合,让自然苏醒。
1.4.2 RTFQ-PCR检测PLK4基因的表达
用TRIzol提取细胞总RNA,反转录试剂盒合成cDNA,用于RTFQ-PCR实验检测PLK4基因的表达。PLK4上游引物为5’-AATCAAGCACTCTCCAATC-3’,PLK4下游引物为5’-TGTGTCCTTCTGCAAATC-3’;β-actin上游引物为5’-GTTGCGTTACACCCTTT CTTG-3’,β-actin下游引物为5’-CACCTTCAC CGTTCCAGTTT-3’。反应体系:cDNA 0.2 μL,上下游引物各0.5 μL,SYBR缓冲溶液29.25 μL,Real Master Mix 35.7 μL,ddH2O 33.85 μL。反应条件为:94 ℃10 min,30个循环:94 ℃15 s,60 ℃32 s。采用2-ΔΔCt法计算PLK4基因的mRNA相对表达量。
1.4.3 蛋白质印迹法(Western blot)检测蛋白水平
离心收集细胞后用RIPA裂解液提取细胞总蛋白。临床组织用液氮速冻后加入RIPA裂解液研磨提取组织总蛋白。BCA法测定蛋白质浓度,取20 μg蛋白质上样进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate polyacrylamide gel electrophoresis,SDS-PAGE),半干转至PVDF膜,用5%脱脂奶粉4 ℃过夜封闭,一抗4 ℃过夜温育,然后与HRP标记的二抗室温温育1 h,ECL发光液进行显影,扫描仪扫描条带并用Image J分析。
1.4.4 利用siRNA技术抑制TE-13细胞中PLK4的表达
将处于对数生长期的TE-13细胞接种于6孔板,置于37 ℃、CO2体积分数为5%细胞培养箱中培养至融合度达60%~80%,弃去培养基,每孔加入2.0 mL无血清培养基,其中含10 µL LipofectamineTM2000试剂和10 µL si-PLK4 RNA(或si-control RNA)混合均匀,继续置细胞培养箱中培养,6 h 后弃去含转染复合物的培养基,加入新鲜培养基继续培养48 h。本研究中si-PLK4 RNA序列顺义链为5’-GACCTTATTCACCAGTTACTT-3’,反义链为5’-GACCTTATTCACCAGTT-3’;si-control RNA序列顺义链为5’-UUCUCCG AACGUUGUCACGUTT-3’,反义链为5’-ACGUG ACACGUUCGGAGAATT-3’。
1.4.5 CCK-8和克隆形成实验检测细胞增殖能力
将细胞接种到96孔板中(2×104个/孔),细胞贴壁后每孔加入10 µL CCK-8测定液,在培养箱中继续培养1 h。用酶标仪检测细胞在450 nm处的吸光度(D)。细胞抑制率=(D对照孔平均值-D实验孔平均值)/D对照孔平均值×100%。
将细胞接种到6孔板中(1×103个/孔),置培养箱中培养细胞至两周,每隔3天更换培养液一次,当克隆数停止增加时弃去培养基,用4%多聚甲醛固定细胞30 min,再用结晶紫染色,计算细胞克隆数。
1.4.6 Transwell小室实验检测细胞侵袭能力
将transwell小室置于24孔培养板的孔中,下室加入600 μL含10%胎牛血清的RPMI-1640培养基。上室加入无血清RPMI-1640培养基和处理过的细胞。培养24 h后用4%的多聚甲醛固定细胞30 min,PBS清洗小室洗去多余的甲醛,加入1%的结晶紫室温放置30 min,PBS清洗3次,用乙醇棉球擦拭上室未迁移的细胞,显微镜下取随机视野观察。
1.4.7 划痕愈合实验检测细胞迁移能力
将细胞接种到6孔板中,待细胞的融合度达到90%,用划痕仪在6孔板下部的中心划痕,形成划痕后置培养箱中继续培养,分别在划痕后0和48 h拍摄划痕愈合单层的照片,计算每组细胞迁移率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.5 统计学处理
数据用SPSS 23.0软件进行统计学分析。PLK4在各细胞中的表达差异用单因素方差分析。构建受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under curve,AUC)用于评估PLK4蛋白表达水平在诊断ESCC中的性能,计算cutoff值,统计PLK4蛋白表达诊断ESCC的灵敏度和特异度。用卡方检验分析组织标本中两组间PLK4蛋白表达差异。Spearman相关性分析PLK4和ESCC病理学参数之间的相关性,Spearman偏相关性分析临床分期和PLK4表达的净相关。P<0.05为差异有统计学意义。
2 结果
2.1 PLK4在ESCC细胞和组织中的表达
与Het-1A细胞相比,PLK4基因的mRNA在ESCC细胞中均呈高表达,差异有统计学意义(P<0.05,图1)。Western blot检测结果显示,PLK4蛋白在各ESCC细胞中也呈高表达,与Het-1A相比,差异有统计学意义(P<0.05,图2)。
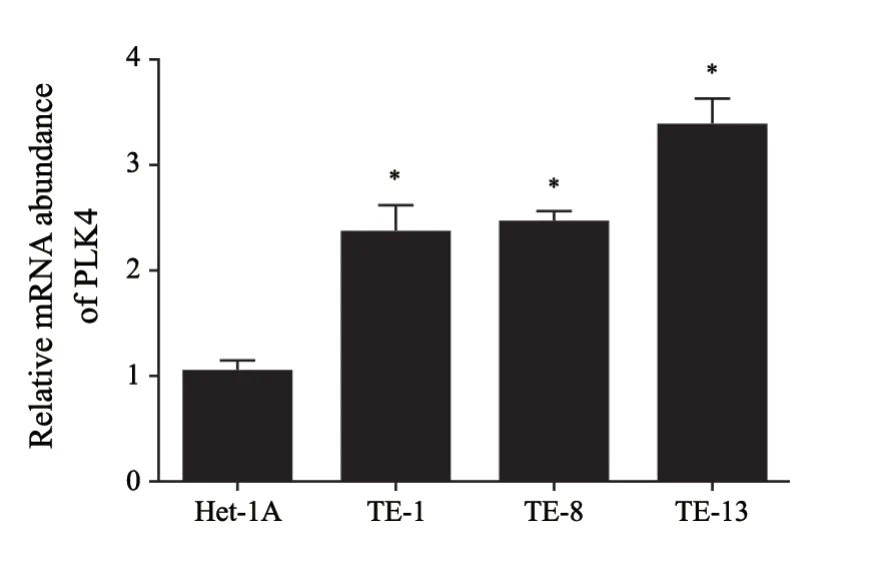
图1 Het-1A和ESCC细胞株中的PLK4 mRNA表达Fig.1 Expression of PLK4 mRNA in Het-1A and ESCC cell lines

图2 Het-1A和ESCC细胞株中的PLK4蛋白的表达Fig.2 Expression of PLK4 protein in Het-1A and ESCC cell lines
通过Western blot检测ESCC组织和癌旁正常组织中PLK4蛋白的水平,绘制ROC曲线。结果显示,AUC为0.841,95% CI:0.786~0.895,采用约登指数最大法得到cutoff值为1.343,灵敏度为74.2%(69/93),特异度为89.2%(83/93),差异有统计学意义(P<0.0001,图3,表1)。
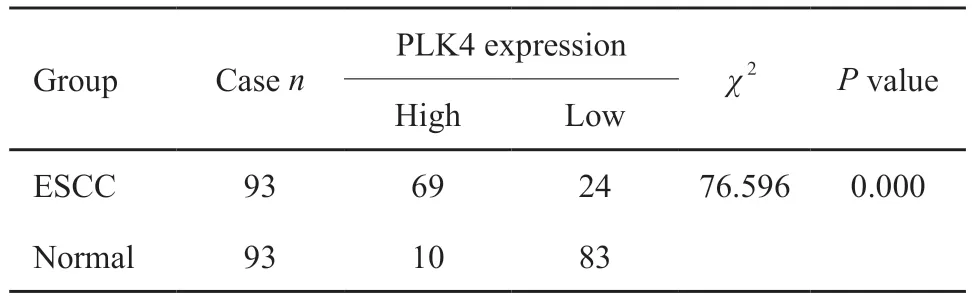
表1 PLK4蛋白在ESCC组织和癌旁正常组织中的水平Tab.1 Level of PLK4 protein in ESCC and para-cancerous tissues

图3 ESCC和癌旁正常组织中PLK4蛋白的水平Fig.3 Level of PLK4 protein in ESCC and para-cancerous tissues
2.2 PLK4蛋白水平与临床病理学参数的关系
ESCC组织中PLK4蛋白水平与性别、年龄和肿瘤大小均无关(均P>0.05),但与分化程度、临床分期和淋巴结转移有关(均P<0.05)。ESCC分化程度越低,PLK4阳性率越高,其中低分化程度的ESCC组织中PLK4阳性率为86.7%,Ⅲ~Ⅳ期患者ESCC组织中PLK4蛋白阳性率为92.3%(表2)。

表2 ESCC组织中PLK4蛋白水平与临床病理学参数的关系Tab.2 Relationship between protein level of PLK4 in ESCC and clinical parameters
2.3 PLK4表达与ESCC临床分期的相关性分析
ESCC组织中PLK4表达与分化程度、淋巴结转移和临床分期均有相关性(P<0.05),此外,PLK4表达与临床分期呈正相关(r=0.604,P=0.000,表3)。为了研究临床分期和PLK4表达的净相关,经Spearman偏相关控制分化程度和淋巴结转移这两个因素后,PLK4表达与临床分期之间的净相关系数r为0.539(P=0.000)。
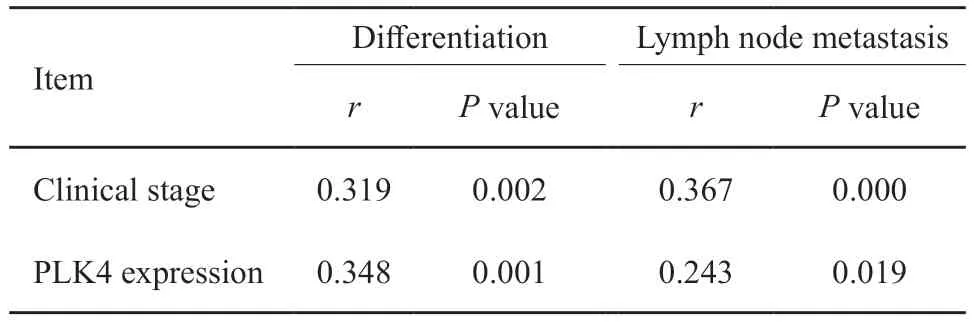
表3 PLK4表达与ESCC临床病理学参数相关性分析Tab.3 Correlation analysis between PLK4 expression and ESCC clinic opathological parameters
2.4 抑制PLK4基因的表达对TE-13细胞增殖、侵袭迁移的影响
采用si-RNA干扰技术抑制ESCC细胞TE-13中PLK4的表达,RTFQ-PCR和Western blot结果显示成功抑制TE-13细胞中PLK4的表达(P<0.05,图3)。CCK-8结果显示,siRNA抑制PLK4的表达后,TE-13的增殖速度显著低于对照(P<0.05,图4A),克隆形成实验结果显示,si-PLK4组的克隆细胞数显著低于对照组(P<0.05,图4B和4C)。划痕迁移实验结果显示,si-PLK4组的细胞迁移率为16.67%,显著低于对照组(P<0.05,图4D)。Transwell小室实验结果显示,si-PLK4组的细胞侵袭数显著低于对照组(P<0.05,图4E和4F)。
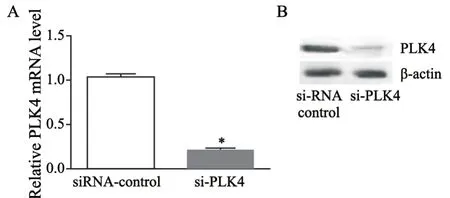
图4 抑制食管鳞癌细胞TE-13中PLK4的表达Fig.4 Inhibition of PLK4 expression in esophageal squamous cell carcinoma TE-13
2.5 抑制PLK4的表达对mTOR/p70S6K信号转导通路的影响
为了研究PLK4对TE-13细胞增殖、侵袭和迁移影响的潜在机制,通过Western blot检测了mTOR/p70S6K信号转导通路靶蛋白的表达水平。与对照组相比,si-PLK4组mTOR和p70S6K蛋白的表达水平降低,分别为0.69(P<0.05)和0.56(P<0.05),此外,p-mTORSer2448和p-p70S6KThr421/Ser424的蛋白水平显著低于对照组,分别为0.20(P<0.05)和0.19(P<0.05,图5、6)。
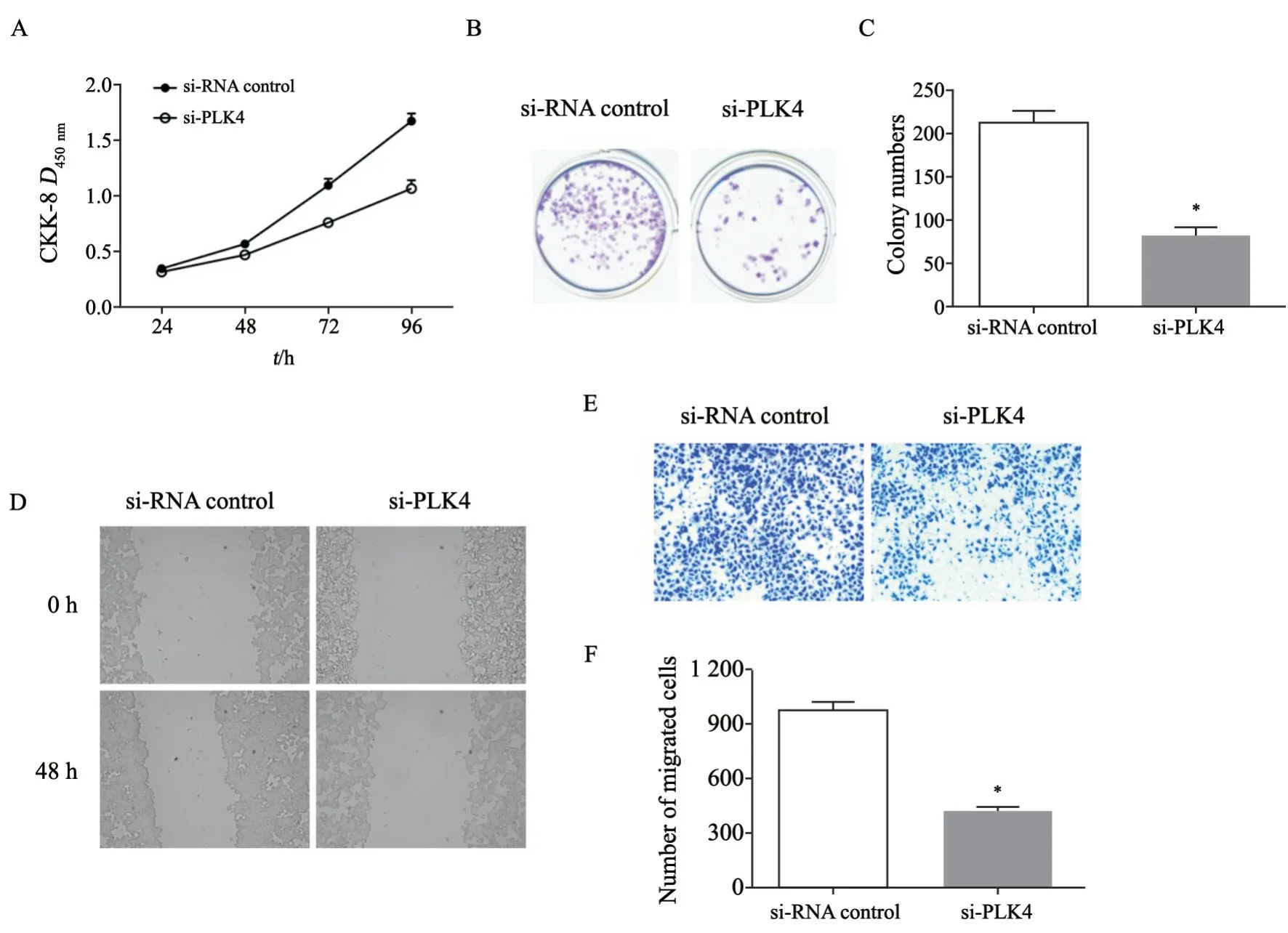
图5 抑制PLK4的表达对TE-13细胞增殖、侵袭和迁移的影响Fig.5 Effect of inhibition of Plk4 expression on proliferation,invasion and migration of TE-13 cells
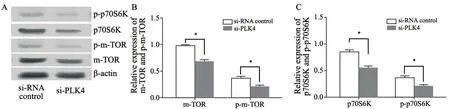
图6 PLK4对TE-13细胞mTOR/p70S6K信号转导通路活性的影响Fig.6 Effects of PSMD7 on the activity of mTOR/p70S6K pathway in TE-13 cells
3 讨 论
PLK4作为调节细胞周期的蛋白激酶,参与有丝分裂的多个步骤,如有丝分裂启动、中心体成熟、胞质分裂等,同时还参与DNA损伤检测点和有丝分裂中期检测点的信号转导[11-12]。有研究[13]结果显示,PLK4在结直肠癌中的表达高于癌旁组织,并且与组织分化程度、淋巴结转移和TNM分期有关。PLK4的高表达与肿瘤组织分级、恶性程度及肿瘤患者的预后呈正相关[14],提示PLK4可能是肿瘤诊断、预后和化疗的评价指标。
通过TCGA数据库对PLK4 mRNA在食管腺癌和正常组织中的表达进行分析,发现食管腺癌组织中PLK4 mRNA表达的中位值是正常组织的8~9倍[15],而PLK4在ESCC组织中的表达鲜见报道。本研究发现,PLK4在各ESCC细胞中的mRNA表达和蛋白水平均显著高于正常食管上皮细胞,且ESCC组织标本中PLK4蛋白的水平显著高于癌旁正常组织。PLK4的表达水平诊断ESCC的AUC为0.841,灵敏度和特异度分别为74.2%和89.2%,PLK4蛋白水平与性别和年龄均无关(P>0.05),但与分化程度、临床分期和淋巴结转移相关(P<0.05),低分化程度的ESCC组织中PLK4阳性率最高,Ⅲ~Ⅳ期患者ESCC组织中PLK4阳性率最高,说明PLK4表达水平与ESCC的恶性程度有关,参与ESCC的发生、发展。
本研究结果表明PLK4表达与临床分期呈正相关,控制分化程度和淋巴结转移因素后,PLK4表达与临床分期之间仍呈正相关。目前已经鉴定了几种PLK4的小分子抑制剂,其中一些正在临床试验中。CFI-400945是第一种口服PLK4抑制剂,CFI-400945在PLK4过表达的乳腺癌细胞中具有选择性的抗肿瘤活性[16]。进一步的研究证明了CFI-400945在多种肿瘤中具有显著的抗肿瘤作用,包括胰腺癌[17]、肺癌[18]、肝癌[19]和乳腺癌[20]。YLT-11是一种新设计的选择性PLK4抑制剂,Lei等[21]的研究表明YLT-11能显著抑制乳腺癌细胞的增殖,并导致中心体复制和有丝分裂缺陷的失调,从而增加肿瘤细胞对化疗的敏感性。鉴于PLK4在ESCC中呈高表达,以及与临床分期的正相关性,PLK4有望成为ESCC潜在的治疗靶点。
在细胞增殖过程中mTOR/p70S6K信号转导通路发挥关键作用,并受其他蛋白质的调节[22-23]。Wu等[24]探索了临床ESCC组织标本中mTOR/p70S6K信号转导通路中各种靶蛋白水平与临床病理学因素以及患者预后之间的关系,发现mTOR、p-mTOR、p70S6K、p-p70S6K、延伸起始因子4E、结合蛋白-1等在肿瘤组织中显著上调,mTOR和p70S6K的表达与总生存期相关,而p-mTOR与无进展生存期相关,并证实mTOR的过表达是ESCC总体生存的独立不良预后因素。白血病患者的肿瘤细胞中诱导Plk1的表达后使mTOR信号转导通路激活,促进肿瘤细胞的增殖,并抑制细胞的凋亡[25]。在ESCC细胞系中,mTOR/p70S6K信号转导通路通过多个丝氨酸和苏氨酸残基的磷酸化被激活[26],下调PLK4不仅降低mTOR和p70S6K的表达,还可抑制p-mTORSer2448和p-p70S6KThr421/Ser424的表达。本研究结果显示,下调PLK4引起的ESCC细胞增殖和侵袭迁移能力的降低可能与mTOR/p70S6K信号转导通路密切相关。
本研究结果证实,PLK4在ESCC细胞系和组织中的高表达,与分化程度、临床分期及淋巴结转移相关。进一步的机制研究表明,PLK4可能通过mTOR/p70S6K信号转导通路抑制TE-13细胞的增殖和侵袭迁移能力。
