RNA干扰在鳞翅目昆虫中的应用研究进展
2022-01-11张秋朗刘建宏
张秋朗,刘建宏,徐 进,2*,叶 辉
RNA干扰在鳞翅目昆虫中的应用研究进展
张秋朗1,刘建宏1,徐 进1,2*,叶 辉3*
(1. 西南林业大学 云南生物多样性研究院,云南 昆明 650224;2. 西南林业大学 西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224;3. 云南大学 生态与环境学院,云南 昆明 650091)
鳞翅目(Lepidoptera)是昆虫纲中的第二大目,现已经记载的鳞翅目昆虫多达18万个种。鳞翅目昆虫中的许多成员是重要的全球性农业害虫。多数鳞翅目害虫具有繁殖快、危害重、抗药性强及长距离迁飞等特性,对农业生产构成巨大威胁。RNA干扰(RNAi)技术是指通过将目的基因特异性同源双链RNA(dsRNA)导入到细胞内,引起与其同源的mRNA特异性降解,从而达成目标基因表达沉默的一种分子技术。目前该技术已被广泛应用于鳞翅目昆虫的基因功能研究和绿色害虫防治策略探索,并在近年来取得了显著成效和进展。基于此,对RNAi在昆虫中的作用机理进行了归纳和概括,并重点总结和探讨了近年来RNAi技术在鳞翅目昆虫基因功能研究以及鳞翅目害虫防治新方法探索方面取得的新进展,以期为鳞翅目昆虫相关科学研究和生产实践提供参考。
鳞翅目昆虫;RNA干扰;基因功能;害虫防治
鳞翅目(Lepidoptera)是昆虫纲(Insecta)中的第二大目,现已记载的鳞翅目昆虫约有18万种,分属于47个总科和128个科[1]。鳞翅目昆虫包括蛾类(moths)、蝴蝶(butterflies)和弄蝶(skippers)3大类群,但蛾类占了绝大多数(约90%)。
鳞翅目昆虫多以幼虫取食植物,有许多是全球性的重要农林业害虫,例如棉铃虫()、小菜蛾()、舞毒蛾()、烟青虫()、玉米螟()、二化螟()、甜菜夜蛾()、斜纹夜蛾()和草地贪夜蛾()等。许多鳞翅目害虫具有寄主范围广、繁殖快、危害重、抗药性强及长距离迁飞能力等特性,每年对农业造成巨大经济损失。以近年来正在全世界发生的重大迁飞性农业害虫草地贪夜蛾为例,该害虫原产于美洲热带和亚热带地区,主要危害玉米、水稻等粮食作物[2-3]。自2016年开始,该害虫入侵了非洲、亚洲、大洋洲等60多个国家和地区[4],并于2019年初经由云南入侵我国[5]。之后迅速扩散至我国大部分地区,其中包括长江流域、黄河流域和东北玉米、小麦等重要粮食作物主产区[6]。除了长距离迁飞能力,草地贪夜蛾还具有较强的繁殖能力和抗药性[7]。在非洲,草地贪夜蛾可造成玉米年产量减少21%~53%,经济损失估计为24.81~61.87亿美元[8]。在我国,草地贪夜蛾每年对玉米及小麦造成的经济损失估计分别为172.86~521.43亿美元[9]及155.71~901.43亿美元[10]。另一些鳞翅目昆虫也能对仓储粮食造成巨大损失,例如地中海粉螟(,印度谷螟(,粉斑螟(及葡萄干果斑螟(等,是世界性广泛分布的重要仓储害虫[11-12]。而一些鳞翅目昆虫,例如家蚕(和虫草蝙蝠蛾(,却是重要的经济性昆虫。许多蝶类不仅具有较高的艺术观赏价值,在生物多样性保护及全球气候变化生物效应研究领域也有重要价值。此外,大部分鳞翅目昆虫的成虫在植物传粉方面也起着不可忽视的作用。
Fire等[12]首次在秀丽隐杆线虫()中发现外源性双链RNA(double-stranded RNA,dsRNA)可以引起内源同源基因沉默的现象,并将其命名为RNA干扰(RNA interference,RNAi)。自首次发现,RNAi被证明存在于绝大部分真核生物中,包括原生动物、无脊椎动物、脊椎动物、真菌、藻类和植物[13]。由于其简单高效等特性,RNAi自发现后便迅速成为基因功能研究的强大反向遗传学工具[14-16]。与此同时,RNAi在害虫防治方面也显示出巨大的潜力,在这方面的里程碑式进展是成功培育了表达双链RNA的抗病及抗虫转基因作物[17-18]。当前有效目标基因的快速鉴定和新型 dsRNA 递送系统的开发将有助于进一步推进基于RNAi技术的病虫害防治研究和应用。
2002年,Bettencourt等[19]首次将RNAi技术用于鳞翅目昆虫刻克罗普斯蚕蛾()上。到目前为止,已有超过100篇文献报道了在鳞翅目昆虫中成功应用RNAi技术的实例,这些研究涵盖了10个科25种鳞翅目昆虫(表1~3)。基于此,本文总结了RNAi内在机理的研究发现,并重点总结和探讨了近年来应用RNAi技术研究鳞翅目昆虫基因功能以及探索鳞翅目害虫防治新方法方面取得的新进展。
1 RNAi作用机理
1.1 RNAi相关小 RNA
小RNA是一类<200 nt(核苷酸)的核糖核酸短链,它们一般是非编码小RNA分子,目前已知3种不同类别的小RNA可触发相应的RNAi途径[20]:(1)PIWI interacting RNAs(piRNAs):单链RNA,通常长度约为23~36 nt单链,与PIWI(P-element induced wimpy testis)亚家族蛋白结合抑制基因转录过程并维持生殖细胞中基因组的稳定性和完整性,保证正常的配子发生和生殖过程[18,21];(2)microRNAs(miRNAs):为21~24 nt的单链RNA,主要调控基因在转录后水平的表达[22-23];(3)small interfering RNAs(siRNAs):siRNA是dsRNA,通常长度为19~21 bp,由外源或内源的长dsRNA分子加工而成,分为外源siRNAs(exo-siRNAs)和内源siRNAs(endo-siRNAs)。参与生物体抵抗病毒的侵入、抑制转座子的扩展或是调控基因转录后的表达等机制[21-22]。
虽然siRNA和miRNA进入RNAi途径的方式不同,但两者都是dsRNA被核糖核酸酶RNase III(Dicer酶)切割形成的[24]。siRNA和miRNA通过与Argonaut(AGO)家族蛋白结合形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)。
1.2 昆虫细胞摄取dsRNA的机制
在昆虫中,dsRNA摄取可能存在2种主要机制:(1)基于SID-1和SID-2蛋白的跨膜通道介导(transmembrane channel-mediated)的dsRNA摄取机制[25];在线虫()中,SID-1是一种多跨膜蛋白,在线虫的系统性RNAi(systemic RNAi)过程中起到至关重要的作用,其功能是形成一个多聚体将dsRNA被动运输到细胞内。SID-2蛋白主要存在于线虫的肠道组织中,在线虫的环境RNAi(environmental RNAi)过程中发挥作用[25]。SID同源蛋白同样存在于鳞翅目昆虫中,例如在家蚕(中发现了3个SID同源蛋白,在甜菜夜蛾()体内也发现了1个SID同源蛋白[26]。(2)内吞作用介导(endocytosis-mediated)的dsRNA摄取机制[27]。黑腹果蝇()中没有SID同源基因,其dsRNA摄取与囊泡(vesicles)、清除剂受体(scavenger receptors)以及其它直接或间接参与内吞作用的蛋白有关,RNAi 途径由内吞作用介导[27]。
2 外源dsRNA导入昆虫体内的方法
dsRNA导入昆虫体内的方法包括微量注射、饲喂、浸泡、电穿孔、病毒转染以及转基因等(表1~3)。dsRNA导入效率可因方法和物种的不同有很大差异,同一方法用在不同物种也可能产生很大差异[26,28]。
2.1 微量注射法
将适量的dsRNA溶液直接注射到昆虫胚胎或昆虫体内[29]。显微注射是将dsRNA导入生物体内并进入RNAi途径最直接有效的手段。1998年,Kennerdell和Carthew首次用显微注射法将黑腹果蝇()目标基因的dsRNA导入到果蝇的胚胎中,从而得到目标基因的缺陷型[30]。许多研究已经成功地在不同种的鳞翅目昆虫中成功建立RNAi的微量注射体系(表1)。但是,通过显微注射在鳞翅目昆虫中导入dsRNA进行RNA干扰的效率相差很大,并不如在其它目的昆虫中直接[31-32]。此外,dsRNA显微注射导入法仅适用于在实验室内开展,无法在害虫防治中应用。
2.2 饲喂法
通过取食dsRNA的方式进入到生物体内并引发RNAi的过程。Timmon等[33]最早在线虫()证明通过取食表达dsRNA的大肠杆菌可以导致靶基因沉默。在随后的研究中,无论是喂食表达dsRNA的转基因植物和细菌还是直接喂食人工合成的dsRNA,基于饲喂dsRNA的RNAi技术在各种昆虫类群包括鳞翅目昆虫中获得了广范的应用(表2)。相比于微量注射,饲喂是dsRNA引入到昆虫体内的一种更自然的方法,它不仅造成的损伤小,此方法可以应用到基于RNAi的害虫防治中,可将人工合成的dsRNA或表达dsRNA的细菌喷洒到植物表面,害虫通过取食这些植物导致死亡,或害虫直接取食表达dsRNA的转基因植物而引起滞育和死亡(表3)。
2.3 浸泡法
基于浸泡的dsRNA导入方法适用于昆虫细胞和组织,以及昆虫的特定发育阶段,如昆虫的卵期和新生幼虫[34]。最早报告使用浸泡处理导入dsRNA成功进行RNAi是在线虫()中[35]。浸泡方法也已在鳞翅目昆虫中得到成功应用,包括细胞[36-37],卵[38]和幼虫[39](表2)。
2.4 转基因
转基因能使昆虫稳定持续地产生dsRNA,同时可以传给下一代,有利于研究基因在昆虫一生乃至几代中的功能。最早应用于黑腹果蝇()中,利用GAL4/ UAS转基因技术表达发夹RNA从而导致目的基因的沉默[40],随后在鳞翅目昆虫家蚕()中获得成功应用[41]。这种技术同样适用于害虫防治,例如通过释放携带有可以引起雄性或雌性不育的dsRNA的转基因昆虫到田间,转基因昆虫与野生昆虫进行交配从而导致野生个体不育和生殖力下降[42]。
2.5 细菌介导
即通过饲喂或注射利用重组共生菌表达的dsRNA完成RNAi,最常用的是利用重组大肠杆菌表达相关基因的dsRNA。Tian等[43]最早利用重组大肠杆菌表达几丁质酶()基因的dsRNA,甜菜夜蛾()幼虫食用表达dsRNA的菌液后死亡率显著上升。细菌介导可以利用活体细菌表达dsRNA,也可以通过热灭活细菌表达[44]。使用细菌表达的dsRNA比使用试剂盒在体外生产dsRNA更具成本效益,特别是在大规模基因功能分析和害虫防治应用中[45]。
2.6 病毒转染
病毒转染原理是将目标基因dsRNA通过病毒的侵染复制途径导入寄主体内进行RNAi过程。病毒介导RNAi的研究还不多,该种方法利用病毒的侵染复制途径,相较于转基因RNAi无需建立转基因昆虫品系,花费的时间更短,去除了转基因昆虫个体或者组织的选育过程[46]。
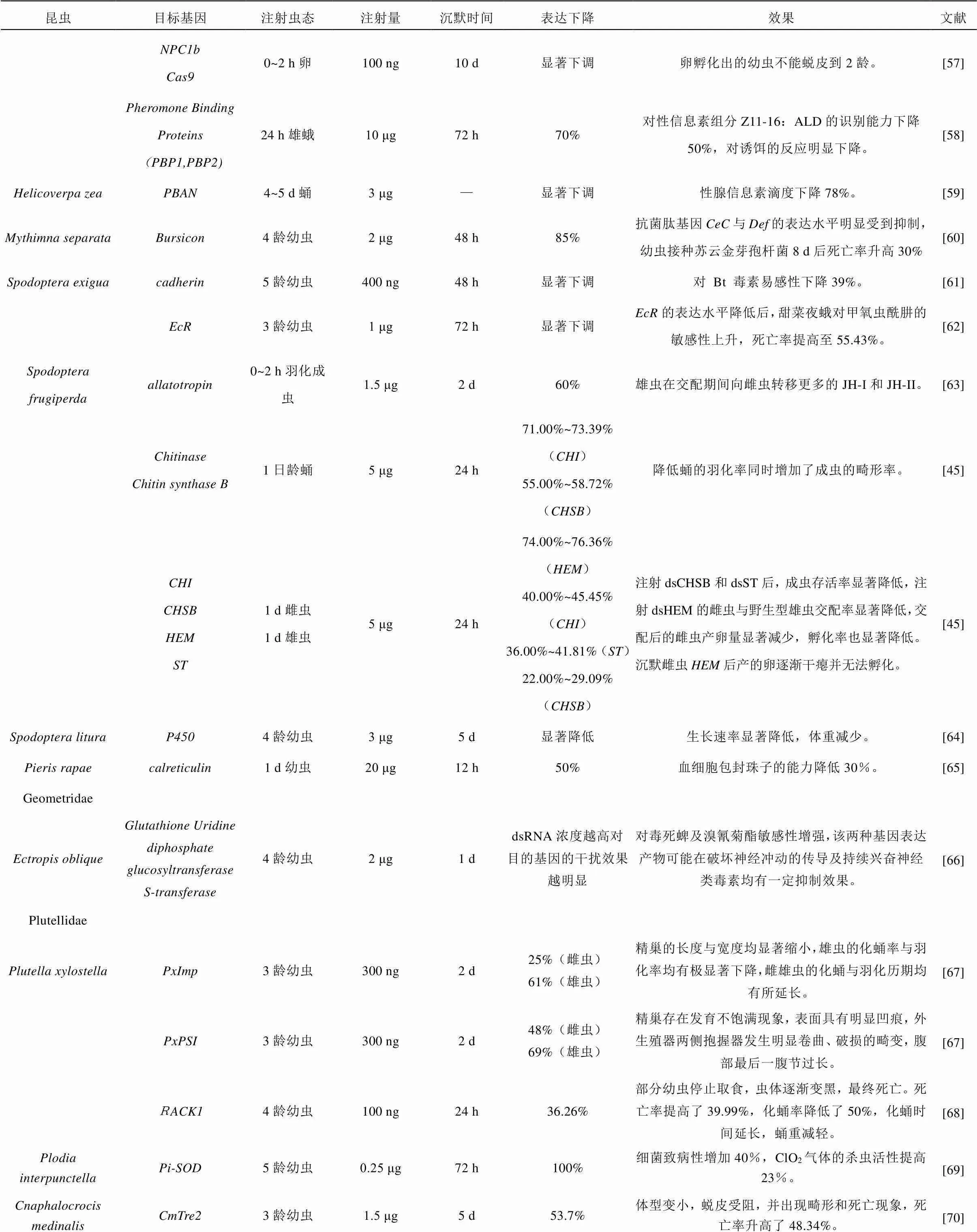
续表1 应用dsRNA微量注射法研究鳞翅目昆虫基因功能的实例
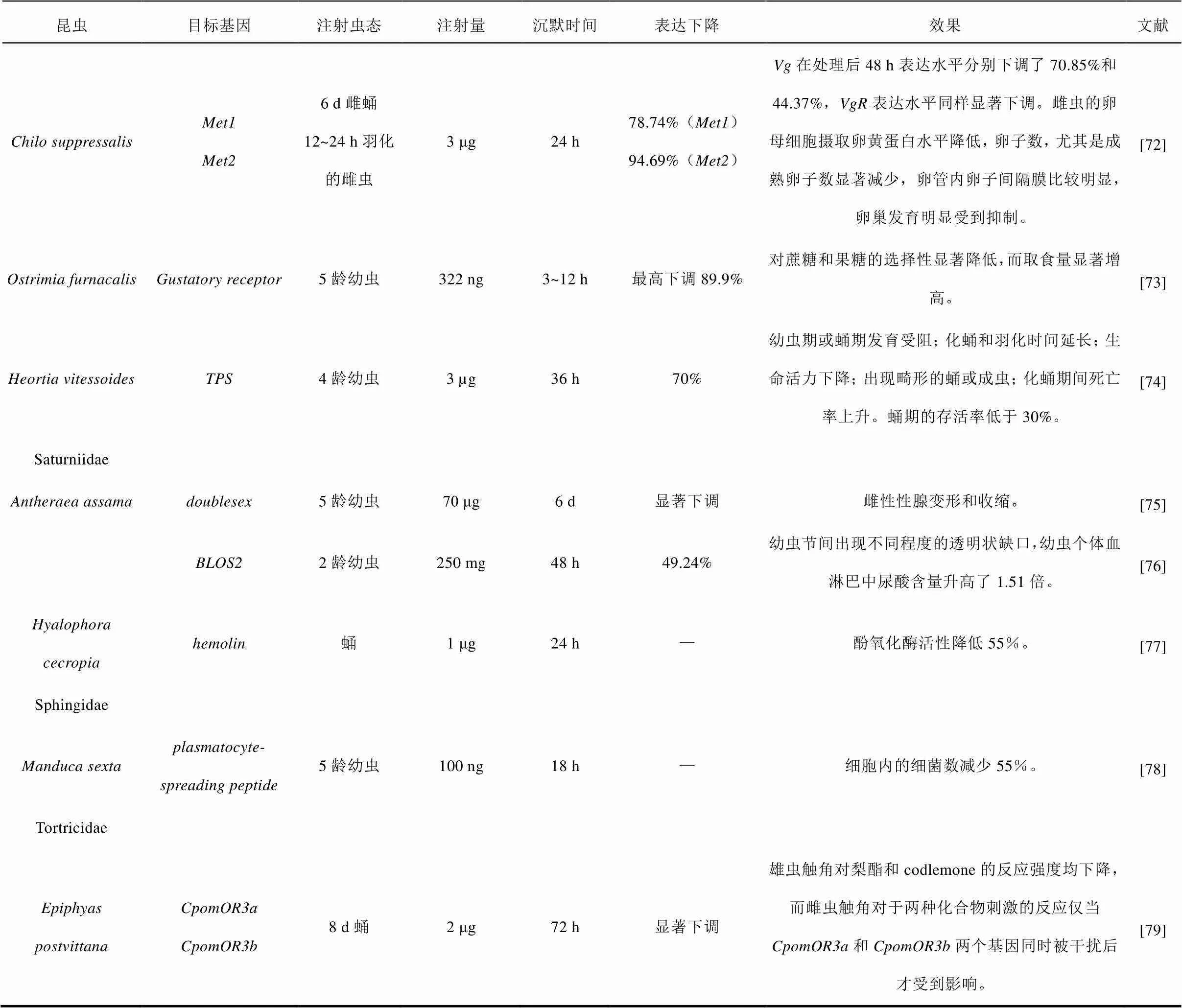
续表1 应用dsRNA微量注射法研究鳞翅目昆虫基因功能的实例
3 RNAi在鳞翅目昆虫基因功能分析中的应用
RNAi 技术目前已经成为分析鳞翅目昆虫基因功能广泛应用的工具。应用于阐明与鳞翅目昆虫生长发育相关的调控基因,为鳞翅目昆虫发育、生物学研究、分子调控机制研究奠定基础(表1和表2)。
Xiang等[80]通过RNAi研究了家蚕()节段性身体发育过程,发现同源异型复合体(homeotic complex,Hox)基因,和是家蚕幼虫节足发育的抑制器。Kontogiannatos等[81]通过RNAi研究玉米秸秆螟()发现保幼激素酯酶(juvenile hormone esterase,JHE)是控制昆虫从幼虫到成虫转变的重要调节因子。Shukla等[75]研究发现在柞蚕()中,的RNAi完全抑制了和基因的表达,导致不规则性腺分化现象。前人使用RNAi技术研究发现许多基因在昆虫胚胎发育以及卵黄生成素和信息素合成的调节中发挥作用。Wang等[82]在棉铃虫()中使用RNAi沉默3-羟基-3-甲基戊二酰辅酶A还原酶基因(3-hydroxy-3-methylglutaryl coenzyme,HMGR),证实基因影响棉铃虫雌虫的繁殖能力,有效降低了雌蛾的产卵量,同时抑制卵黄蛋白原的表达水平。Kotwica等[83]利用RNAi技术沉默非洲棉叶蛾()中的()基因发现雄虫的精子释放高峰期推迟12 h,证明基因具有调节精子昼夜释放节律的功能。Li等[84]使用RNAi技术研究斜纹夜蛾()的sex-peptide receptor(SPR)基因功能发现,基因在调节雌蛾交配行为和交配后的生理过程中起到重要作用。

表2 其他dsRNA导入方法在鳞翅目昆虫基因功能研究中的应用
4 RNAi在鳞翅目害虫防治中的应用
在RNAi被发现并开发出其基因沉默方法后不久,昆虫学家就开始研究将这项技术应用于害虫防治管理。RNAi可以沉默昆虫关键基因的表达导致昆虫发育停滞或死亡,使其成为一种有巨大发展潜力的害虫防治新策略。突破性进展是开发了表达双链RNA(dsRNA)的转基因玉米,以保护玉米根系免受鞘翅目昆虫西方玉米根虫()幼虫的取食造成的伤害[17]。之后Mao等[92]成功获得能够特异表达基因的dsRNA转基因棉花,给鳞翅目害虫棉铃虫()喂食该转基因植株发现棉铃虫幼虫对棉酚耐受下降,死亡率明显增高。目前目标基因鉴定速度的加快以及新dsRNA递送系统的不断发掘提高了RNAi技术在害虫防治中的使用频率。基于RNAi技术的害虫防治方法已经在7科16种鳞翅目害虫中开展(表3)。

表3 RNAi在鳞翅目害虫防治中的应用

续表3 RNAi在鳞翅目害虫防治中的应用
4.1 RNAi防治害虫原理
在害虫防治中使用RNAi的基本原理是将外源dsRNA导入目标昆虫的体内,沉默与昆虫发育和存活有重要关系的关键基因的表达,最终导致目标害虫发育停滞和死亡。外源dsRNA介导的RNAi过程包括4个步骤:(1)dsRNA通过跨膜通道介导的通路(transmembrane channel-mediated pathway)或内吞介导的通路(endocytosis-mediated pathway)进入到细胞内;(2)进入细胞的dsRNA被Dicer酶消化成小双链siRNAs;(3)siRNAs解开螺旋、引导链被装载到RNA诱导的沉默复合体(RISC)上;(4)该RISC通过引导链定向,以引导链互补性定位含有特定核苷酸序列的mRNA,然后结合到这些特定的mRNA序列,并最终阻止这些靶mRNA的翻译。
4.2 RNAi在鳞翅目害虫防治中的进展
4.2.1 取食dsRNA农药 用人工合成的乙酰胆碱酯酶基因的siRNA渗入到人工饲料中喂食棉铃虫()幼虫,可导致幼虫死亡率显著增高(增加了15%)、幼虫的生长受到抑制、蛹质量明显减少、成虫较容易产生畸形并且繁殖力显著降低(与对照相比降低58%~100%,取决于不同的siRNA浓度)[99]。在实验室试验中,将siRNA以3 μg/cm2的浓度均匀涂抹在卷心菜叶的一侧上并饲喂小菜蛾()幼虫,使幼虫死亡率显著升高(增加了65%)[97]。在田间试验中,在喷施了200 μg/mLsiRNA的甘蓝上放养小菜蛾幼虫,也导致幼虫死亡率显著升高(死亡率与对照相比增加了53.4%)[97]。
4.2.2 表达dsRNA的细菌 在鳞翅目昆虫中首先开发了重组共生菌表达dsRNA介导进行RNAi效应,2009年,Tian等[43]在甜菜夜蛾()中利用重组大肠杆菌(Escherichia coli)表达几丁质酶()基因的dsRNA,饲喂幼虫表达dsRNA的菌液进行RNAi,导致幼虫死亡率显著上升。将表达基因的热灭活转基因大肠杆菌饲喂给粘虫()幼虫5 d后,其死亡率约16%[107]。而将表达基因dsRNA的活体大肠杆菌喂食给粘虫幼虫5 d后,导致幼虫蜕皮受到抑制和40%的幼虫非正常死亡[108]。喂食小菜蛾()和棉铃虫()幼虫表达dsRNA的活体细菌直接导致幼虫蜕皮困难,幼虫死亡率高达50%,喂食成虫使雌虫的产卵量和卵的孵化率显著下降[103]。共生菌介导的RNAi在理论上具有双重特异性,一是dsRNA序列的特异性,二是寄主和共生菌协同进化的特异性。肠道共生菌能够持续生产靶向寄主特异基因dsRNA,从而诱导RNAi进行。因此,细菌介导的RNAi效应可以通过种群水平传播或者垂直传播途径实现鳞翅目害虫的种群的防治[123]。
4.2.3 表达dsRNA的转基因植物 可连续产生足够dsRNA的转基因植物被认为是RNAi介导害虫防治的最佳外源dsRNA导入方式。Mamta等[119]最近的一项研究表明,棉铃虫()幼虫取食表达几丁质酶基因dsRNA的转基因烟草和番茄导致幼虫死亡率显著增高。Zhang等[118]研究发现棉铃虫()幼虫取食表达基因的烟草死亡率高到70%。因其高效、便利和低成本的特性,使得表达dsRNA转基因植物介导RNAi体系在未来农业重要性害虫和病媒害虫防治领域中不可或缺,也为绿色环保的新型植物保护策略提供了新的思路。
4.2.4 通过表皮渗透介导的RNAi 通过浸泡介导的RNAi体系具有节省劳力同时可以应用于基因高通量筛选的优点,在防治多种农业重要性害虫中成功应用。Wang等[38]将表达糜蛋白酶样丝氨酸蛋白酶C3的dsRNA喷涂到亚洲玉米螟()幼虫体表,使其40%~50%的幼虫死亡,同时通过荧光标记确认dsRNA能够成功渗透表皮并在体腔内传导。
4.2.5 通过纳米粒子介导的RNAi 纳米粒子(Nanoparticles,NPs)包含阳离子聚合物、肽类、糖类、脂质和金属等大小为1~500 nm的分子。具有稳定性、可修饰性、生物降解性和对环境安全等特点,不仅可以作为分子载体促进dsRNA跨膜转运,还可以延缓dsRNA在昆虫消化系统中被极端PH以及各种核酸酶降解,提高细胞对dsRNA的吸收率,显著提高对RNAi有耐受性昆虫的干扰效率,特别是许多鳞翅目昆虫。Parsons等[112]研发的含胍阳离子聚甲基丙烯酸酯聚合物的纳米粒子可以保护dsRNA免受草地贪夜蛾()中肠核酸酶和极端PH的降解,提高细胞对基因dsRNA的摄入量,得到高效基因敲除的结果。表达基因dsRNA单独处理甜菜夜蛾()的死亡率只有16%,而聚合鸟苷酸纳米粒子与基因dsRNA混合溶液饲喂使其死亡率增加53%。另外,dsRNA聚合物纳米粒子复合体对甜菜夜蛾肠液耐受时间长达30 h[111]。绝大多数纳米粒子具有生物降解和生物相容性的优点,因此,通过纳米粒子介导的RNAi是一种环境友好型的害虫防治措施。
5 小结与展望
在昆虫中,RNAi 是一种对抗外源病毒的天然免疫方式,基于生物体中的这种内在机制而建立的 RNAi 技术已经被广泛用来研究多种昆虫基因的功能。近年的研究结果表明 RNAi 技术在抵御害虫和防治益虫疾病方面具有潜在的应用价值,有可能对农业有害生物的控制起到巨大的推动作用。
RNAi技术在鳞翅目昆虫分子生物学研究及病虫害防治领域同样得了到广泛应用并取得了前所未有的进展。但是,RNAi技术在鳞翅目昆虫中的应用同样存在着一些特别或共性的问题。首先,RNAi通常不能完全阻断靶基因的表达,不同靶标基因的干扰效果并不相同,不同部位组织的RNAi效率也不一致(表1~3)。其次,由于RNAi机制在鳞翅目昆虫中的特殊性,其RNAi效率与其他类群昆虫相比相对较低。
RNAi在病虫害防治应用方面也面临诸多问题,例如dsRNA的导入方法及可靠性和稳定性,防治效率与成本权衡问题,脱靶和非靶标效应问题等。对于dsRNA施用的稳定性问题,目前采用纳米材料包埋技术已经得到了较好的解决,但在成本控制方面又引入了新问题。目前认为较为可行并极具应用潜力的技术是细菌介导的RNAi及表达靶基因dsRNA的转基因作物,然而两者由于涉及细菌载体及转基因技术,可能存在生物安全问题,因此在应用上也存在诸多限制。此外,由于昆虫多具有较强的适应性和抗药性快速进化能力,许多害虫已经对一些抗性转基因作物产生抗性[7,124-125]。
尽管RNA干扰技术的效率和应用受到各种因素的制约,但不能否认该技术已经成为研究昆虫生长发育、生理和分子过程中强有力的科研工具。由于其环境友好、安全以及对非靶标昆虫影响小等优点,RNAi在害虫绿色防控方面也显现了巨大潜力。未来,随着该领域的不断发展和创新,RNAi技术仍将在基因功能等分子生物学研究领域发挥重要作用,并将进一步推进基于RNAi技术的害虫防治新策略的探索及应用。
[1] Lepidoptera taxome project draft proposals and information[EB/OL]. (2016-08-20) http://www.ucl.ac.uk/taxome/lepnos.html.
[2] EARLY R, MORENO P G, MURPHY S T, et al. Forecasting the global extent of invasion of the cereal pest, the fall armyworm[J]. NeoBiota, 2018, 40(40): 25-50.
[3] KEBEDE M, SHIMALIS T. Out-break, distribution and management of fall armyworm,(J. E. Smith) in Africa: the status and prospects[J]. American journal of agricultural research, 2019, 4(43): 1-16.
[4] 齐国君, 苏湘宁, 章玉苹, 等. 草地贪夜蛾监测预警与防控研究进展[J]. 广东农业科学, 2020, 47(12): 109-121.
[5] 孙晓玲, 陈成聪, 李宁, 等. 草地贪夜蛾有转移危害茶树的可能[J]. 茶叶科学, 2020, 40(1): 105-112.
[6] 林培炯, 张智, 王旭龙, 等. 2019年北京市延庆区草地贪夜蛾种群动态与虫源分析[J]. 植物保护学报, 2020, 47(4): 758-769.
[7] Arthropod pesticide resistance database[EB/OL]. (2021-05-18) http://www.pesticide-resistance.org/.
[8] ROGER D, PHIL A, MELANIE B, et al. Fall Armyworm: impacts and implications for Africa[J]. Outlooks on pest management, 2017, 28(5): 196-201.
[9] 秦誉嘉, 杨冬才, 康德琳, 等. 草地贪夜蛾对我国玉米产业的潜在经济损失评估[J]. 植物保护, 2020, 46(1): 69-73.
[10] 徐艳玲, 李昭原, 陈杰, 等. 草地贪夜蛾对我国小麦产业造成的潜在经济损失评估[J]. 植物保护学报, 2020, 47(4): 740-746.
[11] 徐进, 陈鹏. 地中海粉螟繁殖生物学研究[M]. 北京: 中国林业出版社, 2018.
[12] FIRE A, XU S, MONTGOMERY M K, et al. Potent and specific genetic interference by double-stranded RNA in[J]. Nature, 1998, 391(6669): 806-811.
[13] AGRAWAL N, DASARADHI P V N, MOHMMED A, et al. RNA interference: biology, mechanism, and applications[J]. Microbiology and molecular biology reviews, 2003, 67(4): 657-685.
[14] NANDETY R S, KUO Y W, NOURI S, et al. Emerging strategies for RNA interference(RNAi)applications in insects[J]. Bioengineered, 2015, 6(1): 8-19.
[15] SUZUKI T, NUNES M A, ESPANA M U, et al. RNAi-based reverse genetics in the chelicerate model: A comparative analysis of five methods for gene silencing[J]. PLoS one, 2017, 12(7): e0180654.
[16] BEN-AMAR A, DALDOUL S, REUSTLE G M, et al. Reverse genetics and high throughput sequencing methodologies for plant functional genomics[J]. Current genomics, 2016, 17(6): 460-475.
[17] BAUM J A, BOGAERT T, CLINTON W, et al. Control of coleopteran insect pests through RNA interference[J]. Nature biotechnology, 2007, 25(11): 1322-1326.
[18] ROSA C, KUO Y W, WURIYANGHAN H, et al. RNA interference mechanisms and applications in plant pathology[J]. Annual revew phytopathology, 2018, 56: 581-610.
[19] BETTENCOURT R, TERENIUS O, FAYE I. Hemolin gene silencing by dsRNA injected intopupae is lethal to next generation embryos[J]. Insect molecular biology, 2002, 11(3): 267-271.
[20] ZHOU R, HOTTA I, DENLI A M, et al. Comparative analysis of argonaute-dependent small RNA pathways in[J]. Molecular cell, 2008, 32(4): 592-599.
[21] MONDAL M, MANSFIELD K, FLYNT A. siRNAs and piRNAs collaborate for transposon control in the two-spotted spider mite[J]. RNA, 2018, 24(7): 899-907.
[22] CARTHEW R W, SONTHEIMER E J. Origins and mechanisms of miRNAs and siRNAs[J]. Cell, 2009, 136(4): 642-655.
[23] YLLA G, FROMM B, PIULACHS M D, et al. The microRNA toolkit of insects[J]. Scientific reports, 2016, 6: 37736.
[24] SIOMI H, SIOMI M. On the road to reading the RNA-interference code[J]. Nature, 2009, 457: 396-404.
[25] JOSE A M, HUNTER C P. Transport of sequence-specific RNA interference information between cells[J]. Annual review of genetics, 2007, 41: 305-330.
[26] HUVENNE H, SMAGGHE G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: a review[J]. Journal of insect physiology, 2010, 56(3): 227-235.
[27] SALEH M C, VAN RIJ R P, HEKELE A, et al. The endocytic pathway mediates cell entry of dsRNA to induce RNAi silencing[J]. Nature cell biology, 2006, 8: 793-802.
[28] BURAND J P, HUNTER W B. RNAi: Future in insect management[J]. Journal of invertebrate pathology, 2013, 112: S68-S74.
[29] JOGA M R, ZOTTI M J, SMAGGHE G, et al. RNAi efficiency, systemic properties, and novel delivery methods for pest insect control: what we know so far[J]. Frontiers in physiology, 2016, 7: 553.
[30] KENNERDELL J R, CARTHEW R W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway[J]. Cell, 1998, 95(7): 1017-1026.
[31] KOLLIOPOULOU A, SWEVERS L. Recent progress in RNAi research in Lepidoptera: intracellular machinery, antiviral immune response and prospects for insect pest control[J]. Current opinion in insect science, 2014, 6: 28-34.
[32] TERENIUS O, PAPANICOLAOU A, GARBUTT J S, et al. RNA interference in Lepidoptera: an overview of successful and unsuccessful studies and implications for experimental design[J]. Journal of insect physiology, 2011, 57(2): 231-245.
[33] TIMMON L, FIRE A. Specific interference by ingested dsRNA[J]. Nature, 1998, 395: 854.
[34] YU N, CHRISTIAENS O, LIU J S, et al. Delivery of dsRNA for RNAi in insects: an overview and future directions[J]. Insect science, 2013, 20(1): 4-14.
[35] TABARA H, GRISHOK A, MELLO C C. RNAi in: soaking in the genome sequence[J]. Science, 1998, 282: 430-431.
[36] LI S, FEI J J, CHENG D D, et al. Bioinformatics, tissue distribution, and subcellular localization analyses of FK506 binding protein 12B from silkworms[J]. Archives of insect biochemistry and physiology, 2016, 91(2): 109-123.
[37] ZHAO H M, YI X, HU Z, et al. RNAi-mediated knockdown of catalase causes cell cycle arrest in SL-1 cells and results in low survival rate of(Fabricius)[J]. PloS one, 2013, 8(3): e59527.
[38] WANG Y, ZHANG H, LI H, et al. Second-generation sequencing supply an effective way to screen RNAi targets in large scale for potential application in pest insect control[J]. PloS one, 2011, 6(4): e18644.
[39] WU F, WANG P Y, ZHAO Q L, et al. Mutation of agene,, is responsible for silkworm non-moulting in the 2nd instar mutant[J]. PloS one, 2016, 11(4): e0153549.
[40] KENNERDELL J R, CARTHEW R W.gene silencing inusing doublestranded RNA[J]. Nature biotechnology, 2000, 18(8): 896-898.
[41] DAI H, MA L, WANG J, et al. Knockdown ofgene with a binary UAS/GAL4 RNA interference system leads to lethal ecdysis deficiency in silkworm[J]. Acta biochimica Et biophysica Sinica, 2008, 40(9): 790-795.
[42] YANG G, LIU C, VASSEUR L, et al. Development of RNAi in insects and RNAi-based pest control [M]. Croatia: InTech Open Access Publisher, 2011: 27-38.
[43] TIAN H, PENG H, YAO Q, et al. Developmental control of a Lepidopteran pestby ingestion of bacteria expressing dsRNA of a non-midgut gene[J]. PloS One, 2009, 4(7): e6225.
[44] 肖蓓, 幸诗斯, 邓丹, 等. RNAi递送系统在害虫防治中的研究进展[J]. 应用昆虫学报, 2021, 58(4): 764-782.
[45] WAN X S, SHI M R, XU J, et al. Interference efficiency and effects of bacterium-mediated RNAi in the fall armyworm (Lepidoptera: Noctuidae)[J]. Journal of insect science, 2021, 21(5): 1-12.
[46] 杨广, 尤民生, 赵伊英, 等. 昆虫的RNA干扰[J]. 昆虫学报, 2009, 52(10): 1156-1162.
[47] 王越, 张苏芳, 徐瑶, 等. 美国白蛾基因的克隆、表达模式分析及其在幼虫中的功能验证[J]. 林业科学, 2019, 55(10): 48-56.
[48] 殷晶晶. 基于RNAi干扰美国白蛾神经肽F及其受体基因功能分析[D]. 哈尔滨: 东北林业大学, 2020.
[49] QIAN C, FU W W, WEI G Q, et al. Identification and expression analysis of vitellogenin receptor from the wild silkworm,[J]. Archives of insect biochemistry and physiology, 2015, 89(4): 181-192.
[50] OSANAI-FUTAHASHI M, TATEMATSU K, FUTAHASHI R, et al. Positional cloning of apink-eyed white egg locus reveals the major role of cardinal in ommochrome synthesis[J]. Heredity, 2016, 116(2): 135-145.
[51] 王倩倩. 沙棘木蠹蛾幼虫和基因的克隆表达及基因RNA干扰体系的构建[D]. 北京: 北京林业大学, 2020.
[52] MOHAMMED A M A, DIAB M R, ABD-ALLA S M M, et al. RNA interference-mediated knockdown ofgenes in pink bollworm()[J]. International journal of biology, pharmacy and allied sciences, 2015, 4(5): 2641-2660.
[53] 王建国. 舞毒蛾气味受体对CO2浓度变化响应机制[D]. 哈尔滨: 东北林业大学, 2021.
[54] 马静怡. 舞毒蛾神经肽参与生长发育和生殖调控研究[D]. 哈尔滨: 东北林业大学, 2021.
[55] ABRIEUX A, DEBERNARD S, MARIA A, et al. Involvement of the G-protein-coupled dopamine/ecdysteroid receptorin the behavioral response to sex pheromone in an insect[J]. PloS one, 2013, 8(9): e72785.
[56] YANG J, HAN Z J. Efficiency of different methods for dsRNA delivery in cotton bollworm ()[J]. Journal of integrative agriculture, 2014, 13(1): 115-123.
[57] ZHENG J C, YUE X R, KUANG W Q, et al.as a novel target in controlling the cotton bollworm,[J]. Pest management science, 2020, 76: 2233-2242.
[58] DONG K, SUN L, LIU J T, et al. RNAi-induced electrophysiological and behavioral changes reveal two pheromone binding proteins ofinvolved in the perception of the main sex pheromone component Z11-16:Ald[J]. Journal of chemical ecology, 2017, 43(2): 207-214.
[59] CHOI M Y, MEER R K V, COY M, et al. Phenotypic impacts ofRNA interference in an ant,, and a moth,[J]. Journal of insect physiology, 2012, 58(8): 1159-1165.
[60] 荆王辉. 鞣化激素对粘虫高密度幼虫抗菌肽基因表达及抗病能力的影响[D]. 扬州: 扬州大学, 2021.
[61] PARK Y, KIM Y. RNA interference of cadherin gene expression inreveals its significance as a specific Bt target[J]. Journal of invertebrate pathology, 2013, 114(3): 285-291.
[62] 张职显. 双链RNA介导的甜菜夜蛾基因沉默对甲氧虫酰肼与虱螨脲复配毒力的影响[D]. 北京: 中国农业科学院, 2021.
[63] HASSANIEN I T E, MEYERING-VOS M, HOFFMANN K H. RNA interference reveals allatotropin functioning in larvae and adults of(Lepidoptera, Noctuidae)[J]. Entomologia, 2014, 2: 56-64.
[64] 赵鹏. 斜纹夜蛾四条基因克隆和功能研究[D]. 武汉: 华中农业大学, 2020.
[65] WANG L, FANG Q, ZHU J Y, et al. Molecular cloning and functional study of calreticulin from a lepidopteran pest,[J]. Developmental and comparative immunology, 2012, 38(1): 55-65.
[66] 周雨晴. 茶尺蠖解毒相关基因的功能及其表达模式研究[D]. 乌鲁木齐: 新疆大学, 2020.
[67] 马培培. 小菜蛾与基因的克隆与功能分析[D]. 武汉: 华中农业大学, 2020.
[68] 胡晓汉, 田素芬, 林硕, 等. 小菜蛾活化蛋白激酶C受体1基因在变态发育调控中的作用[J]. 昆虫学报, 2021, 64(8): 887-896.
[69] KUMAR S, PARK J, KIM E, et al. Oxidative stress induced by chlorine dioxide as an insecticidal factor to the Indian meal moth,[J]. Pesticide biochemistry and physiology, 2015, 124: 48-59.
[70] 赵凤, 杜娟, 李尚伟, 等. 利用RNAi技术沉默稻纵卷叶螟膜结合型海藻糖酶基因[J]. 西南农业学报, 2020, 33(6): 1105-1112.
[71] VEERANA M, KUBERA A, NGERNSIRI L. Analysis of thegene of rice moth,stainton[J]. Archives of insect biochemistry and physiology, 2014, 87(3): 126-147.
[72] 缪丽君. 二化螟卵黄原蛋白受体和保幼激素受体基因克隆与RNAi沉默研究[D]. 扬州: 扬州大学, 2020.
[73] 李资聪. 黄野螟及其近缘种糖类味觉受体的功能研究[D]. 哈尔滨: 东北林业大学, 2021.
[74] 陈敬祥. 黄野螟海藻糖合成酶基因的克隆及功能研究[D]. 广州: 华南农业大学, 2018.
[75] SHUKLA J N, NAGARAJU J. Two female-specific DSX proteins are encoded by the sex-specific transcripts of dsx, and are required for female sexual differentiation in two wild silkmoth species,and(Lepidoptera, Saturniidae)[J]. Insect biochemistry and molecular biology, 2010, 40(9): 672-682.
[76] 马月月, 张耀亭, 段晓霞, 等. 柞蚕尿酸盐颗粒转运相关基因的表达特征及功能研究[J]. 蚕业科学, 2020, 46(3): 328-335.
[77] TERENIUS O, BETTENCOURT R, LEE S Y, et al. RNA interference of hemolin causes depletion of phenoloxidase activity in[J]. Developmental and comparative immunology, 2007, 31(6): 571-575.
[78] ELEFTHERIANOS I, XU M, YADI H, et al. Plasmatocyte-spreading peptide(PSP)plays a central role in insect cellular immune defenses against bacterial infection[J]. Journal of experimental biology, 2009, 212(12): 1840-1848.
[79] 黄聪. 基于基因组数据的苹果蠹蛾入侵性评估与化学感受机制研究[D]. 长沙: 湖南农业大学, 2019.
[80] XIANG H, LI M W, GUO J H, et al. Influence of RNAi knockdown forgenes on the silkworm proleg development[J]. Archives of insect biochemistry and physiology, 2011, 76(1): 1-11.
[81] KONTOGIANNATOS D, SWEVERS L, MAENAKA K, et al. Functional characterization of a juvenile hormone esterase related gene in the moththrough RNA interference[J]. PloS one, 2013, 8(9): e73834.
[82] WANG Z J, DONG Y C, DESNEUX N, et al. RNAi silencing of thereductase gene inhibits oviposition in thecotton bollworm[J]. Plos one, 2013, 8(7): e67732.
[83] KOTWICA J, BEBAS P, GVAKHARIA B O, et al. RNA interference of the period gene affects the rhythm of sperm release in moths[J]. Journal of biological rhythms, 2009, 24(1): 25-34.
[84] LI C, YU J F, LU Q, et al. Molecular characterization and functional analysis of a putative sex-peptide receptor in the tobacco cutworm(Fabricius, 1775) (Lepidoptera: Noctuidae)[J]. Austral entomology, 2014, 53(4): 424-431.
[85] YANG Y L, ZHU Y C, OTTEA J, et al. Molecular characterization and RNA interference of three midgut aminopeptidase N isozymes fromand -resistant strains of sugarcane borer,[J]. Insect biochemistry and molecular biology, 2010, 40(8): 592-603.
[86] KHAJURIA C, BUSCHMAN L L, CHEN M S, et al. A gut-specificgene essential for regulation of chitin content of peritrophic matrix and growth oflarvae[J]. Insect biochemistry and molecular biology, 2010, 40(8): 621-629.
[87] DI LELIO I, VARRICCHIO P, DI PRISCO G, et al. Functional analysis of an immune gene ofby RNAi[J]. Journal of insect physiology, 2014, 64: 90-97.
[88] WEN N, CHEN J, CHEN G, et al. The overexpression of insect endogenous microRNA in transgenic rice inhibits the pupation ofand[J]. Pest management science, 2021, 77(9): 3990-3999.
[89] BURKE W G, KAPLANOGLU E, KOLOTILIN I, et al. RNA interference in the tobacco hornworm,, using plastid-encoded long double-stranded RNA[J]. Front plant science, 2019, 10: 313.
[90] 冯博. 卵黄原蛋白及其受体在斜纹夜蛾繁殖过程中的功能探究[D]. 昆明: 云南大学, 2020.
[91] WANG X F, CHEN Z, WANG X B, et al. Bacterial-mediated RNAi and functional analysis of Natalisin in a moth[J]. Scientific reports, 2021, 11(1): 4662.
[92] MAO Y B, TAO X Y, XUE X Y, et al. Cotton plants expressingdouble-stranded RNA show enhanced resistance to bollworms[J]. Transgenic research, 2011, 20(3): 665-673.
[93] ZHANG Y, ZHANG Y, FU M, et al. RNA interference to control asian corn borer using dsRNA from a novelgene of(Lepidoptera: Crambidae)[J]. Journal of insect science, 2018, 18(5): 1-9.
[94] WANG J D, GU L Q, IRELAND S, et al. Phenotypic screen for RNAi effects in the codling moth[J]. Gene, 2015, 572(2): 184-190.
[95] ELLANGO R, ASOKAN R, CHANDRA G S, et al. Tyrosine hydroxylase, a potential target for the RNAi-mediated management of diamondback moth(Lepidoptera: Plutellidae)[J]. Florida entomologist, 2018, 101(1): 1-5.
[96] MOHAMED A A M, KIM Y. A target-specific feeding toxicity of β1 integrin dsRNA against diamondback moth,[J]. Archives of insect biochemistry and physiology, 2011, 78(4): 216-230.
[97] GONG L, CHEN Y, HU Z, et al. Testing insecticidal activity of novel chemically synthesized siRNA againstunder laboratory and field conditions[J]. PloS one, 2013, 8(5): e62990.
[98] WHYARD S, SINGH A D, WONG S. Ingested double-stranded RNAs can act as species-specific insecticides[J]. Insect biochemistry and molecular biology, 2009, 39(11): 824-832.
[99] KUMAR M, GUPTA G P, RAJAM M V. Silencing ofgene ofby siRNA affects larval growth and its life cycle[J]. Journal of insect physiology, 2009, 55(3): 273-278.
[100] CHOI M Y, VANDER MEER R K. Phenotypic effects ofRNAi using oral delivery of dsRNA to corn earworm(Lepidoptera: Noctuidae)and tobacco budworm larvae[J]. Journal of economic entomology, 2019, 112(1): 434-439.
[101] LI H, JIANG W, ZHANG Z, et al. Transcriptome analysis and screening for potential target genes for RNAi-mediated pest control of the beet armyworm,[J]. PLoS one, 2013, 8(6): e65931.
[102] 杨付来. 甜菜夜蛾调控喜树碱诱导的氧化胁迫和细胞凋亡机制研究[D]. 北京:中国农业科学院, 2020.
[103] ISRANI B, RAJAM M V. Silencing ofr, insect intestinalandgenes by bacterially produced double-stranded RNA affects larval growth and development inand[J]. Insect molecular biology, 2017, 26(2): 164-180.
[104] QI X L, SU X F, LU G Q, et al. The effect of silencing arginine kinase by RNAi on the larval development of[J]. Bulletin of entomological research, 2015, 105(5): 555-565.
[105] ZHANG X, LIU X, MA J, et al. Silencing of cytochrome P450gene of cotton bollworm()by RNAi[J]. Bulletin of entomological research, 2013, 103(5): 584-591.
[106] YOGINDRAN S, RAJAM M V. Artificial miRNA-mediated silencing of ecdysone receptor()affects larval development and oogenesis in[J]. Insect biochemistry and molecular biology, 2016, 77: 21-30.
[107] GANBAATAR O, CAO B, ZHANG Y, et al. Knockdown ofgenes via bacterial expression and oral delivery of RNAi effectors[J]. BMC Biotechnol, 2017, 17(1): 9.
[108] WANG J D, WANG Y R, WANG Y Z, et al. RNA interference of tubulin genes has lethal effects in[J]. Gene, 2018, 670: 1-6.
[109] HE B, CHU Y, YIN M, et al. Fluorescent nanoparticle delivered dsRNA toward genetic control of insect pests[J]. Advanled materials, 2013, 25(33): 4580-4.
[110] WANG K, PENG Y, CHEN J, et al. Comparison of efficacy of RNAi mediated by various nanoparticles in the rice striped stem borer()[J]. Pesticide biochemistry and physiology, 2020, 165: 104467.
[111] CHRISTIAENS O, TARDAJOS M G, MARTINEZ REYNA Z L, et al. Increased RNAi efficacy invia the formulation of dsRNA with guanylated polymers[J]. Frontiers in physiology, 2018, 9: 316.
[112] PARSONS K H, MONDAL M H, MCCORMICK C L, et al. Guanidinium-functionalized interpolyelectrolyte complexes enabling RNAi in resistant insect pests[J]. Biomacromolecules, 2018, 19(4): 1111-1117.
[113] WANG Z, LI T, NI H, et al. Transgenic soybean plants expressingdsRNA exhibit enhanced resistance to the soybean pod borerLepidoptera: Olethreutidae)[J]. Archives of insect biochemistry and physiology, 2018, 98(2): e21461.
[114] 孙庚晓. dsRNA甘蓝的构建及其对小菜蛾的抗性[D]. 福州: 福建农林大学, 2020.
[115] HE K, XIAO H, SUN Y, et al. Transgenicrice shows high resistance to rice stem borer[J]. Plant Biotechnol J, 2019, 17(2): 461-471.
[116] ZHENG X, WENG Z, LI H, et al. Transgenic rice overexpressing insect endogenous microRNAis resistant to striped stem borer under field conditions[J]. Plant biotechnology journal, 2021, 19(3): 421-423.
[117] KOLA V S R, RENUKA P, PADMAKUMARI A P, et al. Silencing ofandgenes affects the growth and development of rice yellow stem borer,[J]. Frontiers in physiology, 2016, 7: 20.
[118] ZHANG J, KHAN S A, HECKEL D G, et al. Next-generation insect-resistant plants: RNAi-mediated crop protection[J]. Trends in biotechnology, 2017, 35(9): 871-882.
[119] MAMTA, REDDY K R K, RAJAM M V. Targetinggene ofby host-induced RNA interference confers insect resistance in tobacco and tomato[J]. Plant molecular biology, 2016, 90(3): 281-292.
[120] 崔可佳. 玉米介导RNAi技术沉默粘虫基因的有效性研究[D]. 临汾: 山西师范大学, 2020.
[121] 代丽华. 玉米介导RNAi技术沉默粘虫基因的有效性研究[D]. 临汾: 山西师范大学, 2020.
[122] 包文化. 基于PTA技术的抗虫转基因玉米的培育及玉米黏虫的RNAi机理研究[D]. 呼和浩特: 内蒙古大学, 2021.
[123] ZHU K Y, PALLI S R. Mechanisms, applications, and challenges of insect RNA interference[J]. Annual review of entomology, 2020, 65: 293-311.
[124] BURTET L M, BERNARDI O, MELO A A, et al. Managing fall armyworm,(Lepidoptera: Noctuidae), with Bt maize and insecticides in southern Brazil[J]. Pest management science, 2017, 73(12): 2569-2577.
[125] 李永平, 张帅, 王晓军, 等.草地贪夜蛾抗药性现状及化学防治策略[J]. 植物保护, 2019, 45(4): 14-19.
The Mechanism and Application of RNA Interference in Lepidopteran Insects
ZHANG Qiulang1, LIU Jianhong1, XU Jin1,2*, YE Hui3*
(1. Yunnan Academy of Biodiversity, Southwest Forestry University, Kunming 650224, China; 2. Key Laboratory of Ministry of Education for Forest Resources Conservation and Utilization in the Southwest Mountains of China, Southwest Forestry University, Kunming 650224, China; 3. School of Ecology and Environment, Yunnan University, Kunming 650091, China)
Lepidoptera is the second largest order in the class of Insecta. About 180 000 species of Lepidoptera have been recorded so far. Lepidopteran insects mostly feed on plants, and many of its members are important global agricultural pests. Many Lepidopteran pests have the characteristics of rapid reproduction, heavy damage, strong resistance to pesticides and long-distance migration, which pose a huge threat to agricultural production. RNA interference (RNAi) technology refers to a molecular technology that introduces target gene-specific homologous double-stranded RNA (dsRNA) into cells to cause specific degradation of the homologous mRNA, thereby achieving target gene expression silencing. At present, this technology has been widely used in the study of the gene function of Lepidopteran insects and the exploration of green pest control strategies, which has achieved remarkable progress in recent years. Based on this, this article summarized the mechanism of RNAi in insects, and then reviewed and discussed the recent progress on gene function study and control strategy exploration in Lepidopteran insects by using RNAi techniques, which may contribute to scientific research and pest management related to Lepidopteran insects.
Lepidoptera; RNA interference; gene function; pest control
Q965
A
2095-3704(2021)04-0363-16
张秋朗, 刘建宏, 徐进, 等. RNA干扰在鳞翅目昆虫中的应用研究进展[J]. 生物灾害科学, 2021, 44(4): 363-378.
2021-10-19
2021-11-08
云南省重点领域科技计划项目(202001BB050002)、云南省农业基础研究联合专项重点项目(2018FG001-002)和国家自然科学基金项目(31760635)
张秋朗(1996—),女,硕士生,主要从事农林昆虫学研究,qiulangzhang@126.com;
通信作者:徐进,研究员,博士,博士生导师,xujin2798@126.com;叶辉,教授,博士,博士生导师,huiye196@163.com。
