氨曲南及其注射剂无菌检查方法适用性试验
2022-01-11傅莉萍王朝丽
傅莉萍,王朝丽,李 婷,张 平*
(1.上海市松江食品药品检验所微生物检验室,上海 201600;2.海口市制药厂有限公司,海口 570311;3.上海美迪西生物医药有限公司,上海 200120)
氨曲南是单酰胺环类的新型β-内酰胺类抗菌药,通过抑制细菌细胞壁的合成发挥杀菌作用,对G-杆菌细胞膜上的青霉素结合蛋白(penicillin-binding protein,PBP)-3有高度亲和力,从而导致细胞溶解、死亡。氨曲南的抗菌谱主要为G-菌,临床主要用于敏感需氧G-菌所致感染[1]。制剂的无菌性是临床安全用药的重要保障,无菌检查法是保障无菌制剂安全性的重要方法[2]。方法适用性试验是考察所采用的方法是否适用于该产品的无菌检查,以避免对检查结果的误判[3]。抗生素类品种无菌检查结果准确与否的关键是无菌检查过程中对其抑菌性的有效消除[4]。本研究采用增加薄膜过滤法冲洗量,并在培养基中添加青霉素酶的方法,通过3个批次独立的方法适用性试验,为氨曲南及其注射剂建立了一种准确、高效的无菌检查方法。
1 材 料
1.1 仪器和菌种 C级背景局部A级的净化工作台、MLS-3781L-PC高压蒸汽灭菌锅(日本Panasonic公司);PL402-L电子天平(梅特勒-托力多公司);KS12生物安全柜(Thermo公司);BD400微生物培养箱(德国Binder公司);HTY-602A集菌仪、KDGB330/NKF330集菌培养器(浙江泰林生物技术股份有限公司)。金黄色葡萄球菌[CMCC(B)26003]、生孢梭菌[CMCC(B)64941]、大肠杆菌[CMCC(B)44102]、枯草芽孢杆菌[CMCC(B)63501]、白念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]标准质控菌株均购自浙江泰林生物技术股份有限公司,菌种使用前均经鉴定,确认合格。
1.2 试剂和药品 pH 7.0无菌氯化钠-蛋白胨缓冲液、硫乙醇酸盐流体培养基、胰酪大豆胨液体培养基、胰酪大豆胨琼脂培养基、沙氏葡萄糖琼脂培养基、哥伦比亚琼脂培养基(北京三药科技开发公司);精氨酸(分析纯,上海麦克林生化科技有限公司);氯化钠(分析纯,上海凌峰化学试剂公司)。以上试剂使用前均经无菌性检查和灵敏度检查,确认合格。青霉素酶[规格:>300万单位/ml×5 ml,阿拉丁试剂(上海)有限公司]。氨曲南原料药(批号SS06042001001、SS06042001002、SS06042001003,重庆天地药业有限责任公司);注射用氨曲南(规格:0.5 g,批号09200222、09200223、09200224,海口市制药厂有限公司)。
2 方法和结果
2.1 薄膜过滤法 取每种培养基规定接种的供试品总量,用薄膜过滤法过滤,冲洗,在最后一次的冲洗液中加入<100 CFU试验菌,加硫乙醇酸盐流体培养基或胰酪大豆胨液体培养基至滤筒内。另取一个装有等体积培养基的容器,加入等量试验菌,作为对照。置规定温度培养,培养时间不得超过5 d。其余试验菌采用同法操作。
2.2 菌液的制备 根据菌种说明书,分别取1支金黄色葡萄球菌、生孢梭菌、大肠杆菌、枯草芽孢杆菌、白念珠菌、黑曲霉(浓度均为110~1100 CFU/pcs)的标准菌株,用2.2 ml生理盐水涡旋振荡溶解,作为工作用菌悬液。使用时取0.1 ml加入过滤器,使最终制备的供试品液中含菌落数≤100 CFU。
2.3 供试品溶液的制备 (1)氨曲南原料药:按《中华人民共和国药典》(以下简称中国药典)四部通则1101,出厂检验抗生素固体原料药≥5 g,取6个容器,每个容器供试品接入每种培养基的最少量0.5 g,即做方法适用性试验时每种培养基接入的供试品总量为6×0.5 g=3 g。在A级环境下称取9 g氨曲南原料药作为三联罐集菌器的用量,加2.34%精氨酸无菌溶液200 ml使溶解,可以每次3 g,分次称取,分次加入2.34%精氨酸无菌溶液,使总溶剂体积为200 ml。(2)注射用氨曲南:按中国药典四部通则1101,注射剂出厂检验批产量>500支,接种每种培养基的最少检验数量为20支。300 mg≤固体制剂≤5 g,每支供试品接入每种培养基的最少量是150 mg,即方法适用性试验时每种培养基接入的样品总量为20支×0.15 g/支=3 g,即注射用氨曲南的用量。取18支注射用氨曲南作为三联罐集菌器的用量,每支分别加0.9%氯化钠无菌溶液溶解,并稀释成氨曲南浓度为90 mg/ml的溶液。
2.4 方法适用性试验 以氨曲南原料药(批号SS06042001001)作为试验组研究对象, 按表1设计无菌检查方法适用性试验。
2.4.1 试验组(氨曲南原料药) 取1套三联罐集菌器,用少量的pH 7.0无菌氯化钠-蛋白胨缓冲液润湿滤膜,取200 ml供试品溶液平均滤入三联罐集菌器中(相当于每罐含氨曲南3 g),用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,每张滤膜每次冲洗量为 100 ml。根据试验方案设计的冲洗量冲洗滤膜,在最后一次冲洗液中分别加入<100 CFU的金黄色葡萄球菌、大肠杆菌、生孢梭菌的菌悬液。每个集菌器中注入100 ml硫乙醇酸盐流体培养基,每个集菌器中加入试验方案设计的中和剂溶液。同法制备胰酪大豆胨液体培养基集菌器罐,分别加入<100 CFU的枯草芽孢杆菌、白念珠菌和黑曲霉的菌悬液。
2.4.2 试验组(注射用氨曲南) 取18支注射用氨曲南,每支分别加0.9%氯化钠无菌溶液溶解并稀释成含氨曲南90 mg/ml的供试品溶液。取1套三联罐集菌器,用少量的pH 7.0无菌氯化钠-蛋白胨缓冲液润湿滤膜,将18支供试品溶液平均滤入三联罐集菌器中(相当于每罐含氨曲南3 g),用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,每张滤膜每次冲洗量为 100 ml。根据试验方案设计的冲洗量冲洗滤膜,在最后一次冲洗液中分别加入<100 CFU的金黄色葡萄球菌、大肠杆菌、生孢梭菌的菌悬液。每个集菌器中注入100 ml硫乙醇酸盐流体培养基,每个集菌器中加入试验方案设计的中和剂溶液。同法制备胰酪大豆胨液体培养基集菌器罐,分别加入<100 CFU的枯草芽孢杆菌、白念珠菌和黑曲霉的菌悬液。
2.4.3 菌液对照组 以0.9%氯化钠无菌溶液替代供试品溶液,按照试验组(注射用氨曲南)操作,不加中和剂,6个集菌器分别加入6种试验菌。
2.4.4 中和剂对照组 以0.9%氯化钠无菌溶液替代供试品溶液,按照试验组(氨曲南原料药)操作,加入中和剂溶液,6个集菌器分别加入6种试验菌。
2.4.5 供试品对照组 取制备好的供试品溶液(三联罐集菌器每罐含氨曲南3 g),以0.9%氯化钠无菌溶液代替试验菌液,其余操作与试验组(氨曲南原料药)相同,加入中和剂溶液。
2.4.6 阴性对照组 以0.9%氯化钠无菌溶液替代供试品溶液,按照试验组(氨曲南原料药)操作,不加中和剂,不加试验菌液。将上述硫乙醇酸盐流体培养基集菌器置30~35 ℃培养箱中培养,胰酪大豆胨液体培养基集菌器置20~25 ℃的培养箱培养,培养时长不得超过5 d。
2.5 方法适用性试验
2.5.1 菌落计数结果 取金黄色葡萄球菌、大肠杆菌、生孢梭菌、枯草芽孢杆菌、白念珠菌和黑曲霉工作用菌悬液0.1 ml置平皿中,分别加入适量琼脂培养基,在适宜的温度培养后,菌落计数均<100 CFU。菌落计数结果见表2。
表2 菌落计数结果Table 2 Colony count results
2.5.2 试验方法确认 以氨曲南原料药(批号SS06042001001)作为试验组研究对象,5种方案试验结果见表3。以青霉素酶作为中和剂,只有方案5中的6种试验菌在5 d之内均生长良好。最终确认以方案5作为氨曲南无菌检查方法,即以600万单位青霉素酶作为中和剂,用800 ml冲洗液冲洗。

表3 5种试验方案的测定结果Table 3 Results of the five test schemes
2.5.3 方法适用性试验结果 取3批氨曲南原料药(批号SS06042001001、SS06042001002、SS06042001003),分别进行3次方法适用性试验,结果见表4。3批供试品试验组、中和剂对照组与阳性对照组比较,6种试验菌均生长良好,并且与菌液对照组的培养结果相似,说明供试品在该检验条件下抑菌作用完全消除,并且以青霉素酶作为中和剂对6种试验菌的生长无影响,可按该法进行氨曲南原料药的无菌检查。
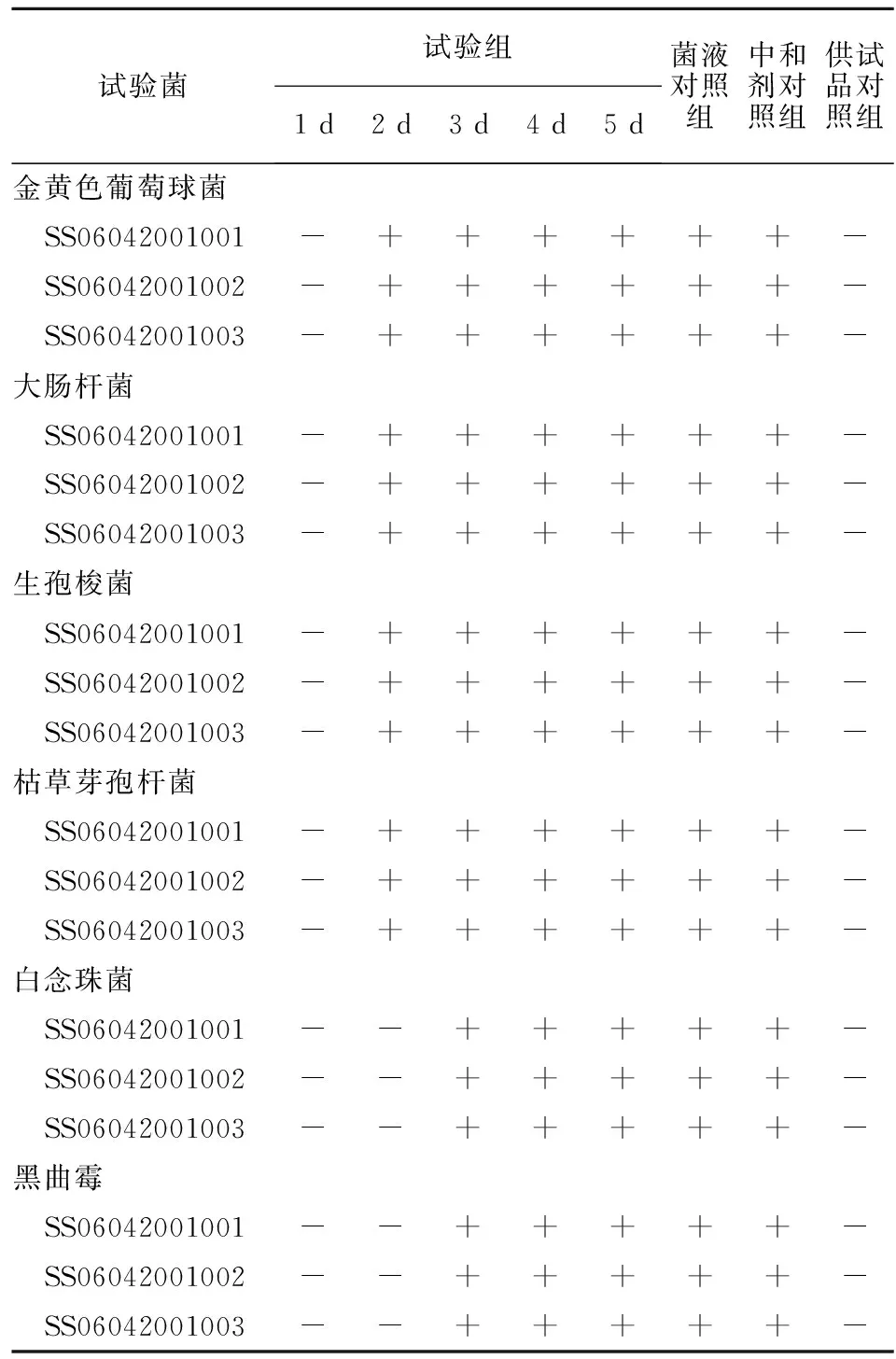
表4 氨曲南原料药无菌检查方法适用性试验结果Table 4 Results of applicability of the sterility test for aztreonam material
取3批注射用氨曲南(批号09200222、09200223、09200224),分别进行3次方法适用性试验,结果见表5。3批供试品试验组、中和剂对照组与阳性对照组比较,6种试验菌均生长良好,并且与菌液对照组的培养结果相似,说明供试品在该检验条件下抑菌作用完全消除,并且以青霉素酶作为中和剂对6种试验菌的生长无影响,可按该法进行注射用氨曲南的无菌检查。

表5 注射用氨曲南方法适用性试验结果Table 5 Results of applicability of sterility test for aztreonam for injection
2.6 建立无菌检查方法 取氨曲南原料药9 g, 加200 ml的2.34%精氨酸无菌溶液使溶解,经薄膜过滤法处理,用pH 7.0无菌氯化钠-蛋白胨缓冲液分次冲洗(每膜冲洗量800 ml),每管培养基中加入≥600万单位的青霉素酶,以大肠杆菌为阳性对照菌,依法检查,应符合规定。取适量注射用氨曲南,加0.9%氯化钠无菌溶液溶解并稀释成含氨曲南90 mg/ml的溶液,按照氨曲南项下的方法检查,结果符合规定。
3 讨 论
中国药典氨曲南项下规定[5],氨曲南为微溶于水的白色至淡黄色结晶性粉末,无菌检查时取9 g溶于100 ml的2.34%精氨酸溶液中。为了保证本品的溶解度和溶解速度,在氨曲南中加入一定比例精氨酸,可以起到促进氨曲南溶解和稳定的作用。本研究实际操作过程中发现,100 ml的2.34%精氨酸溶液很难溶解9 g氨曲南,且放置后氨曲南易发生氧化反应,产生杂质,使溶液变红,无法采用薄膜过滤法进行无菌检查。中国药典2020年版四部通则1101无菌检查法规定[6],无菌检查法包括薄膜过滤法和直接接种法,只要供试品性质允许,应采用薄膜过滤法。薄膜过滤法在药品无菌检查中应用越来越广泛,是无菌检查的首选方法[7]。本研究摸索了溶解氨曲南溶剂的量,最终确定采用分步称量,将200 ml的2.34%精氨酸溶液逐步加入,既能快速、完全溶解9 g氨曲南,防止氨曲南被氧化,又可以使用最小的溶剂量,加快薄膜过滤法的过滤速度,提高工作效率。
《中国药典分析检测技术指南》[8]指出,方法适用性试验的供试品用量可以是指接种到培养基中所需的检验量,而不一定要取满足供试品的检验数量。所以在制备供试品过程中,氨曲南原料药和注射用氨曲南取样量采用满足检验量的要求,但检验数量不做要求。在药品无菌检查中,对抑菌性供试品可以使用适宜的中和剂消除抑菌成分,使用的中和剂不应与培养基发生反应,不应改变培养基原有性状,不应对结果判断产生影响[9]。本研究在摸索无菌检查方法过程中,采用600万单位青霉素酶作为中和剂,中和剂对照组的菌种与阳性对照组的菌种一样生长良好,表明600万单位青霉素酶能满足作为中和剂的要求。研究报道[10],氨曲南无菌检查法采用薄膜过滤法结合添加青霉素酶作为中和剂,但本研究中因样本和试剂耗材来源的不同,采用500 ml冲洗量无法实现大肠杆菌的回收。滤膜对药物的吸附性起着关键的作用,过滤抗生素应尽量选择低吸附性的滤器和滤膜[8]。本研究采用浙江泰林生物技术股份有限公司提供的KDGB330、NKF330一次性封闭式集菌培养器,采用尼龙膜材质滤膜,适用于强抑菌性的抗生素药液。
本研究采用的无菌检查用培养基均通过技术验证,根据中国药典[12]要求,进行培养基适用性试验,包括无菌检查和灵敏度检查,并根据供试品特性选择阳性对照菌,对抗G-菌为主的供试品应以大肠杆菌为对照菌。同时,《中国药典分析检测技术指南》[8]规定,若检验程序或产品发生变化可能影响检验结果时,应重新进行方法适用性试验。产品的适用性试验除规定的情况外,还应建立定期再确认的制度,对所选方法和所用条件进行挑战性试验来确认,以防止未觉察的影响因素对无菌检查结果的干扰。本产品可以选择最敏感的大肠杆菌作为再确认的试验菌,并在后续生产过程中累积数据,通过长期跟踪维持或改进工艺,保证产品质量[11]。
