中药调控免疫系统治疗动脉粥样硬化研究进展
2022-01-08张丹丹韩汶润董鹏志
张丹丹 ,韩汶润,朱 彦,董鹏志
(1.天津中医药大学组分中药国家重点实验室,天津 301608;2.天津国际生物医药联合研究院中药新药研发中心,天津 300457)
动脉粥样硬化(atherosclerosis,AS)是引起缺血性心、脑血管及周围血管疾病的主要病理基础,其主要特点为内皮损伤释放黏附分子,触发由单核-巨噬细胞主导的先天免疫反应,继而树突状细胞(dendritic cells,DC)、巨噬细胞呈递抗原引起由淋巴细胞所主导的适应性免疫反应。AS发病的炎症机制是基于AS病变中发现有大量的免疫活性细胞,如先天性免疫细胞(单核细胞、巨噬细胞和DC等)、适应性免疫细胞(T细胞和B细胞等)及其产生的多种细胞因子,如白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor,TNF)、干扰素(interferon,IFN)、转化生长因子(transforming growth factor,TGF)、集落刺激因子(colony stimu⁃lating factor,CSF)和各种趋化因子[1]。其中促炎细胞因子如TNF-α、IL-1β、趋化因子CCL2〔也称为单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)〕、IL-6、IL-1、IL-12和Ⅰ型IFN(IFN-γ,β)等加速AS的进展;而抗炎细胞因子如IL-10、TGF-β、精氨酸酶 1(arginase-1,Arg-1)、叉头或翼状螺旋转录因子3(forkhead or winged helix transcription factor-3,FOXP3)和IL-5等改善AS发展。此外,免疫细胞分泌的抗体,如免疫球蛋白E(immunoglobulin E,IgE)、IgG和IgM等特异性结合相关抗原,如热休克蛋白(heat shock protein,HSP)和氧化低密度脂蛋白(oxidized low-density lipoprotein,oxLDL),也发挥免疫调节作用。
已有研究表明,免疫系统和炎症反应对AS发生发展的各个阶段均有显著影响[2]。AS迄今还不能仅通过药物治疗来逆转,因此有必要从免疫调节角度去制定新的策略,以减轻这种引起心血管相关疾病的病理过程[3]。目前中医研究认为,AS是多种因素共同作用引起的一种痰瘀毒互结证。将现代医学的免疫调控机制与中医学的痰瘀毒发病机制相结合,对疾病进行整体调节的防治策略逐渐受到重视。现代研究表明,大量中药具有调节免疫反应的作用,其中一部分中药干预AS后,取得了较好的疗效。本文综述各类免疫细胞在AS发病机制中的研究进展和中药及其成分干预免疫调节治疗AS的现状,以期为心血管疾病的基础研究及治疗提供新的思路。
1 免疫系统与动脉粥样硬化
免疫反应包括先天性免疫反应和适应性免疫反应。在AS病理过程中,先天性免疫反应开始于血管壁内皮细胞(endothelial cells,EC)的激活,导致单核细胞分化、巨噬细胞活化释放炎症因子[4]。随后,抗原呈递细胞(antigen presenting cells,APC)如DC,将一系列潜在抗原呈递给效应T和(或)B淋巴细胞后,适应性免疫反应迅速发生。
先天性免疫反应是免疫反应的第一道防线,也是特异性免疫反应的基础,主要发挥清除受损和凋亡细胞、抗原呈递、免疫抑制和保护宿主免受外来微生物侵害的作用[5]。其中单核细胞和巨噬细胞是炎症和先天性免疫反应的关键效应因子和调节因子[6]。DC启动和调节高度病原体特异性的适应性免疫反应,是免疫记忆和耐受性发展的中心[7];T和(或)B淋巴细胞识别呈递的抗原,释放抗体,主导适应性免疫反应的发生。
1.1 单核细胞
AS发病起始于低密度脂蛋白(low-density lipoprotein,LDL)通过载脂蛋白B(apolipoprotein B,Apo B)与蛋白聚糖结合穿透内皮屏障,沉积在内皮下间隙的细胞外基质中。内皮下LDL被血管细胞氧化后可刺激EC和血管平滑肌细胞(vascular smooth muscle cells,VSMC)产生MCP-1和巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)。MCP-1通过化学趋化因子受体2(cc chemokine receptors 2,CCR2)促进单核细胞的迁移和浸润[6],而单核细胞通过单核细胞集落刺激因子(granulocyte macrophage colony-stimulating factor,GM-CSF)介质分化为含有清道夫受体簇36(scavenger receptor cluster 36,CD36)、清道夫受体(scavenger receptor,SR)、凝集素样oxLDL受体1(lectin-like oxldl receptor-1,LOX-1)、Toll样受体(Toll-like receptor,TLR)的巨噬细胞和DC。单核细胞通过感知自身所在的环境来清除病原体和死亡细胞,同时启动适应性免疫反应并提供巨噬细胞和DC的祖细胞来源[8]。
1.2 巨噬细胞
在过去的20年里,巨噬细胞被认为是AS及其并发症的主要参与者,在AS的所有阶段发挥不同作用,同时也是斑块中最丰富的炎症细胞类型。单核细胞分化为细胞表面表达SR(CD36、SR-A1)和LOX-1等的巨噬细胞。修饰过的脂蛋白与SR相互作用,巨噬细胞被激活并摄取oxLDL,最终导致泡沫细胞的形成[9]。
巨噬细胞除数量众多,其可塑性和异质性也决定了其在AS免疫反应中占据非常重要的地位。巨噬细胞可依据其所处微环境改变自身表型从而发挥相应作用。巨噬细胞主要分为2大类:经典激活表型(M1)巨噬细胞和选择性激活表型(M2)巨噬细胞。在不稳定斑块中,M1巨噬细胞占比高于M2巨噬细胞;而在稳定斑块中,M2巨噬细胞占比高于M1[10]。如IFN-γ和TLR配体,在脂多糖(lipopoly⁃saccharide,LPS)的刺激下,巨噬细胞极化为M1表型,其特征是分泌高水平的IL-1β,IL-6和TNF-α等促炎因子,表达促炎转录因子,从而产生大量一氧化氮和活性氧,诱导泡沫细胞凋亡和线粒体功能障碍[11]。综上,M1型巨噬细胞可以促进、维持炎症反应,因而被认为具有促AS的作用[12]。相反,Ⅱ型T辅助细胞(typeⅡT helper cells,Th2)因子IL-4和IL-13使巨噬细胞极化为M2表型。M2巨噬细胞表达IL-10,TGF-β和Arg-1等高水平的抗炎因子,平衡M1巨噬细胞的活性,下调炎症反应,启动组织修复,促进组织重塑和血管生成,并表现出吞噬活性以控制炎症反应,发挥抗AS的作用。
1.3 树突状细胞
DC是一种特殊APC,作为先天和适应性免疫反应之间的联系枢纽发挥重要作用。在多数外周组织中,DC处于不成熟状态,其主要功能为捕获抗原,分泌细胞因子;成熟过程是在炎症刺激下触发的,DC通过表达SR(LOX-1,CD36和CD205)促进oxLDL摄取,激活NF-κB通路,并分化为能够释放促炎性细胞因子的DC[5]。一旦斑块中的oxLDL激活DC,它们就会转移到次级淋巴器官,充当APC的角色[13]。成熟后,DC表现出较低的抗原捕获和摄取能力,但抗原呈递能力增强,主要组织相容性复合体Ⅱ(histocompatibility complex class MHC-Ⅱ)和T细胞共刺激分子如CD40,CD80和CD86的表面表达增加。MHC-Ⅱ分子与其捕获加工的抗原结合,形成肽-MHC分子复合物,并递呈给T细胞,从而启动MHC-Ⅱ类限制性的Th1细胞反应。同时,DC还通过其高表达的共刺激分子提供T细胞活化所必须的第二信号,启动适应性免疫应答[14]。另外,成熟DC分泌胶原酶和基质金属蛋白酶(matrix metalloproteinase,MMP),可促进胶原和细胞外基质降解,导致纤维帽变薄,形成易损斑块表型。综上,DC在AS中的作用可以概括为诱导趋化因子和细胞因子分泌、抗原的呈递以及脂质的摄取,这些可能引发炎症或促进免疫耐受性[15]。
1.4 T细胞
T细胞是AS斑块中仅次于巨噬细胞的第二大免疫细胞群。患有AS的小鼠样本中CD4+T细胞数量显著多于CD8+T细胞。Naive CD4+T细胞主要分化为2类效应亚群:Th细胞(Th1,Th2和Th17等)和调节性T细胞(T regulatory cells,Treg细胞)[16-17](表 1)。
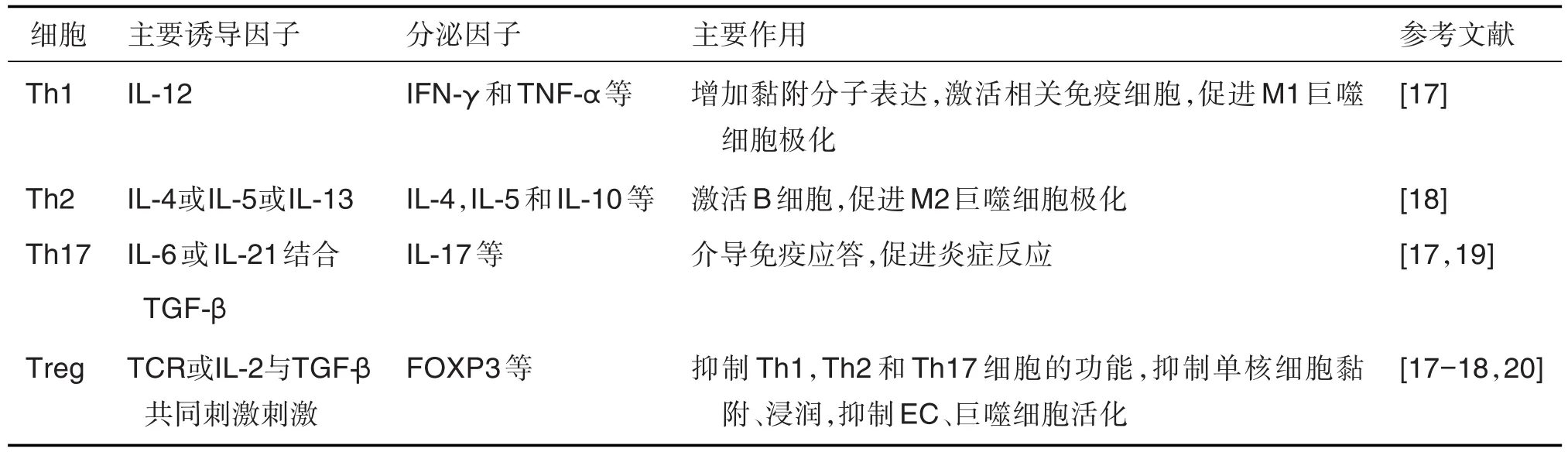
表1 各类T细胞在动脉粥样硬化(AS)中的作用

表2 B细胞抗体的分类及作用
AS中T细胞的主要表型是Th1细胞,巨噬细胞和DC将抗原呈递给T细胞可激活T细胞。M1巨噬细胞释放IL-12诱导T细胞产生Th1型免疫反应,使T细胞分化为Th1细胞,Th1细胞分泌IFN-γ和TNF-α[17]。IFN-γ 可激活单核细胞、巨噬细胞和DC,导致Th1反应的延续;诱导巨噬细胞极化成M1型巨噬细胞;增加巨噬细胞SR-A的表达,从而促进oxLDL的蓄积和泡沫细胞的形成,促进AS的发展。M2型巨噬细胞可诱导T细胞分化为Th2细胞。Th2细胞分泌IL-4,IL-5,IL-10和IL-13等细胞因子,激活B细胞产生抗体,还可以促进巨噬细胞极化为M2巨噬细胞[18]。但有研究表明,IL-4通过作用于EC,增加促炎介质如细胞因子、趋化因子和黏附分子的表达而增强T细胞与EC的黏附聚集,诱导炎症反应。可见,Th2细胞在AS中的作用仍有争议。Th17细胞是由IL-6或IL-21(结合TGF-β)刺激T细胞分化而成,可产生IL-17,IL-22和IL-23,招募中性粒细胞,并介导对细胞外细菌和真菌的免疫应答[19]。但Th17细胞对AS的具体作用仍不清楚[17]。
Treg细胞包括胸腺衍生Treg(thymus derived T regulatory cells,tTreg)细胞和外周衍生 Treg(peripheral derived T regulatory cells,pTreg)细胞。tTreg细胞是通过接受较强的TCR刺激而产生,进而诱导FOXP3的表达[17-18]。另外,pTreg是在IL-2和TGF-β共同刺激下产生,IL-2诱导转录激活因子5(transcriptional activator-5,STAT5)激活FOXP3。FOXP3可抑制Th1,Th2和Th17细胞的功能。FOXP3+Treg细胞的免疫抑制作用可抑制单核细胞黏附于动脉EC表面,从而阻断其向内皮下间隙的浸润。Treg细胞还能抑制EC和巨噬细胞的活化,阻断斑块中修饰的自身抗原以减少AS病变形成[20]。
1.5 B细胞
B细胞通过细胞间接触、抗原呈递和细胞因子的产生来控制细胞免疫反应,从而参与AS的全身和局部免疫反应[21]。B细胞表达表面抗体或B细胞受体,是产生抗体的浆细胞的来源[22]。
B细胞主要分为B1细胞和B2细胞2大类。B1细胞是不经感染或免疫而产生的天然抗体的主要来源,主要分泌天然性IgM抗体,能够识别凋亡细胞表面和oxLDL的抗原决定因子,抑制巨噬细胞吞噬oxLDL,减缓泡沫细胞的形成从而抑制AS的发展[23-24]。相比之下,B2细胞介导对T细胞依赖抗原的应答,产生对抗原具有良好特异性的适应性IgG类抗体以及IgE抗体:①oxLDL特异性IgG抗体可以通过Fcγ受体(Fc gamma receptor,FcγR)参与激活巨噬细胞,从而促进AS的发生,但也可能表现出保护性中和能力;②HSP60特异性IgG能识别应激EC,并通过抗体依赖性细胞毒性诱导内皮损伤;③IgE抗体通过FcγR接触激活肥大细胞和巨噬细胞,导致AS斑块不稳定。实验中载脂蛋白E缺陷(ApoE-/-)小鼠条件性敲除B2细胞可减少AS形成。相反,移植B2细胞可增强AS,这表明B2细胞具有促AS作用[24]。
2 中药治疗动脉粥样硬化的机制
中医学理论中无AS这一病理过程概念,根据其病理变化和临床表现多将其归于“瘀证”“脉痹”“中风”“胸痹”和“坏疽”等病证的范畴[25]。AS是在络气郁滞或虚滞久病不愈基础上继发“浊、痰、瘀、毒”引起脉道不利,脏腑功能失调,是多种因素共同作用的结果。因此,选用单一作用靶点药物很难取得满意疗效[26],中药“整体调控”的特点可能更加适用于AS的治疗。近年来,对预防和治疗心脑血管疾病的中药进一步分析发现其中大多数都具有抑制免疫反应的潜能[27]。目前针对免疫细胞的治疗主要有:①减少趋化因子和黏附因子释放,抑制单核细胞黏附聚集;②降低SR的表达,从而抑制巨噬细胞摄取oxLDL,抑制泡沫细胞形成、调节脂质代谢;③调节炎症因子释放,改善血管微环境,调节巨噬细胞极化状态;④减少DC数量抑制DC的成熟,可降低抗原呈递能力和炎症因子释放;⑤调节淋巴细胞比例,增加Treg细胞、B1细胞的占比,恢复免疫平衡。总结相关文献中所报道的中药对AS进展中各类免疫细胞功能性的影响,有助于挖掘中药干预免疫调节的潜力并应用于临床实践。
2.1 抑制单核细胞黏附聚集
内皮功能障碍是AS发展的起点,内皮损伤释放黏附因子和趋化因子,进而引起单核细胞黏附、聚集、分化,促进细胞向血管内膜迁移,参与AS斑块的形成。这一生物学机制与中医中的有关血瘀气滞病机相关内容的论述类似。所以化瘀祛痰通络可能是干预AS发展的首要途径[28-29],如三七和川芎等,再配合一些益气活血、清热解毒中药,如丹参和柴胡等,以去毒邪、畅通血脉,进而改善炎症病变和脂质沉积。
中药作用于单核细胞治疗AS的主要生物学机制有:①防止内皮受损;②减少炎症因子的释放;③抑制单核细胞黏附聚集以及浸润分化。柴胡皂苷通过调控细胞外调节蛋白激酶和p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)或者氨基末端激酶和p38 MAPK信号通路抑制ox⁃LDL诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)损伤[30]。另外,人参皂苷Re和Rg1水解产生的代谢产物人参皂苷F1(ginsenoside F1,GF1)以剂量依赖性方式改善oxLDL诱导的EC损伤[31]。GF1通过A20依赖途径抑制EC NF-κB磷酸化,从而下调NF-κB活性,增加EC活力,减缓AS的发展。在H2O2损伤HUVEC模型中,灯盏花素可降低活性氧(reactive oxygen,ROS)水平,增强抗氧化酶活性。灯盏花素通过抗氧化作用在体外抑制氧化应激诱导的血管内皮功能障碍和EC损伤,并在体内预防AS形成[32]。此外,Fu等[33]发现oxLDL诱导的HUVEC经三七皂苷R1预处理后可抑制其凋亡、迁移的能力,降低MCP-1和细胞间黏附因子(intercellular adhesion molecule 1,ICAM-1)的过度生成。丹参中2种亲脂性成分丹参酮ⅡA(tanshinoneⅡA,TanⅡA)和隐丹参酮(cryptotanshinone,CTS)都已被证明通过保护内皮功能,减少炎症因子释放,达到治疗AS的效果。如赵东等[34]发现,TanⅡA对MAPK和晚期糖基化终末产物的多配体受体信号激活有抑制作用从而下调血管细胞黏附因子(vascular cell adhesion molecule-1,VCAM-1),ICAM-1,MMP-2,MMP-3和MMP-9的表达水平,减缓纤维帽变薄的速度稳定斑块。Ahmad等[35]研究发现CTS显著降低TNF-α诱导的EC通透性、单核细胞可溶性ICAM-1,VCAM-1和MCP-1的表达,并恢复一氧化氮的生成,表明CTS具有抗炎特性,可以预防细胞因子诱导的早期AS。Hsueh等[36]发现,黄酮的主要成分柚皮苷能够剂量依赖性地抑制TNF-α诱导的VCAM-1,ICAM-1和e-选择素的mRNA和蛋白表达,抑制THP-1单核细胞对TNF-α刺激的HUVEC的黏附。柚皮苷还能降低TNF-α诱导的CX3CL1,MCP-1等趋化因子的mRNA和蛋白水平,表明柚皮苷通过抑制细胞黏附分子和趋化因子的表达,发挥抗AS作用。Lee等[37]发现牛蒡子根提取物可以降低TNF-α诱导的血管内皮单核细胞浸润和小鼠主动脉中炎症细胞因子(包括IL-1β,IL-6,TNF-α和MCP-1)编码基因的表达水平,表明牛蒡子根提取物直接或间接地改变炎症因子的表达,减少白细胞向血管内皮的浸润,起到治疗AS的作用。
2.2 抑制泡沫细胞形成,调节脂质代谢
巨噬细胞膜上表达多种与oxLDL结合的SR。SR与oxLDL结合后,巨噬细胞可有效将其摄取,从而加速胆固醇的蓄积。如来自oxLDL颗粒内化的胆固醇不能从巨噬细胞中充分消除,它就会以胆固醇酯或细胞质胆固醇晶体的形式蓄积,最终使巨噬细胞转化为泡沫细胞,这是AS发展的标志事件[38]。益气活血药可使机体气血旺盛,脉络复通[39],改善脂质沉积,从而抑制泡沫细胞的形成,这些中药有活血药丹参、红花、当归、川芎,益气药黄芪、人参和白术等,以及益气活血中药复方丹蒌方、桂枝汤和丹红注射液等。基于这一事实,通过抑制巨噬细胞与oxLDL的结合,减少氧化应激和泡沫细胞的形成,以达到减少脂质沉积的目的。槲皮素可以改善oxLDL诱导的脂质沉积和ROS过剩,并阻断LOX-1的表达,从而减少泡沫细胞的形成[40]。另外,虾青素通过淬灭单线态氧和清除自由基来发挥其强大的抗氧化活性;同时,虾青素可抑制LDL氧化和增加高密度脂蛋白胆固醇和脂联素水平。越来越多的实验结果表明,虾青素可能通过改善氧化应激、炎症、脂质代谢和糖代谢来预防AS性心血管疾病[41]。二氢丹参酮I和刺芒柄花素则通过减少SR-A1的表达,抑制巨噬细胞摄取oxLDL。二氢丹参酮Ⅰ主要作用机制为调控TLR4/烟酰胺腺嘌呤二核苷酸磷酸氧化酶/NF-κB通路,抑制LPS诱导的EC LOX-1表达,从而抑制LOX-1介导的oxLDL的内吞作用和EC与单核细胞的黏附作用,减轻ApoE-/-小鼠的AS形成[42]。刺芒柄花素通过增加kruppel样因子4表达和核易位抑制SR-A1的表达,从而减少EC和单核细胞之间的结合,抑制巨噬细胞和VSMC来源的泡沫细胞形成[43]。黄芪甲苷联合阿托伐他汀可显著降低血浆脂质含量和oxLDL,其主要作用机制为抑制NF-κB,CD36,MMP-9,ICAM-1,VCAM-1和p-P38的表达水平,同时上调过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)表达。这些表明黄芪甲苷联合阿托伐他汀能够抑制巨噬细胞摄取oxLDL,具有减少泡沫细胞形成的潜能[44]。除了上述中药单体成分外,中药复方如丹蒌方和丹红注射液等同样具有抑制泡沫细胞形成的功效。丹蒌方化痰散结、活血化瘀,在小鼠巨噬细胞RAW264.7经oxLDL诱导成泡沫细胞模型中,丹蒌方乙醇提取物可抑制TLR4和SR-B1的蛋白和mRNA表达,降低oxLDL摄取和脂质沉积,从而减轻oxLDL诱导的巨噬细胞向泡沫细胞转化[45]。周明学等[46]发现,由丹参和红花组成的丹红注射液通过激活磷脂酰肌醇胰岛素信号通路,减少巨噬细胞脂质蓄积。袁晓雯等[47]发现,桂枝汤能够降低炎症性单核细胞比例以及单核细胞表面TLR4和CD36的表达,从而抑制巨噬细胞吞噬脂质转变为泡沫细胞。另外,泽泻和白术组成的泽泻汤能够显著下调IL-1β、TNF-α和IL-6mRNA表达,从而抑制巨噬细胞泡沫化过程中的脂质沉积,并通过下调NF-κB下游的一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶2(cyclooxygenase-2,COX-2)的表达,减轻局部炎症反应[48]。景虎通脉方及红景天苷可能通过抑制CD36和CD204的表达,减少oxLDL与巨噬细胞膜上CD36和CD204的结合,抑制脂质摄取,减少巨噬细胞向泡沫细胞转化,最终减少了斑块的形成[49]。
另外,巨噬细胞转变为泡沫细胞及其凋亡也被认为是影响AS发展的关键因素,所以保护巨噬细胞免于凋亡是治疗AS的一种新策略。已有研究证实:木犀草素可通过促进自噬减弱泡沫细胞形成和巨噬细胞凋亡干预AS[50]。在oxLDL诱导RAW264.7巨噬细胞的体外泡沫细胞模型中,Cao等[51]发现,槲皮素可阻断蛋白激酶MST1的表达,增加LC3-Ⅱ/Ⅰ和Beclin1表达,减少脂质蓄积,降低细胞衰老表型,表明槲皮素抗AS可能与上调RAW264.7巨噬细胞介导的MST1自噬有关。
2.3 调控巨噬细胞极化
巨噬细胞在AS的形成过程中表现出高度的异质性。巨噬细胞受斑块内微环境以及细胞因子刺激后表现出不同的极化状态。不同的巨噬细胞表型也在AS斑块的发展和消退中起着不同的调节作用。有理由认为调节巨噬细胞极化和控制斑块的表型比例将是一种有效的新方法。以往研究中,具有清热解毒功效的中药,如栀子、人参、番红花、通心络和补阳还五汤等,外加活血、补气通络药如穿心莲等,共同发挥药效起到调节炎症因子释放,改善血管微环境的作用。郑进等[52]在AS新西兰兔中发现,栀子苷可能通过FOS/MAPK信号通路,降低iNOS mRNA和蛋白的表达以及IL-1β的分泌,显著增加Arg-1 mRNA和蛋白表达以及IL-10的分泌。以上结果说明,栀子苷防治AS作用机制可能与巨噬细胞表型变化相关。此外,陈逸飞等[53]报道,通心络可以抑制巨噬细胞向M1极化而表现出抗炎作用。人参皂苷Rg3是人参的主要活性成分之一,此前有报道其为PPARγ的天然配体[54]。最近研究发现,在糖尿病AS小鼠模型,人参皂苷20(S)-Rg3通过PPARγ依赖机制促进巨噬细胞向M2型转化,并在糖尿病并发AS的预防和治疗中发挥作用。Rb1增强IL-4和(或)IL-13和STAT6磷酸化,进而调控抗炎M2巨噬细胞极化来增加AS斑块的稳定性[55]。此外,补阳还五汤通过调控M1/M2巨噬细胞极化枢纽丙酮酸激酶与缺氧诱导因子1α的蛋白表达水平及其下游糖酵解酶的表达而调节M1/M2巨噬细胞极化平衡,使巨噬细胞分化偏向M2表型,达到抗炎、促进斑块稳定、延缓AS进展的作用[56]。李静等[57]发现,番红花通过促进M2巨噬细胞极化并可能通过抑制NF-κB P65核移位来抑制维生素D3诱导的大鼠冠状动脉粥样硬化模型中的脂肪生成并减轻炎症。经木犀草素处理的巨噬细胞可抑制NLRP3炎症小体激活并增强了M2巨噬细胞标志物(Arg-1和IL-10)的表达,降低与M1巨噬细胞极化相关的标志物(TNF-α,IL-6和iNOS)的表达,表明木犀草素通过调节巨噬细胞表型极化来调节先天性和适应性免疫应答,在AS的治疗中发挥作用[58]。
2.4 调节树突状细胞功能
关于DC在冠状动脉疾病中对AS的发展是促进还是抑制作用仍存在争议。但有研究表明,减少DC数量及抑制DC成熟,可降低其抗原呈递能力和相关炎症因子的表达,提示减少DC数量、抑制DC成熟也可能成为治疗AS的突破点。如槲皮素能够降低DC表面标志物CD80,CD86,MHC-Ⅱ,IL-6和IL-12的表达,其作用机制可能是通过上调结构域抗体抑制DC成熟,进而下调Src/PI3K/Akt-NF-κB炎症通路,表明槲皮素通过调节DC的成熟来抑制AS病变中的炎症反应,从而发挥抗AS作用[59]。李莹等[60]以正常人外周血单核细胞为研究对象,将其诱导成未成熟的DC,在高糖培养条件下,DC中促炎细胞因子IL-6和IL-12的表达升高,导致DC成熟以及ROS的生成增加,从而诱导DC p38 MAPK的过度活化,促进DC摄取oxLDL并促进AS发展。而薯蓣皂苷与DC孵育后抑制ROS的产生并部分抑制了SR,CD36和LOX-1基因的上调,部分逆转p38 MAPK蛋白的上调。此外,薯蓣皂苷还能逆转高糖饮食引起的DC IL-6和IL-12分泌增加、IL-10分泌减少的趋势,推测薯蓣皂苷抑制DC的成熟,并减少对oxLDL的摄取,从而减缓AS的发展。另外,芍药苷可以增加IL-10和TGF-β分泌,减少IL-12和共刺激分子的表达,抑制小鼠骨髓源性DC的成熟和免疫刺激功能[61]。最近有实验表明,在AS背景下,通过特异性敲除髓样分化因子(myeloid differentia⁃tion factor,MyD)88(Cd11cCre+MyD88fl/fl)来阻断DC的成熟,降低DC向T细胞呈递抗原和激活T细胞的能力,从而导致病变中效应T细胞(Teff)和Treg细胞的激活受阻,最终抑制AS病变的发展。丹皮酚亦可通过降低TLR7/8信号通路中的MyD88和TLR8蛋白,抑制DC的成熟和激活,达到治疗炎症性疾病的作用[62]。
2.5 调节淋巴细胞功能
淋巴细胞是由骨髓造血干细胞分化而来。肾主骨生髓,中医常采用补肾益肺健脾法调节机体免疫状态。另外,活血通络、清热凉血润燥可调节机体阴阳平衡,使得免疫系统恢复正常。如玄参滋阴降火调理肾经,雷公藤杀虫解毒,活血通络归肾经;杏仁益肺;黄芪、甘草、当归补肺脾之气;赤芍、地龙、川芎、牛黄等清热平肝。
特定的T细胞亚群对AS的发生产生不同(保护或促进)的作用。在AS中,Th1细胞的促AS作用和Treg细胞的动脉保护特性现在已被广泛接受。然而,Th2和Th17细胞对于AS的作用仍有争议。CD4+T细胞的亚群具有显著多样性,表明其尚未最终分化,因而可根据局部微环境变化进行功能和表型切换。紫草素(shikonin,SKN)是一种具有抗炎活性的天然萘醌,已有实验证明其具有心脏保护作用[63]。最近的研究表明,在高同型半胱氨酸血症加速诱导的AS动物模型中,SKN治疗后斑块中CD4+T细胞的数量减少,并降低了脾CD4+T细胞IFN-γ的分泌,从而抑制巨噬细胞极化至促炎状态。表明SKN通过降低CD4+T细胞炎症活化来减轻AS。生物学机制研究表明促炎细胞和Treg之间的失衡会导致AS。因而通过调控Treg细胞活性来恢复免疫系统平衡对预防心血管疾病具有很好的应用前景。提高Treg细胞比例,增强Treg细胞的免疫抑制能力,可作为治疗AS性心血管疾病的基础免疫治疗手段[20]。吕建珍等[64]将携带FOXP3shRNA 的慢病毒注入ApoE-/-小鼠体内,杏仁苷处理后对FOXP3的mRNA和蛋白水平进行测定,显示杏仁苷处理的小鼠Treg细胞数量增加。实验表明,杏仁苷通过抑制炎症反应和促进Treg细胞的免疫调节功能来调控AS的形成和稳定斑块。另外,补阳还五汤可以增加ApoE-/-AS小鼠脾和外周血中Treg细胞的数量,增加CD4+T细胞中Treg细胞的比例,并调节炎症因子的水平。补阳还五汤还能增加体内与Treg细胞分化途径相关的TGF-β和Smad2 mRNA和蛋白水平。在体外模型中,补阳还五汤提高了FOXP3、TGF-β和Smad2的mRNA水平[65]。综上,补阳还五汤可恢复CD4+T细胞之间的免疫平衡,调节脂质代谢,抑制了炎症反应,因而能增强AS斑块的稳定性。《神医秘传》中著名的中药配方四妙勇安汤通过抑制单核细胞和巨噬细胞的分化和募集,增加Treg细胞的比例,进而减少促炎因子的分泌,改善与AS相关的病理变化,并可抑制西式饮食诱导的ApoE-/-小鼠脂质沉积[66]。
Th17/Treg平衡在自身免疫性和炎症性疾病中发挥重要作用。范庆红等[67]发现安宫牛黄丸(Angong Niuhuang Pill,ANP)降低Th17细胞和转录因子RORγt的表达水平,增加Treg细胞和转录因子FOXP3的表达水平,证明ANP通过调节Th17/Treg平衡,抑制慢性炎症,减少斑块胶原纤维,减少炎症细胞浸润,对高脂饮食诱导的ApoE-/-小鼠早期和中期AS模型具有抑制作用。蛇藤总黄酮预处理细胞,降低刀豆蛋白A(Con A)刺激下Th17细胞百分比和转录因子RORγt水平。蛇藤总黄酮预处理在抑制Th17细胞的同时,显著抑制Con A刺激下Treg细胞水平和转录因子FOXP3的表达,维持活化淋巴细胞中Treg/Th17的平衡[68]。用黄芪、丹参、三七和降香油组成的芪参益气丸(Qishen Yiqi droplet,QSYQ)喂食ApoE-/-小鼠可抑制CD36的表达,促进FOXP3的表达,降低IL-17a的表达[69]。表明QSYQ通过调节AS病变中Treg的功能,抑制斑块和脾中的辅助性Th17细胞,促进肝胆固醇排泄,因而具有抗AS作用。
B细胞在AS中的功能最初是由Caligiuri和他的同事发现[70]。研究人员在对ApoE-/-小鼠进行脾B细胞移植的脾切除术时发现,这一操作加重了AS发展,而通过移植脾细胞逆转了这一症状。与此相一致,相关研究表明,与高胆固醇饮食喂养的野生型骨髓重组小鼠相比,B细胞缺陷的野生型骨髓重组小鼠的AS斑块形成更为明显,表明B细胞具有整体的保护作用。中药柴银颗粒可显著增加T淋巴细胞和总B淋巴细胞百分比,减少炎症因子的表达,从而发挥免疫调节作用[71]。Han等[72]发现,三萜皂苷可通过减少Treg细胞数量,增加B细胞、自然杀伤细胞、CD3+T细胞和CD28+T细胞数量,并减少NF-κB、COX-2和微体前列腺素E合成酶1等炎症因子的分泌来诱导抗肿瘤免疫应答。
虽然有研究表明B细胞对免疫性疾病具有保护作用,但最近的数据对这一观点提出了挑战。利妥昔单抗是一种针对CD20(B细胞表面标志物)的单克隆抗体,导致的B细胞衰竭对自身免疫缺陷患者产生有益作用,抗CD20介导的B细胞损耗在ApoE-/-和Ldlr-/-小鼠中显著减小了AS斑块面积;研究证明,这是由于B细胞亚群具有强烈特异性作用,如体内抗CD20治疗在给药后数小时内优先消耗B2细胞[73-74]。另外,在 Tin 等[75]的研究中,CD20抗体消耗B细胞阻止了随后的IgG在AS斑块中的蓄积和心肌梗死诱导的AS加速形成,这是由于B2细胞在CD20抗体治疗中有效消耗,而B1细胞数量基本保持不变,进而引发B细胞减少,但其病变却出现缓解的现象[24]。基于B淋巴细胞对AS的确切作用尚未定论,因而突显出针对不同B细胞亚群干预的必要性[76]。扩大B1细胞范围和增加天然IgM可能具有有益的抗AS作用,B2细胞耗尽疗法同样可能具有抗AS作用,由此逐渐形成基于增加B1细胞数量或损耗B2细胞数量作为抗AS新的治疗策略。雷公藤甲素(triptolide)可显著降低血清TNF-α和IL-6等细胞因子水平,而IL-6的生物学功能是促进B淋巴细胞增殖和分化。提示雷公藤甲素可能通过抑制B淋巴细胞的数目来抑制免疫反应[77]。另外,二氢青蒿素(dihydroartemisinim,DHA)是青蒿素的衍生物,可增加辅助T细胞和CD8+T细胞的比例,减少脾和循环B细胞的数量。此外,DHA可以减少促炎细胞因子的产生[78]。研究表明,除了抗寄生虫活性外,青蒿素及其衍生物还可以调节免疫系统。郭冉等[79]发现,沉香中提取的苯乙基色酮衍生物GYF-21可轻度抑制由IgM,抗CD40和IL-4联合作用所诱导的B细胞存活、活化和增殖,而对抗CD40和IL-4联合作用诱导的B细胞分化有微弱促进作用。此外,苯乙基色酮衍生物GYF-21强烈抑制B细胞活化因子刺激的B细胞的存活、活化、增殖和分化,表明苯乙基色酮衍生物GYF-21可导致B2细胞凋亡,小幅度升高B1细胞的比例,即可达到治疗自身免疫性疾病的功效。
3 结语
在AS发病过程中,免疫细胞活化具体表现为单核细胞黏附聚集、泡沫细胞形成、M1/M2巨噬细胞分化、DC成熟与淋巴细胞分化等。多项研究表明,免疫细胞的活化是作为脂质代谢、炎症和免疫反应等复杂机制的一部分,在AS中起着重要作用。中药主要是从防止内皮受损,抑制单核细胞迁移、聚集和黏附,调节巨噬细胞脂质代谢、自噬和氧化应激,抑制M1巨噬细胞极化或促进M2巨噬细胞极化,减少DC的数目、抑制DC成熟,减少Th1细胞比例、调节Th17/Treg平衡、减少B2或增加B1细胞数目等几个方面防治AS。其中益气活血、化瘀祛痰通络、清热解毒类中药当为首选,这与AS的病理变化和临床表现相关。AS是在络气郁滞或虚滞久病不愈基础上继发“浊、痰、瘀、毒”进而引起脉道不利、脏腑功能失调。益气活血、化瘀祛痰类中药可使机体气足载血、布津有力,进而改善单核细胞巨噬细胞聚集、脂质沉积等病理现象;辅以清热解毒类中药去毒邪,改善血管微环境,调节巨噬细胞极化、淋巴细胞功能等。
通过免疫调节策略来控制AS是一个很有吸引力的治疗方法[80]。但由于AS斑块的复杂性和免疫细胞之间发生的动态相互作用,为这类疗法的发展带来许多挑战[81],因而需要更深入了解免疫细胞及其影响AS的机制。对免疫细胞及其机制的进一步研究将有助于从免疫调控角度阐明AS的发病机制,为AS的治疗提供更有效、更为安全的方法。
