高尔基体蛋白73和FIB4指数对非酒精性脂肪肝病肝硬化的诊断价值
2022-01-05叶亚丽潘连连包丹妮朱凤娇林雪丹胡艳芳曾万里
叶亚丽 潘连连 包丹妮 朱凤娇 林雪丹 胡艳芳 曾万里
随着肥胖、Ⅱ型糖尿病、高血压及代谢综合征的发病率增多,非酒精性脂肪肝病(NAFLD)的发病率持续上升,已成为第二大慢性肝病[1],被公认为是隐蔽性肝硬化的常见原因。肝纤维化是机体对各种病因所致反复或持续肝损伤的一种修复过程,表现为以胶原为主的肝细胞为基质在肝内过多的沉积[2]。如不予有效治疗,肝纤维化可进展为肝硬化、肝癌、肝衰竭等终末期肝病。研究报道,血清GP73对不同病因慢性肝病所致的肝纤维化、肝硬化均有更好的诊断价值[3]。FIB4指数能准确预测NAFLD肝纤维化进展程度,可以判断患者发生严重肝硬化的风险[4]。本文探讨血清GP73水平和FIB4指数对NAFLD肝硬化的早期诊断价值。
1 资料与方法
1.1 临床资料 2018年1月至2020年9月三门县人民医院经B超诊断为非酒精性脂肪性肝病患者168例,经临床确诊为NAFLD肝硬化46例,男31例,女15例;年龄33~79岁,NAFLD非肝硬化122例,男94例,女28例;年龄29~77岁。同期随机抽取的体检健康者200例为对照组,男153例,女47例;年龄28~72岁。NAFLD肝硬化组、NAFLD非肝硬化组与对照组间性别、年龄等比较差异无统计学意义。脂肪肝诊断标准依照2012年中华医学会肝脏病学分会发布的《非酒精性脂肪性肝病诊疗指南》[5]:具备以下3项腹部超声表现中的两项者即可诊断为脂肪肝:(1)肝脏近场场回声弥漫性增强(“明亮肝”),回声强于肾脏:(2)肝内管道结构显示不清:(3)肝脏远场回声逐渐衰减。肝纤维化程度诊断:采用肝穿刺活检将非酒精性脂肪性肝分为无/轻度肝纤维化(F0,F1)为NAFLD非肝硬化组,进展期肝纤维化(F3,F4)为NAFLD肝硬化组。排除标准:①特殊类型糖尿病、妊娠糖尿病、Ⅰ型糖尿病及其他分型不详的糖尿病患者;②酒精摄入量男性>140 g/周,女性>70 g/周;③ALD、病毒性肝炎、肝豆状核变性、自身免疫性肝病等导致脂肪肝的特定疾病;④药物、全胃肠外营养、炎性肠病、甲状腺功能减退症、库欣综合征、肢端肥大症以及一些与IR相关的综合征(Mauriac综合征)等可导致脂肪肝的特殊情况。
1.2 方法 (1)人体学参数测量:所有受试者身高、体重参数均采用同一全自动测量仪。血压采用全自动血压测量仪进行测量。(2)B超检测:由专业的超声影像医师采用同一超声诊断仪与3.5 MHz的B超探头进行上腹部B超检查,并出具统一的诊断报告。(3)实验室各指标检测:清晨空腹采集EDTA-K2抗凝静脉血2 mL,采用希森美康XE-2100血液分析及配套试剂检测白细胞计数(WBC)、血红蛋白(Hgb)、血小板(PLT)。采集无抗凝血3 mL,分离血清,采用贝克曼AU5800全自动生化分析仪及配套试剂检测总蛋白(TP)、白蛋白(Ab)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、血糖(GIU)、谷氨酰酰基转移酶(GGT)、甘油三酯(TG)、总胆固醇(Tch)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、尿酸(UA)、肌酐(Cr)。采集无抗凝血3 mL,分离血清,采用新产业MAGLUMI 2000全自动化学发光分析仪及相应试剂检测肝纤维化指标HA、LN、CⅣ、PⅢNP。采集无抗凝血3 mL,分离血清,采用酶联免疫比色法(ELISA)检测血清GP73水平。所有项目操作步骤严格按照仪器及试剂盒的说明书进行。FIB4指数=年龄×AST/血小板计数×ALT。
1.3 统计学方法 采用SPSS21.0统计软件。计数资料用%表示,用χ2检验;正态分布的计量资料以(x±s)表示,多组间比较用方差分析;非正态分布以M(Q1,Q3)表示,用Mann-Whitney U检验。采用 Spearman相关性分析GP73和FIB4指数与其他因素的相关性。采用Logistic回归分析对NAFLD的相关因素进行风险分析。采用ROC曲线分析GP73和FIB4指数对NAFLD肝硬化的诊断效能。以P<0.05为差异有统计学意义。
2 结果
2.1 三组基线特征比较 见表1。
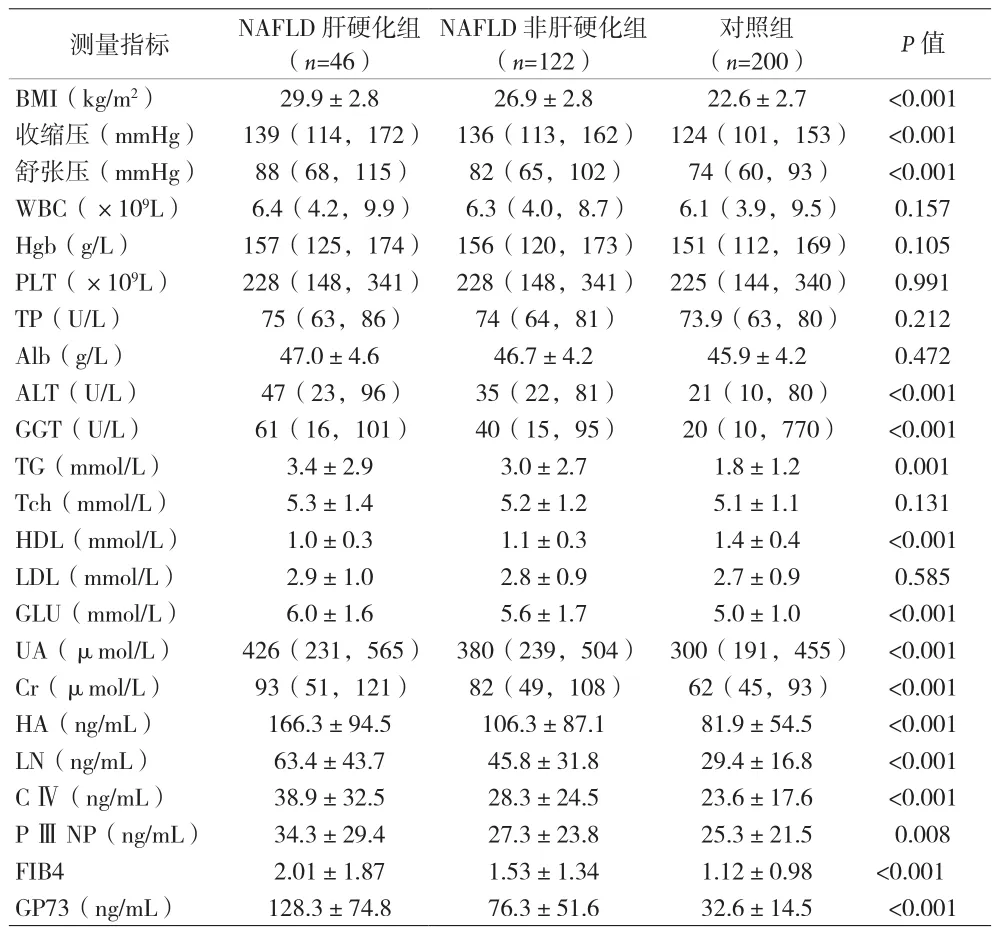
表1 三组基线特征比较
2.2 NAFLD肝硬化相关危险因素分析 通过单因素和多因素Logistic回归分析结果显示:血清GP73、FIB4、BMI、ALT和HA、LN、CⅣ、PⅢNP均是NAFLD肝硬化发生的独立危险因素(P均<0.001)。血清GP73的OR 2.982(95%CI 2.450~4.705);FIB4指数的 OR 2.024(95%CI 1.892~2.247),P<0.001。
2.3 GP73与FIB4指数及其他相关指标的相关性分析 Spearman相关分析显示GP73与FIB4指数间呈高度相关(r=0.892,P<0.001),GP73与 BMI、ALT 和 HA、CⅣ呈均中度正相关(P<0.05),与LN和PⅢNP无相关性(P>0.05)。
2.4 NAFLD肝硬化组各项指标的诊断效能 血清GP73水平的AUC为0.894,FIB4指数为0.882。血清GP73水平的最佳cut-off值为136.2 ng/mL时,其敏感性为83%,特异性为92%;FIB4指数最佳cut-off值为1.5时,其敏感性为76%,特异性为92%。见图1。

图1 NAFLD肝硬化组的各项指标的ROC曲线
2.5 不同水平的GP73、FIB4指数对NAFLD的风险性分析 依据ROC曲线得出cut-off值分别将GP73、FIB4指数分为两组,当GP73<136.2 ng/mL,NAFLD的患病率为16.18%,当GP73≥136.2 ng/mL,NAFLD的患病率可高达83.32%。当FIB4<1.5,NAFLD的患病率为23.53%,当FIB4≥1.5,NAFLD的患病率可高达76.47%。见图2。
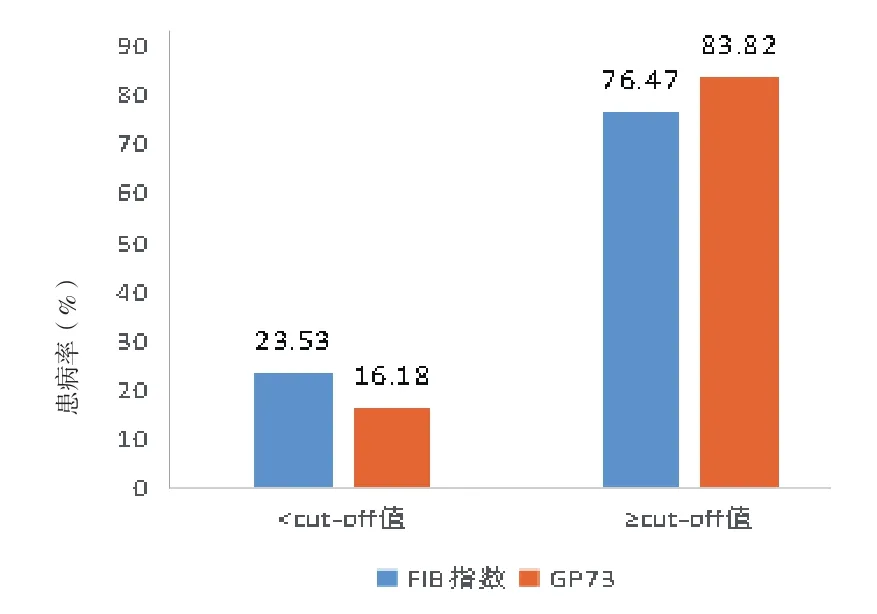
图2 不同水平的GP73、FIB4指数对NAFLD的风险性分析
3 讨论
NAFLD是指除外酒精和其他明确的肝损害因素所致的以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征,是与胰岛素抵抗和遗传易感性密切相关的获得性代谢应激性肝损伤[6]。其疾病谱包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎及其相关肝硬化和肝细胞癌[7]。尽管肝活检组织检查是诊断肝硬化的金标准,但因其有创性,临床应用受限。因此,无创诊断肝硬化指标如血清GP73和FIB-4指数等在早期肝硬化诊断中的应用逐渐受到关注。
GP73在正常肝组织中主要表达在胆管上皮细胞,在肝细胞内几乎不表达。临床曾将GP73作为原发性肝癌的诊断指标,但有文献报道显示肝硬化患者血清GP73水平也明显升高[8]。为明确GP73与肝硬化、肝癌的关系,北京大学基础医学院鲁凤民教授团队将肝细胞癌患者分为合并肝硬化和无肝硬化2组,发现肝硬化HCC患者血清GP73升高明显;同时研究发现,GP73对不同病因所致的肝硬化均有较好的诊断价值[9]。本资料结果显示:NAFLD肝硬化组患者的血清GP73的结果明显高于NAFLD非肝硬化组和正常对照组水平,提示血清GP73可能是潜在的诊断肝硬化的良好指标。
在一项有541例NAFLD患者的队列研究中发现,与其他非侵入性指标相比较,FIB4指数优于NFS和BARD,而且FIB4指数=2.67的阳性预测值为80%,及FIB4指数=1.30有90%的阴性预测值来诊断进展期纤维化[9]。FIB4指数能准确预测NAFLD肝纤维化进展程度,是评估肝纤维化进展的较好指标。本研究结果显示,NAFLD肝硬化组患者的FIB4指数的结果明显高于NAFLD非肝硬化组和正常对照组水平,提示FIB4指数可能与NAFLD肝硬化的发生、发展密切相关。
多因素Logistic回归分析中显示:血清GP73、FIB4、BMI、ALT和肝纤维四项HA、LN、CⅣ、PⅢNP是NAFLD肝纤维化发生的独立危险因素,GP73 OR值最高为2.982,其次是FIB4指数,为2.024,均高于其余各指标。表明GP73和FIB4指数是预测NAFLD肝硬化的独立危险因子。而GP73水平与FIB4指数呈高度的相关,进一步表明这两指标在NAFLD肝硬化诊断中具有重要意义,从而可能有助于其诊断、预测和病情评估。
为了进一步评估风险指标在NAFLD肝硬化的预测中的作用,ROC曲线结果显示,血清 GP73水平AUC为0.894,高于其他指标,GP73水平最佳cut-off值为136.2ng/ml时,其诊断NAFLD肝硬化均具有较高的敏感性和特异性,分别达到83.0%和92.0%。其次为FIB4指数,AUC的0.882,最佳cut-off值为1.5。因此,以GP73水平和FIB4指数的cut-off值作为医学决定水平用于预测NAFLD肝硬化诊断具有实用价值。综上所述,血清GP73水平和FIB4指数升高是NAFLD患者发生肝硬化的独立风险因子,且对NAFLD肝硬化的早期诊断均具有较高的预测价值。
