长链非编码RNA TUG1 靶向miR-29a-3p 调控高糖诱导的人足细胞损伤
2022-01-04任丽珏魏翠英魏枫张永红张悦
任丽珏 魏翠英 魏枫 张永红 张悦
(内蒙古科技大学包头医学院第一附属医院内分泌科,内蒙古 包头 014010)
足细胞是位于肾小球基底膜(GBM)外侧的高度分化的细胞,与GBM、内皮细胞共同组成了肾小球滤过膜,足细胞损伤是介导肾小球疾病进展的关键因素,以足细胞损伤为靶点的治疗现已成为糖尿病肾病等肾小球疾病治疗的新手段〔1,2〕。高血糖可以引起足细胞凋亡、脱落、数量减少,造成足细胞损伤,从而引起大量尿蛋白,启动肾小球硬化〔3〕。研究发现长链非编码RNA(LncRNA)与肾脏发育和肾脏疾病的发生发展相关,研究其影响肾脏疾病发病和进展机制,为肾脏疾病提供诊断依据和潜在治疗靶点〔4〕。牛磺酸上调基因(TUG)1 在各种肿瘤中表达失调,参与多种肿瘤细胞的增殖和凋亡,LncRNA TUG1 可能作为癌症患者的有用预后生物标志物〔5〕。有研究发现TUG1 在足细胞中调节线粒体功能,抑制细胞增殖和细胞外基质积累〔6〕。TUG1 可通过下调抑癌基因P27 表达促进乳腺浸润性导管癌生长,而沉默TUG1 可抑制细胞增殖并上调凋亡细胞比例〔7〕。此外,微小RNA(miRNA)可通过调控足细胞在肾小球疾病发生发展中发挥重要作用,进一步研究miRNA 在足细胞及肾小球疾病中的作用有助于实现肾小球疾病的早诊断、早治疗〔8〕。研究报道过表达miR-29a 通过抑制第10 染色体同源丢失性磷酸酶张力蛋白基因(PTEN)的表达从而抑制肾小管上皮细胞凋亡〔9〕。miR-29a-3p 可抑制胃癌细胞的增殖而促进其凋亡〔10〕。而TUG1 和miR-29a-3p 对高糖诱导的人足细胞损伤的影响及TUG1是否通过miR-29a-3p 影响足细胞损伤还尚未清楚。本实验旨在研究TUG1 是否通过miR-29a-3p 影响高糖诱导的人足细胞损伤。
1 材料与方法
1.1 材料 人肾小球足细胞(HPCs)购自中国科学院上海细胞库;胎牛血清、DMEM-F12 培养基、胰蛋白酶购自美国Sigma 公司;LipofectamineTM2000 转染试剂盒购自美国Invitrogen 公司;Trizol 试剂、反转录试剂盒、荧光定量试剂盒购自日本TaKaRa 公司;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)和碘化丙锭(PI)试剂盒、双荧光素酶报告基因检测试剂盒购自北京Solarbio 公司;二喹啉甲酸(BCA)试剂盒、RIPA 蛋白裂解液、十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)试剂盒购自上海碧云天生物技术有限公司。
1.2 细胞培养与分组 将HPCs 细胞在37℃、含10%胎牛血清的DMEM-F12 完全培养液中培养,每隔2~3 d 传代1 次,将融和至80%的细胞无血清饥饿培养24 h,用终浓度为30 mmol/L 的D-葡萄糖溶液刺激培养细胞48 h 作为高糖(HG)组,同时以终浓度为5 mmol/L 的D-葡萄糖溶液处理细胞作为正常对照(Control)组。将pCDH-NC、pCDH-TUG1、si-NC、si-TUG1 分别转染至正常HPCs 细胞中,记为pCDH-NC 组,pCDH-TUG1 组、si-NC 组、si-TUG1 组。将pCDH-NC、pCDH-TUG1、anti-NC、anti-miR-29a-3p转染至高糖处理的HPCs 细胞中,记为HG+pCDHNC 组、HG+pCDH-TUG1 组、HG+anti-NC 组和HG+anti-miR-29a-3p 组。将 pCDH-TUG1 与 miR-NC、miR-29a-3p 分别共同转染至高糖处理的HPCs 细胞中,记为HG+pCDH-TUG1+miR-NC 组、HG+pCDHTUG1+miR-29a-3p 组;转染均采用LipofectamineTM2000 转染试剂盒。
1.3 qRT-PCR 检测miR-29a-3p 和TUG1 mRNA 的表达水平 收集各组细胞,研磨充分后加入Trizol试剂提取总RNA,微量核酸测定仪检测RNA 纯度和浓度。使用TaKaRa 反转录试剂盒将RNA 反转录成cDNA,按照TaKaRa 荧光定量试剂盒使用说明配制反应体系,以β-actin 为内参进行PCR 扩增,每个样品重复3 次,循环条件为95℃30 s,60℃30 s;72℃30 s,共40 个循环;72℃延长5 min。相对表达量采用2-△△Ct法计算。
1.4 Western 印迹检测蛋白表达 收集各组细胞,加入RIPA 裂解液裂解,4℃,10 340 r/min 离心15 min,收集蛋白上清液,BCA 试剂盒测定蛋白浓度。将蛋白样品进行SDS-PAGE 后转至聚偏氟乙烯(PVDF)膜上,5 %脱脂奶粉封闭液室温封闭1 h。分别加入一抗(1 ∶1 000),4℃孵育过夜,TBST 洗膜;加入二抗(1 ∶2 000)室温孵育2 h,TBST 洗涤3 次,每次10 min,后在暗室中曝光显影,再浸入定影,最后洗去残液晾干,将胶片用Quantity One 凝胶分析软件处理,测定各组蛋白条带的吸光度,以目的条带和β-actin 条带的比值作为蛋白表达水平。每个蛋白样品重复3 次。
1.5 流式细胞术检测细胞凋亡 用不含乙二胺四乙酸(EDTA)的胰酶消化各组细胞,离心收集各组细胞,磷酸盐缓冲液(PBS)漂洗2 次,加结合缓冲液重悬细胞。依据试剂盒说明书,先后加入Annexin V-FITC 和PI 避光孵育。流式细胞仪检测激发波长488 nm 和发射波长530 nm 处的荧光强度。实验重复3 次。
1.6 荧光素酶报告基因检测实验检测TUG1 对miR-29a-3p 的靶向调控 TargetScan 数据库显示TUG1 3'UTR 区域有miR-29a-3p 结合位点。构建野生型和突变型基因靶点TUG1 3'UTR 荧光素酶表达载体(TUG1-WT 和TUG1-MUT),用LipofectamineTM2000 将TUG1-WT 和TUG1-MUT 分别与miR-NC 和miR-29a-3p 共转染至HPCs 细胞中。按说明书要求,使用荧光素酶报告基因检测仪进行双荧光素酶报告实验。结果以荧光素酶活性和Renilla 活性比值进行统计学分析。实验重复3 次。
1.7 统计学分析 采用SPSS20.0 软件进行t检验、单因素方差分析。
2 结果
2.1 高糖对HPCs 细胞损伤的影响 与Control 组相比,HG 组podocin、nephrin、Bcl-2 表达水平显著降低;Bax 表达水平显著升高(P<0.05);HPCs 细胞凋亡率显著升高(P<0.05)。见图1,表1。
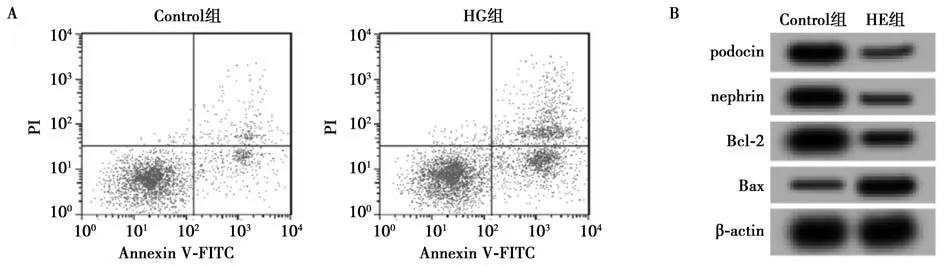
图1 高糖对HPCs 细胞损伤的影响
表1 高糖对HPCs 细胞损伤及TUG1、miR-29a-3p 表达的影响(,n=9)

表1 高糖对HPCs 细胞损伤及TUG1、miR-29a-3p 表达的影响(,n=9)
与Control 组比较:1)P<0.05
2.2 高糖处理后HPCs 细胞中LncRNA-TUG1 和miR-29a-3p 表达量 与Control 组相比,HG 组HPCs细胞中TUG1 mRNA 表达水平显著降低;miR-29a-3p 表达水平显著升高(P<0.05)。见表1。说明高糖可促进miR-29a-3p 表达,抑制TUG1 mRNA 表达。
2.3 过表达TUG1 对高糖诱导的HPCs 细胞损伤的影响 与HG+pCDH-NC 组相比,HG+pCDH-TUG1组HPCs 细胞中podocin、nephrin、Bcl-2 表达水平显著升高;Bax、miR-29a-3p 表达水平显著降低(P<0.05);HPCs 细胞凋亡率显著降低(P<0.05)。见图2,表2。说明过表达TUG1 抑制HPCs 细胞凋亡,保护高糖诱导的足细胞损伤。
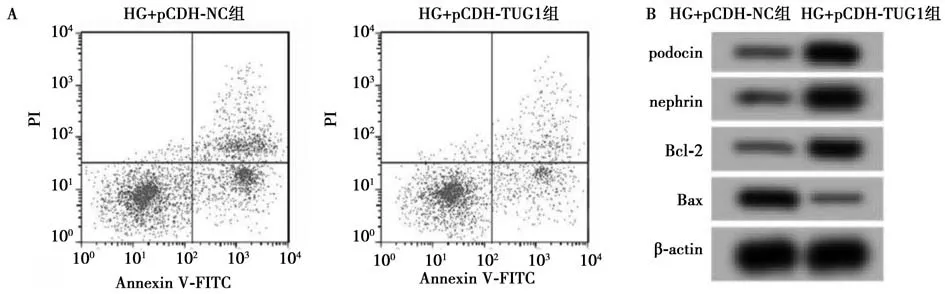
图2 过表达TUG1 后HPCs 细胞蛋白的表达
表2 过表达TUG1 对HPCs 细胞损伤的影响(,n=9)

表2 过表达TUG1 对HPCs 细胞损伤的影响(,n=9)
与HG+pCDH-NC 组比较:1)P<0.05
2.4 抑制miR-29a-3p 的表达对高糖诱导的HPCs细胞损伤的影响 与HG+anti-NC 组相比,HG+antimiR-29a-3p 组HPCs 细胞中podocin、nephrin、Bcl-2表达水平显著升高;Bax、miR-29a-3p 表达水平显著降低(P<0.05);HPCs 细胞凋亡率显著降低(P<0.05)。见图3,表3。说明抑制miR-29a-3p 的表达抑制HPCs 细胞凋亡,保护高糖诱导的足细胞损伤。

图3 抑制miR-29a-3p 后HPCs 细胞蛋白的表达
表3 抑制miR-29a-3p 后对人足细胞损伤的影响(,n=9)

表3 抑制miR-29a-3p 后对人足细胞损伤的影响(,n=9)
与HG+anti-NC 组比较:1)P<0.05
2.5 LncRNA-TUG1 靶向调控miR-29a-3p TargetScan 数据库预测到TUG1 与miR-29a-3p 存在结合位点(图4)。转染野生型和突变型表达载体TUG1-WT 和TUG1-MUT 后,相较于miR-NC 组,miR-29a-3p 组TUG1-WT 人足细胞的荧光素酶活性显著降低(P<0.05);而TUG1-MUT 人足细胞的荧光素酶活性差异不显著(表4)。相较于pCDH-NC组,pCDH-TUG1 组miR-29a-3p 表达水平显著降低(0.59±0.07 vs 0.20±0.03);相较于si-NC 组,si-TUG1 组miR-29a-3p 表达水平显著升高(0.57±0.04 vs 0.85±0.09;P<0.05)。可见,TUG1 可靶向调控miR-29a-3p。

图4 LncRNA-TUG1 靶向调控miR-29a-3p
表4 双荧光素酶报告实验(,n=9)
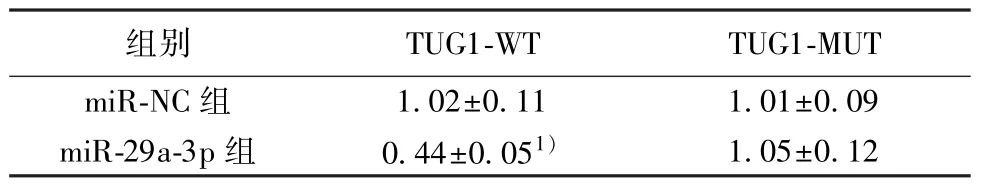
表4 双荧光素酶报告实验(,n=9)
与miR-NC 组比较:1)P<0.05
2.6 过表达miR-29a-3p 表达能逆转过表达TUG1对高糖诱导的人足细胞损伤的抑制作用 结果如图5、表5 所示,与HG+pCDH-NC 组相比,HG+pCDHTUG1 组podocin、nephrin、Bcl-2 表达水平显著升高,Bax、miR-29a-3p 表达水 平显著降低(P<0.05);HPCs 细胞凋亡率显著降低(P<0.05)。与HG+pCDH-TUG1 +miR-NC 组相比,HG+pCDHTUG1+miR-29a-3p 组HPCs 细胞中podocin、nephrin、Bcl-2 表达水平显著降低,Bax、miR-29a-3p 表达水平显著升高(P<0.05);HPCs 细胞凋亡率显著升高(P<0.05)。
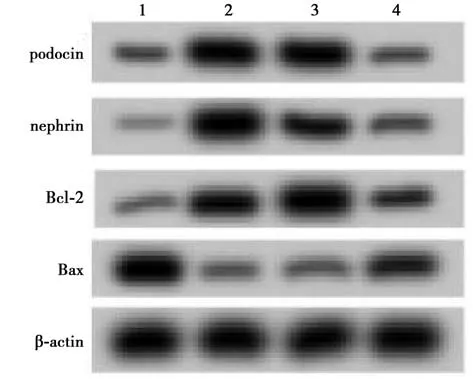
图5 人足细胞凋亡蛋白表达
表5 过表达miR-29a-3p 对人足细胞损伤的影响(,n=9)

表5 过表达miR-29a-3p 对人足细胞损伤的影响(,n=9)
与HG+pCDH-NC 组比较:1)P<0.05;与HG+pCDH-TUG1+miR-NC 组比较:2)P<0.05
3 讨论
足细胞是肾小球终末分化细胞,易损伤,难再生,其损伤导致的足细胞结构和功能异常改变是肾小球疾病相关的足细胞病的主要特点〔11〕。研究发现LncRNA TUG1 在多种肿瘤中表达上调,其主要通过竞争性内源RNA(ceRNA)模式与转录因子竞争性结合miRNA、调控下游蛋白表达等途径参与肿瘤的发生、发展〔12〕。TUG1 通过下调miR-29b 抑制脂多糖引起的H9c2 细胞凋亡和炎症反应〔13〕。TUG1 通过调节miR-223 保护肾小管上皮细胞免受脂多糖诱导的损伤〔14〕。TUG1 过表达通过抑制细胞凋亡和炎症来防止冷诱导的小鼠肝脏损伤〔15〕。足细胞裂孔蛋白podocin 和nephrin 是肾小球滤过分子筛的重要组成成分,在足细胞损伤时会代偿性增高〔16〕。而B 细胞淋巴瘤(Bcl)-2 和Bcl-2 相关X 蛋白(Bax)是调控凋亡关键因子,Bax/Bcl-2 比列升高促进凋亡。所以,本实验结果表明过表达TUG1 可保护高糖诱导的足细胞损伤。
此外,本实验还发现TUG1 靶向调控miR-29a-3p。有报道显示TUG1 通过调节miR-29b 参与肝纤维化和肝星状细胞的活化〔17〕;TUG1 通过抑制miR-29b-3p 促进多发性骨髓瘤的增殖和抑制细胞凋亡〔18〕。抑制miR-29a-3p 表达通过靶向上调半胱氨酸天冬氨酸蛋白酶(caspase)7、caspase8、Bcl-2 促进巨噬细胞凋亡〔19〕。miR-29a-3p 抑制表达能增强喉癌Hep-2 细胞增殖,抑制细胞凋亡〔20〕。以上研究结果说明miR-29a-3p 影响细胞的增殖和凋亡,而TUG1 与miR-29 存在靶向调控关系。且还有研究发现miR-29a 和miR-29b 与2 型糖尿病患者的尿白蛋白相关〔21〕。本实验研究结果显示,高糖处理的HPCs 中miR-29a-3p 表达水平升高,抑制miR-29a-3p 表达可提高podocin、nephrin、Bcl-2 的表达水平,降低Bax 的表达水平;降低细胞凋亡率,保护高糖诱导的足细胞损伤。且过表达miR-29a-3p 能逆转TUG1 过表达对高糖诱导足细胞损伤的保护作用。进一步表明TUG1 可能通过调控miR-29a-3p 保护高糖诱导足细胞损伤。
综上所述,TUG1 对高糖刺激的人足细胞损伤有保护作用,其机制可能与miR-29a-3p 表达相关。将可为糖尿病肾病等肾小球相关疾病的诊断和治疗提供新靶点和理论依据。
