右美托咪定对尿液干细胞移植治疗大鼠肺气肿的影响
2022-01-04张茂康学栋刘颖朱鸿浩
张茂 康学栋 刘颖 朱鸿浩
(1 宜宾市第一人民医院药剂科,四川 宜宾 644000;2 暨南大学附属第一医院核医学科)
肺气肿是慢性阻塞性肺疾病的晚期表现,并无特效治疗方法,故严重威胁人们的生命安全〔1,2〕。临床上多以低流量吸氧、中药治疗、激素注射或者抗感染等针对其症状缓解的治疗方法为主〔3〕。然而因肺气肿引发的肺部组织结构损伤和功能下降,目前的治疗手段并无良好的效果。干细胞是一类可以高度增殖并具有极佳的分化分泌功能的多向性分化细胞,其在组织损伤修复方面表现良好〔4~6〕。其中骨髓间充质干细胞和胎肝干细胞等由于来源受限且具有伦理学的争议,研究受到限制。而尿液干细胞来源广泛且无此争议,因此其研究广泛而深入〔7,8〕。研究显示尿液干细胞可以修复表皮、脏器等组织损伤,其是一种未来治疗组织损伤的明星细胞〔9,10〕。王晨等〔11〕研究表明,尿液细胞来源的人类诱导多功能干细胞可以向肺泡上皮细胞转化,具有修复肺脏损伤的潜力。右美托咪定是临床上较为常用的麻醉药物,其是高选择性的α2 肾上腺素受体激动剂〔12〕;其可以通过激动α2 肾上腺素受体,对患者发挥镇痛和抑制焦虑的作用〔13〕。右美托咪定在缓解患者的病痛过程,其并无抑制呼吸的作用,这促使其可以广泛应用于肺部疾病的治疗,同时赵津津等〔14〕研究表明右美托咪定通过抑制肺损伤引起的核转录因子(NF)-κB、转录激活子(STAT)-3 通路的激活进而抑制炎症反应最终起到肺保护作用,故其对肺气肿有保护作用。然而目前的研究就右美托咪定联合尿液干细胞移植对肺气肿的影响研究较少;本研究旨在探讨右美托咪定对尿液干细胞移植治疗肺气肿模型大鼠的影响。
1 实验及材料
1.1 材料及来源 L-DMEM 培养基、胎牛血清和磷酸盐缓冲液(PBS)均购自Hyclone 公司;Trizol 试剂盒购自Invitrogen 公司;转化生长因子(TGF)-β1、血管内皮生长因子(VEGF)及胰岛素样生长因子(IGF)-Ⅰ兔IgG 多克隆抗体均购自Santa anta Gruz公司;兔抗大鼠多克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG 均购自英国Abcam 公司;胰蛋白酶、RT-聚合酶链反应(PCR)试剂盒均购自大连宝生物工程有限公司;本实验所用引物均由Invitrogen 公司合成提供。盐酸右美托咪定注射液(江苏恒瑞医药股份有限公司生产);68 只体重为180~210 g 的成年雌性Wistar 大鼠(7 周龄)由北京维通利华动物实验技术有限公司提供,生产许可证号:SCXK(川)2014-0021,实验动物使用许可证号:SYXK(川)2015-0023)2014-0012。所有Wistar 大鼠饲养于室温25℃,湿度60%~70%的SPF 环境下,同时给予大鼠以自由方便的饮水和采食。人尿液干细胞购自上海通派生物科技有限公司。
1.2 方法
1.2.1 尿液干细胞培养和标记 取出液氮保存的人尿液干细胞,复苏接种于一次性细胞培养瓶(25 cm2)中,加入DMEM 培养液5 ml,放入37 ℃培养箱内5%CO2培养,每隔2 d 换液1 次。连续传代3 次后,离心去掉上清,将尿液干细胞密度调整为1×106/ml。将细胞放置于细胞培养箱中继续培养7 d,用PBS 洗涤细胞3 次后弃去上清液。随后行干细胞进CFSE 的荧光标记。向细胞悬液中加入CFSE,DMEM 培养液调整其浓度5 μmol/L,随后将标记的细胞不断摇匀转入细胞培养箱中继续放置15 min,在荧光显微镜下观测CFSE 标记的尿液干细胞的细胞形态。
1.2.2 动物模型建立和实验分组 68 只Wistar 雌性大鼠给予刺激处理以构建肺气肿模型,其处理操作如下:将大鼠放置在60 L 封闭玻璃箱中,并在玻璃箱中放入16 支点燃的香烟给予大鼠烟熏30 min,2 次/d,每次间隔6 h。在处理1 个月后麻醉大鼠,采用气管插管向大鼠气管中滴入猪胰弹生蛋白酶;随后采用小动物呼吸机给予大鼠通气并将大鼠直立旋转使猪胰弹生蛋白酶均匀进入大鼠两侧的肺组织。随后拔出大鼠的插管,继续给予所有大鼠以烟熏处理,连续进行2 个月从而构建大鼠肺气肿模型。造模完成后随机取8 只大鼠,取肺组织行苏木素-伊红(HE)染色可见建模成功。60 只大鼠随机分为4个,每组20 只:给予病理对照组0.5 ml 的L-DMEM完全培养液尾静脉注射,给予尿液干细胞组0.5 ml的5×106个/L 的尿液干细胞尾静脉移植,给予右美托咪定组大鼠尾静脉6 h 持续输入5 μg/(kg·h)的右美托咪定,给予联合治疗组大鼠尾静脉注射尿液干细 胞〔0.5 ml,5 × 106个/L〕 和右美 托咪定〔5 mg(kg·h),6 h/d〕。所有操作连续进行3 d。
1.2.3 肺泡灌洗液TGF-β1、VEGF 及IGF-Ⅰ表达水平 治疗6 w 后,从4 组中随机选出5 只大鼠收集其肺泡灌洗液;将大鼠的肺脏舌叶作为灌洗部位以获取BALF 细胞,所有操作参照BALF 相关的指针进行。收集4 组肺泡灌洗液后,采用酶联免疫吸附试验测定各组肺泡灌洗液中TGF-β1、VEGF 及IGF-Ⅰ表达水平并进行比较。
1.2.4 肺组织TGF-β1、VEGF 及IGF-Ⅰ基因表达水平 治疗6 w 后,从4 组中分别随机选出5 只大鼠采集大鼠的肺脏50 mg,RT-PCR 检测大鼠肺脏组织TGF-β1、VEGF 及IGF-Ⅰ表达水平。将冷冻的肺脏组织进行冰冻研磨后向组织液中加入Trizol 试剂裂解细胞并提取细胞中RNA。根据逆转录说明合成并扩增相应cDNA。扩增条件均为94℃预变性1 min,94℃变性30 s,59℃退火30 s,72℃延伸30 s,共33 个循环。TGF-β1:上游引物:5'-GCTAATGGTGGACCGCAAC-3';下游引 物:5'-GCTAATGGTGGACCGCAAC-3' ;IGF-Ⅰ:上游引游5'-GCATTGTGGATGAGTGTTGC-3';下游引物:5'-GGCTCCTCCTACATTCTGTA-3';VEGF:上游引 物:5'-GCTATTGCCGTCCAATTGAG-3;下游引物:5'-GGTTTGATCCGCATGATCTG-3';β-actin:上游引 物:5'-CTGCCGCATCCTCTTCCTC-3' ;下游引物:5'-GCAGTAATCTCCTTCTGCATCC-3' 。以β-actin 基因作为内参,测定4 组IGF-ⅠmRNA、VEGF 及IGF-ⅠmRNA 在肺组织相对表达水平。
1.2.5 肺组织TGF-β1、VEGF 及IGF-Ⅰ蛋白表达水平 将RT-PCR 提取后剩余物按1 500 r/min 离心30 min,取上清为粗体蛋白,根据二喹啉甲酸(BCA)试剂盒(北京益德益华生物有限公司)提取并测定肺组织蛋白浓度,将细胞裂解并将其稀释至相同的蛋白浓度,100℃煮沸5 min 使蛋白变性。每组取蛋白40 μg,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电 泳(SDS-PAGE,70 V,30 min;100 V,90 min);转膜(200 mA,3 h)至聚偏氟乙烯(PVDF)膜;5%脱脂牛奶室温封闭2 h(或4℃过夜);一抗1 ∶500,室温孵育2 h(或4℃过夜);TPBS 洗涤3 次,PBS 洗涤1 次;之后进行Western 印迹检测,拍照记录之后进行软件的图像分析,测定各组肺纤维化损伤组织中TGF-β1、VEGF 及IGF-Ⅰ蛋白质相对表达水平。
1.2.6 肺组织病理学变化 干预6 w 后从4 组中随机选取5 只大鼠,分别采集大鼠的肺脏组织并进行HE 染色进行大鼠肺组织的病理学检测。首先采用甲醛溶液对肺脏组织进行组织固定,采用不同浓度的酒精分别进行自低浓度到高浓度的酒精脱水处理。脱水操作完成后将肺脏组织块放置于二甲苯中进行透明处理,将组织中的酒精全部替换而出;浸蜡包埋,将蜡块在切片机上切成5~8 μm 厚的肺组织薄片。小心将所有肺组织薄片进行熨平后贴在载玻片上低温烘干脱蜡。脱蜡后进行HE 染色,之后分别经过酒精脱水和二甲苯透明处理后,在切片上滴加加拿大树胶封上盖玻片。树胶干燥后,在荧光显微镜下检测4 组大鼠肝脏组织病理学的形态和变化。
1.2.7 尿液干细胞在肺组织中的存活和分布 干预6 w 后从4 组中随机选取5 只大鼠,分别采集大鼠的肺脏组织,并将之制备成冷冻切片并进行4',6-二脒基-2 苯基吲哚染色。荧光显微镜下进行观察,在镜下视野中随机选取3 个视野拍照记录;假设每张照片的总亮度为1,从各张照片之中选取1 个亮点,使用ACDsee5.0 软件确定其坐标。从各个样本的图像之中选取8 个视野,分别计数视野中CFSE标记的阳性细胞数和尿液干细胞总数,计算得出各组中大鼠肺脏组织中的尿液干细胞标记率。
1.2.8 肺泡壁细胞凋亡率 干预6 w 后从4 组中随机选取5 只大鼠,取大鼠的肺叶制作石蜡切片,滴加复合消化酶在切片上进行20 min 的室温消化;洗涤切片,向其中滴加50 μl 的Tunel 标记反应混合液37℃下进行孵育1 h;之后滴加50 μl 的POD2 转化液,在37℃下继续孵育30 min;用PBS 冲洗4 次后用DBA 显色,在荧光显微镜下观察各组肺泡壁上的凋亡细胞数目并计算肺泡壁上细胞的凋亡率。
1.3 统计学方法 采用SPSS16.0 软件进行t检验、多组间单因素方差分析。
2 结果
2.1 尿液干细胞形态及CFSE 标记 将尿液干细胞体外条件下复苏完成6 h 后,可以在显微镜下见到少量的干细胞已经开始附着于培养皿的壁和底部。将尿液干细胞接种在细胞培养皿上24 h 后的干细胞形态。细胞贴在细胞培养皿上逐渐开始生长,显微镜下可见尿液干细胞逐渐呈现出长梭形或三角形。见图1。经过CFSE 标记的尿液干细胞,荧光显微镜下可见绿色荧光,尿液干细胞24 h、48 h、72 h、96 h、120 h、144 h 存活率(0.23±0.03、0.30±0.04、0.39±0.05、0.46±0.03、0.58±0.06、0.71±0.05,均P<0.05)依次上升。
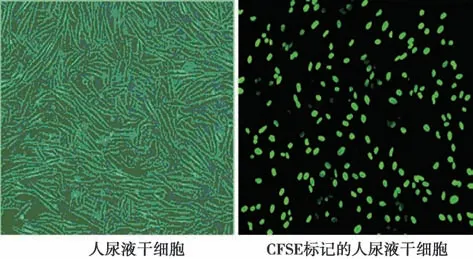
图1 尿液干细胞形态及CFSE 标记观察(×40)
2.2 各组肺泡灌洗液TGF-β1、VEGF 及IGF-Ⅰ表达水平比较 病理对照组肺泡灌洗TGF-β1、VEGF及IGF-Ⅰ的浓度最高(P<0.05),与之相比,其余各组以上指示水平均显著下降(均P<0.05)且联合治疗组以上指标水平浓度最低(P<0.05)。见表1。
表1 各组肺泡灌洗液TGF-β1、VEGF 及IGF-Ⅰ表达水平比较(,n=5,μg/L)
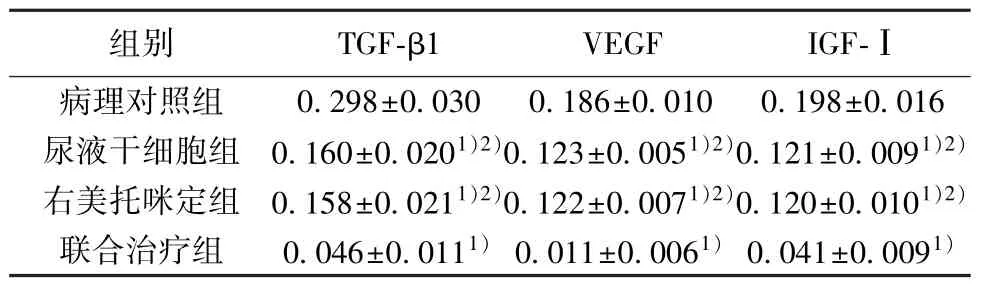
表1 各组肺泡灌洗液TGF-β1、VEGF 及IGF-Ⅰ表达水平比较(,n=5,μg/L)
与病理对照组比较:1)P<0.05,与 联合治疗组比较:2)P<0.05;下表同
2.3 各组肺组织TGF-β1、VEGF 及IGF-Ⅰ基因表达水平比较 病理对照组肺组织TGF-β1、VEGF 及IGF-1 浓度最高(P<0.05),与之相比,其余各组以上指标水平均显著下降,且联合治疗组以上指标水平浓度最低(均P<0.05)。见表2,图2。
表2 各组肺组织TGF-β1、VEGF 及IGF-Ⅰ基因表达水平比较(,n=5)
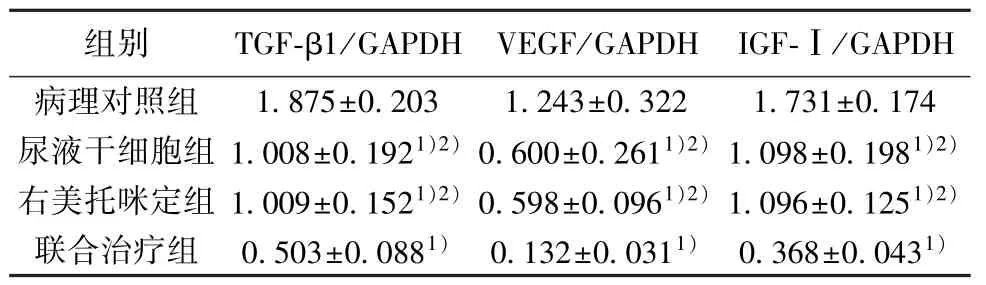
表2 各组肺组织TGF-β1、VEGF 及IGF-Ⅰ基因表达水平比较(,n=5)

图2 肺组织TGF-β1、VEGF 及IGF-Ⅰ基因表达水平
2.4 各组肺组织TGF-β1、VEGF 及IGF-Ⅰ蛋白表达水平比较 病理对照组中大鼠肺脏组织TGF-β1、VEGF 及IGF-Ⅰ蛋白相对表达水平最高(P<0.05);与之相比,其余各组以上指标水平均显著下降,且联合治疗组以上指标水平浓度最低(均P<0.05)。见图3,表3。
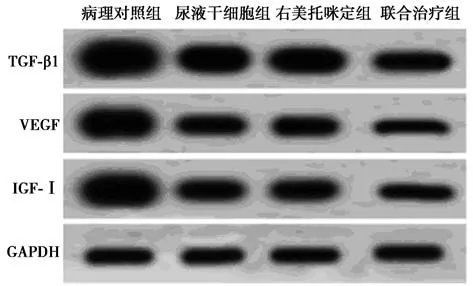
图3 Western 印迹检测肺组织TGF-β1、VEGF 及IGF-Ⅰ蛋白的表达
表3 各组肺组织TGF-β1、VEGF 及IGF-Ⅰ蛋白表达水平比较(,n=5)

表3 各组肺组织TGF-β1、VEGF 及IGF-Ⅰ蛋白表达水平比较(,n=5)
2.5 肺组织病理学变化 各组肺脏中均出现了不同程度的肺气肿。病理对照组肺组织中有较为明显的充血,肺泡中有明显的纤维性浸润且可见肺泡的内衬间隔较厚。尿液干细胞组和右美托咪定组肺气肿显著缓解,可见肺泡内衬间隔显著变薄,充血及纤维性浸润明细减轻;与尿液干细胞组和右美托咪定组相比,联合治疗组肺气肿肺脏组织病理学变化明显改善。见图4。
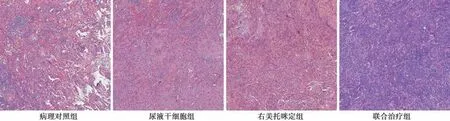
图4 各组肺组织病理学变化(HE,×40)
2.6 尿液干细胞在肺组织中的存活和分布 病理对照组和右美托咪定组中未见有CFSE 标记的尿液干细胞;而在尿液干细胞组和联合治疗组中可以见到有较多的CFSE 标记的尿液干细胞存在。且联合治疗组中的尿液干细胞数目〔(47.42 ±5.63)个/Hp〕显著多于尿液干细胞组〔(31.58±4.24)个/Hp,P<0.05〕。见图5。
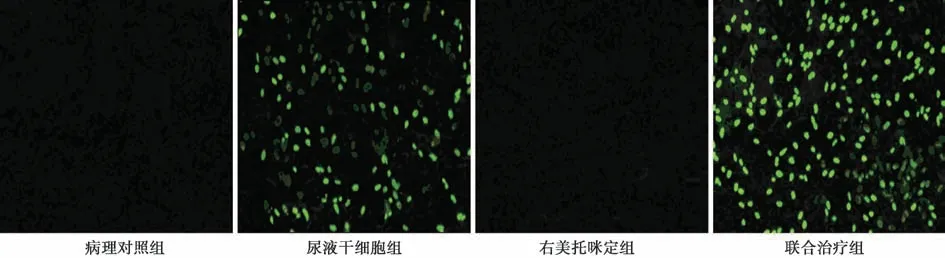
图5 各组荧光显微镜观察CFSE 标记尿液干细胞分布(CFSE,×200)
2.7 肺泡壁细胞凋亡率 病理对照组肺组织中肺泡壁上的细胞凋亡率最高〔(47.10±2.27)%〕,与之相比,右美托咪定组〔(25.53±1.12)%〕和尿液干细胞组〔(26.55±1.14)%〕细胞凋亡率显著下降(均P<0.05);联合治疗组肺泡壁细胞凋亡率进一步下降〔(14.92±0.85)%,P<0.05〕。见图6。
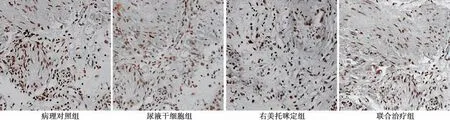
图6 各组肺泡壁细胞凋亡(Tunel,×100)
3 讨论
长期吸烟和慢性炎症反应均会导致肺气肿〔15,16〕。本研究通过烟熏和气管内滴入猪胰弹生蛋白酶的方法成功构建了大鼠肺气肿病理模型。研究显示骨髓间充质干细胞等多向分化细胞移植在缓解肺气肿症状表现优异〔17,18〕。尿液干细胞具有修复肾脏、骨骼和神经损伤的作用〔19,20〕。右美托咪定是临床上常用的镇静镇痛剂,研究发现其对多种干细胞均有促进增殖和诱导分化的作用〔21,22〕。
本研究结果表明单独治疗作用显著改善了肺气肿大鼠的肺脏组织形态学,缓解因损伤造成的细胞凋亡。右美托咪定是临床上常用的镇静镇痛剂,能够通过抑制肺损伤引起的NF-κB、STAT-3 通路的激活进而抑制炎症反应最终起到肺保护作用,故其对肺气肿有保护作用,改善肺部微环境,为尿液干细胞移植后发挥作用提供有利条件,同时研究发现其对多种干细胞均有促进增殖和诱导分化的作用,右美托咪定同时可能缓解并减轻肺部损伤,其通过影响肺部血管收缩和抑制炎症等改善肺部损伤〔23,24〕。尿液干细胞则可能具有向损伤部位归巢并向正常肺脏细胞转化的特性,进而提高肺部损伤的修复效果。本研究结果表明,右美托咪定可能具有提高尿液干细胞增殖和活化的作用。这与右美托咪定在体外诱导干细胞增殖活化的作用较为相似,有待进一步研究探讨。
TGF-β1 具有调节细胞分化生长的功能,而该分子还具有极强的胶原合成促进作用,并可以抑制成纤维细胞的凋亡〔25〕。因此该分子在肺部纤维化和损伤进程中发挥着重要作用。而IGF-1 和TGF-β1在诱导肺部损伤和纤维化进程中具有协同作用〔26~30〕。研究表明,VEGF 在肺部纤维化和肺气肿进程发挥着促进作用〔31〕。本研究显示尿液干细胞移植和右美托咪定输注联合显著降低肺组织和肺泡灌注液中TGF-β1、VEGF 及IGF-Ⅰ的表达水平,这可能是该联合作用改善肺气肿的机制之一。
TGF-β1 有多种生物学效应,不仅对巨噬细胞、中性粒细胞和成纤维细胞等有很强的趋化作用,同时还能刺激肿瘤坏死因子(TNF)-α,白细胞介素(IL)-6,IL-1β 等炎性细胞因子释放导致肺损伤进展,故降低TGF-β1 能够减轻肺损伤〔32〕。研究表明VEGF 持续高表达与大鼠血管内皮细胞损伤有关,而血管内皮细胞的损伤可能是诱发大鼠肺纤维化的重要启动因素之一〔33〕,本研究表明大鼠血管内皮细胞损伤减轻,抑制血管新生,发挥抗肺纤维化作用。IGF-Ⅰ在肺气肿肺纤维化过程中起促进作用。
