牛病毒性腹泻/黏膜病病毒荧光定量PCR检测方法的建立
2022-01-04郭志廷仇正英张景艳王贵波梁芬芬李建喜
张 康,郭志廷,仇正英,张景艳,王 磊,张 凯,王贵波,梁芬芬,马 倩*,李建喜*
(1.中国农业科学院兰州畜牧与兽药研究所/农业农村部兽用药物创新重点实验室/甘肃省新兽药工程重点实验室,甘肃 兰州730050;2.甘肃农业大学动物医学院,甘肃 兰州730050)
0 引言
【研究意义】牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)隶属黄病毒科、瘟病毒属,是一个较大的ORF(开放阅读框)[1−2],主要包括三个部分3′UTR(3′非翻译区)、ORF编码区、5′UTR(5′非翻译区)。5′UTR序列在整个基因系列中具有高度的保守性,根据这组基因的特点设计引物能够在分子水平对BVDV进行诊断,并对其进行病原基因分型[3]。目前BVDV是一种威胁全球养牛业的重要病原体[4]。BVDV能够穿过怀孕母牛的胎盘屏障感染胎儿,从而生出携带有大量病原的持续感染(PI)犊牛[5]。该PI牛通常出生后体弱多病,并且由于其自身免疫系统的损伤,特别容易伴随机会性感染。PI牛在临床上通常出现死亡率极高的迟发型粘膜病[6],严重影响牛群健康,对养殖业造成极大的经济损失[7]。因此控制BVDV感染最有效的手段就是PI牛的早期诊断[8]。【前人研究进展】目前国内外检测BVDV的方法繁多,包括免疫组织化学(IHC)、抗原ELISA、RT-PCR和RT-qPCR以及最近开发的RT-ELISA和交叉引物恒温扩增技术[9]。Driskell等[10]建立检测BVDV的免疫组织化学(IHC)方法,其优点是适合批量临床样本检测,但需要操作熟练的稳定人员和新鲜完整的组织样本;李家伟等[11]建立牛病毒性腹泻病毒LAMP检测方法,其优点是可现场操作,但极易出现假阳性;范晴等[12]与胡俊英等[13]建立的牛病毒性腹泻病毒抗原ELISA检测方法,其包被蛋白暂不能批量生产满足临床检测需求;王荣等[14]提出的使用实时荧光定量RT-PCR检测BVDV的方法不如探针技术敏感性高。而我国诊断BVDV国家标准技术规定首先采用培养细胞分离病毒的方法,其分离鉴定法主要通过接种牛肾细胞,一般需传至1~3代左右才能出现明显病变,具备分离条件的实验少,因此不适用批量检测临床样本[15]。【本研究切入点】以上每个检测方法在灵敏度、成本和耗时方面都存在着优缺点。而荧光定量PCR(real-time PCR)技术是一种能够实时、快速、敏感、准确地检测病毒在体内的分布及变化且能克服其他方法检测不足的技术,因此在病原诊断、病原定量检测及抗病毒机制等方面得到了广泛应用[9,16]。应用荧光定量PCR方法诊断牛病毒性腹泻病毒的研究尚待深入探讨。【拟解决的关键问题】本研究对GenBank提交的BVDV 5′UTR基因序列进行比对,对TaqMan通用探针、BVDV的引物进行改造、设计,以期创建具有灵敏度高、特异性强、能够相对定量且快速便捷的检查方法,为兽医工作者研究和快速诊断牛病毒性腹泻病毒提供技术支持。
1 材料与方法
1.1 病毒和样品
从中国兽医药品监察所购进BVDV阳性样品,编号为CVCC AV67,存放于中国农业科学院兰州畜牧与兽药研究所兽医室实验室。牛传染性鼻气管炎病毒(IBRV)疫苗购自金宇保灵生物药品有限公司,口蹄疫病毒(FMDV)灭活疫苗购自中农威特生物科技股份有限公司,猪瘟病毒(CSFV)疫苗、猪繁殖与呼吸障碍综合征病毒(PRRSV)疫苗购自青岛易邦生物工程有限公司。从甘肃、青海和陕西等省份的奶牛养殖户中收集到65份临床症状疑似受牛病毒性腹泻病毒感染的腹泻牛粪便样品(兽医根据腹泻牛体格瘦小、抵抗能力差、免疫力低下和使用抗生素治疗无效等筛选出疑似BVDV感染牛进行采样)。
1.2 主要仪器及试剂
荧光定量PCR仪,紫外分光光度计,凝胶成像仪;Dnase-FreeRNase,Rnas-Free DnaseI,T7 RNA Polymerase,MaximaH M inus First StrandcDNA Synthesis Kit;2×EsTaqMasterM ix;病 毒DNA/RNA提取试剂盒、DNA琼脂糖胶回收试剂盒、EasyPURE RNA Purification Kit、One Step PrimeScript TM RT-PCR Kit购自宝生物工程(大连)有限公司。
1.3 引物设计和合成
引物的设计登录NCBI从GenBank下载BVDV 5′UTR保守区域基因序列,使用MegA lign软件对其进行对比,选择其相对保守位置,利用Oligo6.0进行分析,设计2对特异性引物(标准品引物A-F/BR和定量引物Q-F/Q-R)和1条探针,其中标准品上已加有T7启动子,下游引物加有多聚T尾巴(表1),均由宝生物工程(大连)有限公司合成。
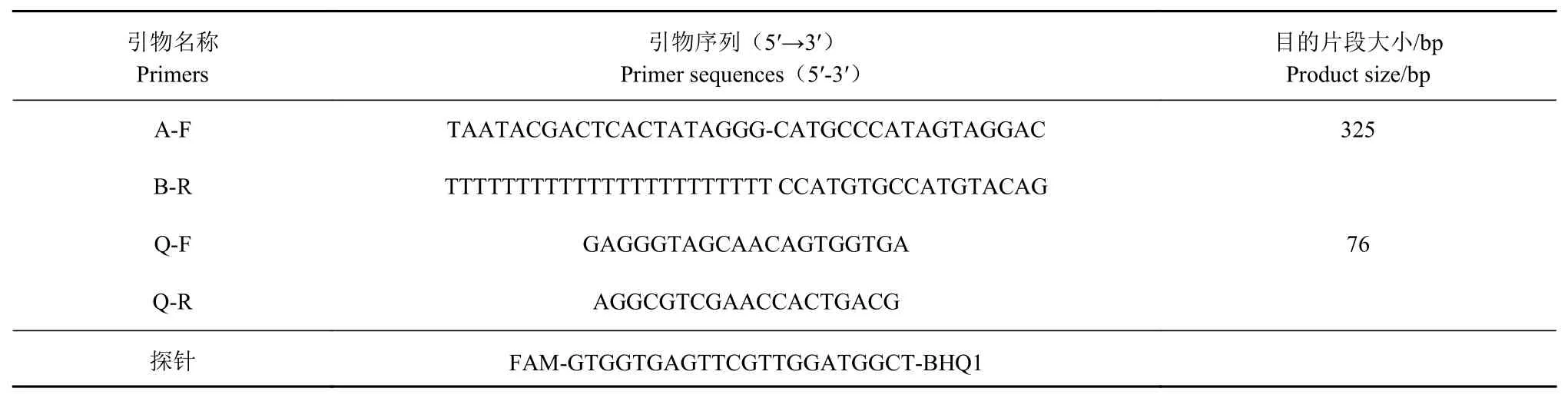
表1 引物和探针Table 1 Prim ersand probesapp lied
1.4 样品RNA的提取
按照试剂盒中的说明书进行操作,样本中提取总RNA,置于-20 ℃环境保存备用。
1.5 阳性标准品的制备
以阳性样品提取的RNA 作为模板进行RNA反转录,以引物A-F和B-R作为扩增引物进行PCR产物的扩增,依照胶回收试剂盒的说明对其进行操作,可以得到纯化回收目的片段,之后按照T7RNA Polymerase相关说明,对其转录进行操作,转录后纯化所得到的产物即为体外转录所制备的标准品。
1.6 荧光定量PCR方法的建立
以BVDV的阳性标准品作为模板建立荧光PCR方法,配制的荧光PCR反应体系包括以下组分:2×One Step RT-PCR Buffer III反应液10μL,TaKaRa ExTaqHS反应液0.4μL,PrimeScript RT Enzyme M ix II反应液0.4μL,上游引物(10μmol·L−1)和下游引物(10μmol·L−1)各0.4μL,荧光探针(5μmol·L−1)0.8μL,RNA标准品2μL,用ddH2O补充至20μL,扩增条件为:温度45℃时间5m in,95℃10 s,40个扩增循环(95℃5 s、60℃20 s)。
1.7 标准扩增曲线的建立和敏感性试验
将标准品RNA模板浓度分别进行10倍倍比稀释,以5.0267×109copies·μL−1为 起 始 浓 度 稀 释 到5.0267×10−1copies·μL−1,之后按照其相关要求对其进行稀释,不同稀释度核酸作为模板进行PCR扩增,将相关标准浓度的Ct值作为纵轴指标,以稀释倍数所计算得到的对数作为横轴指标,画出其标准曲线。在这个曲线基础上得到荧光定量PCR的敏感程度以及最小测定值。
1.8 特异性试验
按照上述的手段对其FMDV、BVDV、IBRV、CSFV、PRRV的DNA/RNA模板进行扩增,对其定量PCR反应指标进行观察,对特异性进行评价。
1.9 重复性试验
将得到的已知浓度BVDV阳性标准品按照10−2、10−3、10−4、10−5以及10−6的比例进行稀释,然后进行组间与组内重复试验,在进行组内试验的过程中,需要将每一个标准使用同一种方法重复3次;在进行组间试验时,需要在不同的时间使用这一方法重复3次,针对测定的结果对其进行分析,来评估本次研究的价值,能否将结果复现。
1.10 荧光PCR方法的应用
使用已经获得的荧光定量PCR方法,对临床收集到的65份标本(这些标本均为怀疑为牛病毒性腹泻病毒感染的牛粪便)进行扩增,出现了阳性结果并对本次研究的可行性程度进行评估。
2 结果与分析
2.1 BVDV标准品引物的特异性扩增结果
按照相关说明书对其病毒RNA进行扩增操作,产物经1.0%琼脂糖凝胶电泳,对其进行测定,获得了分子量为325 bp左右的条带(图1)。
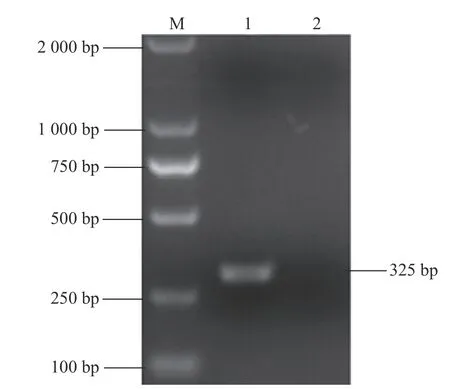
图1 标准品引物扩增产物Fig.1 Am p lification productsof RNA standard primers
2.2 标准品RNA纯度分析结果
紫外分光光度计测定结果显示,标准RNA原液的D260/D280值达到1.92,其质量浓度达到35.70mg·L−1。
2.3 荧光定量PCR方法的建立和特异性试验
将BVDV阳性核酸作为模板,对其进行扩增,最终得到了S形曲线,同时用建立的荧光探针方法对FMDV、IBRV、CSFV和PRRS病毒进行扩增,上述样品都没有得出特异性条带,这就证实这一检测手段对BVDV有较好的特异性,但对遗传物质比较类似的病毒并没有出现相关的反应(图2)。
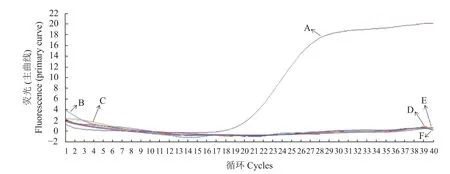
图2 荧光定量PCR方法特异性试验Fig.2 Specificity of RT-PCR assay
2.4 荧光定量PCR方法的标准曲线和敏感性试验
将BVDV阳 性 核 酸(含 量 为5.026 7×109copies·μL−1)10倍稀释后进行扩增(表2),其数据表明,由于模板拷贝数不断减少,Ct值逐渐上升,当稀释达到10−1、10−2、10−3、10−4、10−5、10−6、10−7、10−8和10−9时,Ct值 分 别 为11.17、13.48、18.68、21.43、24.13、28.44、31.22、35.16和37.69,为S形曲线,但达到10−10时,则不显示曲线。这表明本方法的检测极限是样品的10−9稀释倍数,即阳性标准品的浓度为5.026 7 copies·μL−1(图3)。以10−2、10−3、10−4、10−5、10−6、10−7和10−8等不同浓度的反对数作为横轴,以对应的Ct值作为纵轴制作标准曲线(图4),可以得到相关的回归方程:y=3.468 9x+7.303 9,相关系数R2=0.993 8,这说明Ct值与拷贝数之间呈现非常强的线性关系,表明该方法稳定性好,意味着无论待检样品的模板浓度高低,用该方法进行检测都可以得到较好的试验结果。
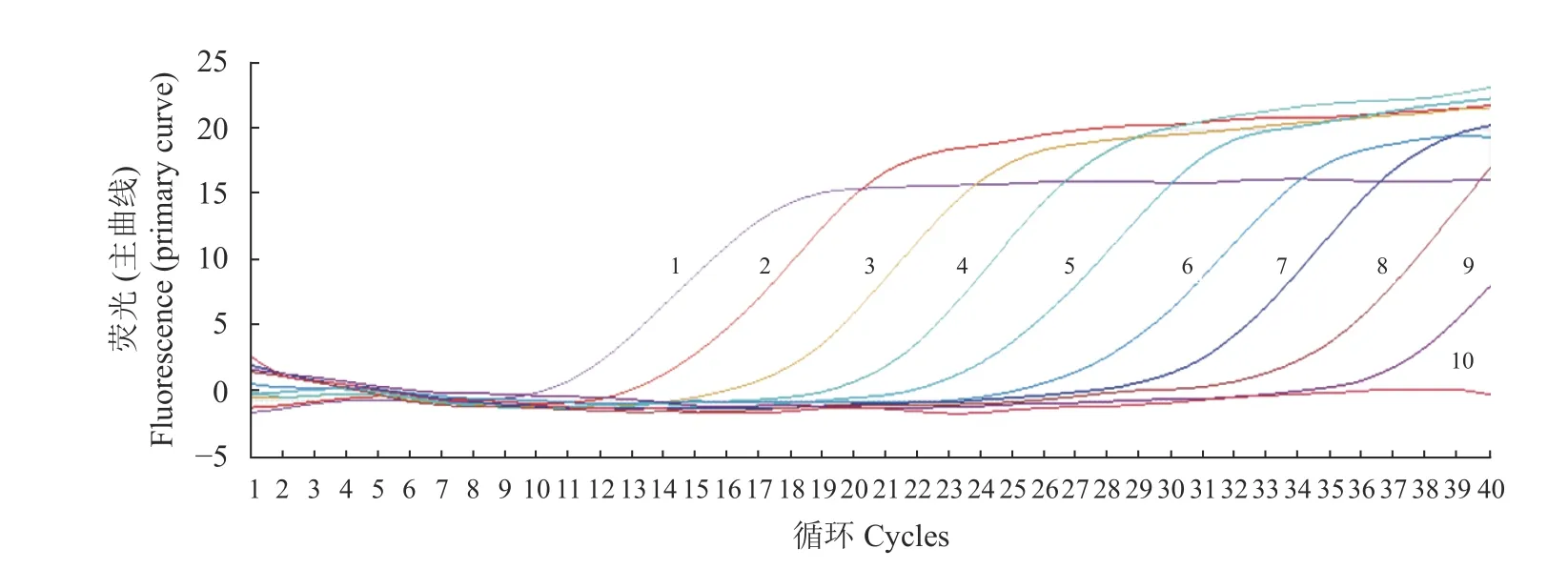
图3 荧光定量PCR敏感性试验Fig.3 Sensitivity of RT-PCR assay
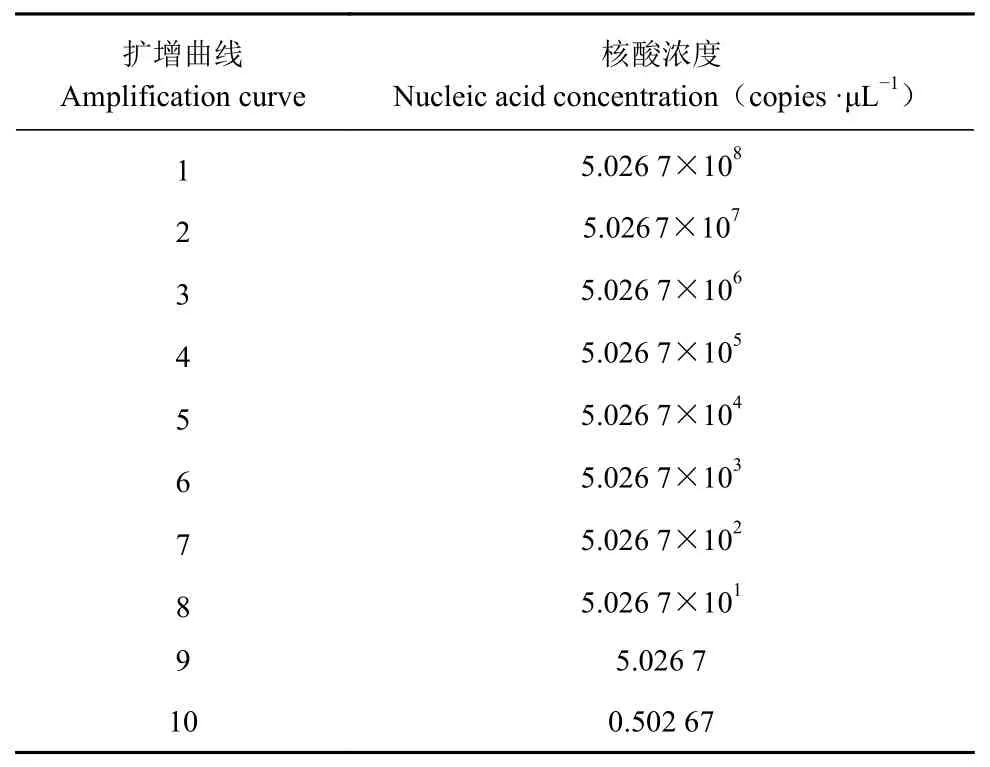
表2核酸浓度Tab le 2 Nucleic acid concentration
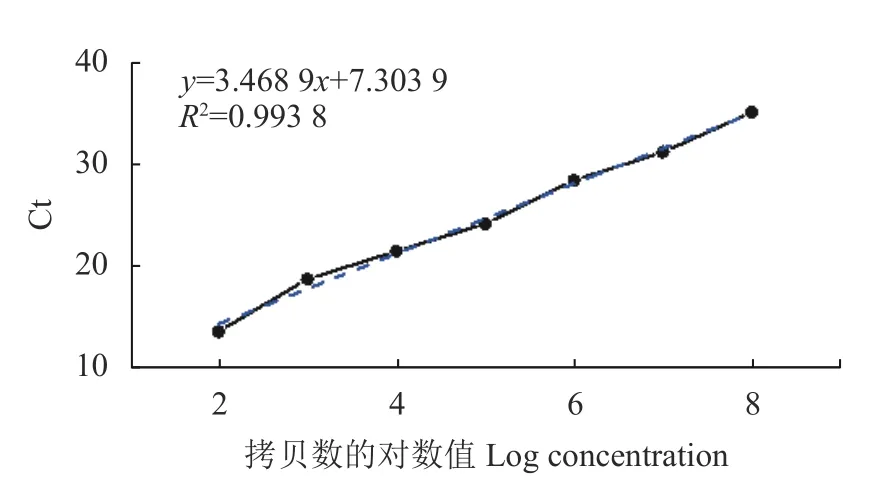
图4 荧光定量PCR标准曲线Fig.4 Standard curve for RT-PCR assay
2.5 荧光PCR方法的重复性
获取以 上的稀释 倍数10−4、10−5、10−6、10−7和10−8的模板对其进行重复性研究,结果表明,组内重复试验的变异系数(CV)平均为0.77%±0.13%,组间重复试验的变异系数(CV)平均为0.90%±0.67%,这表明本方法的重复性较好,结果详见表3和图5。
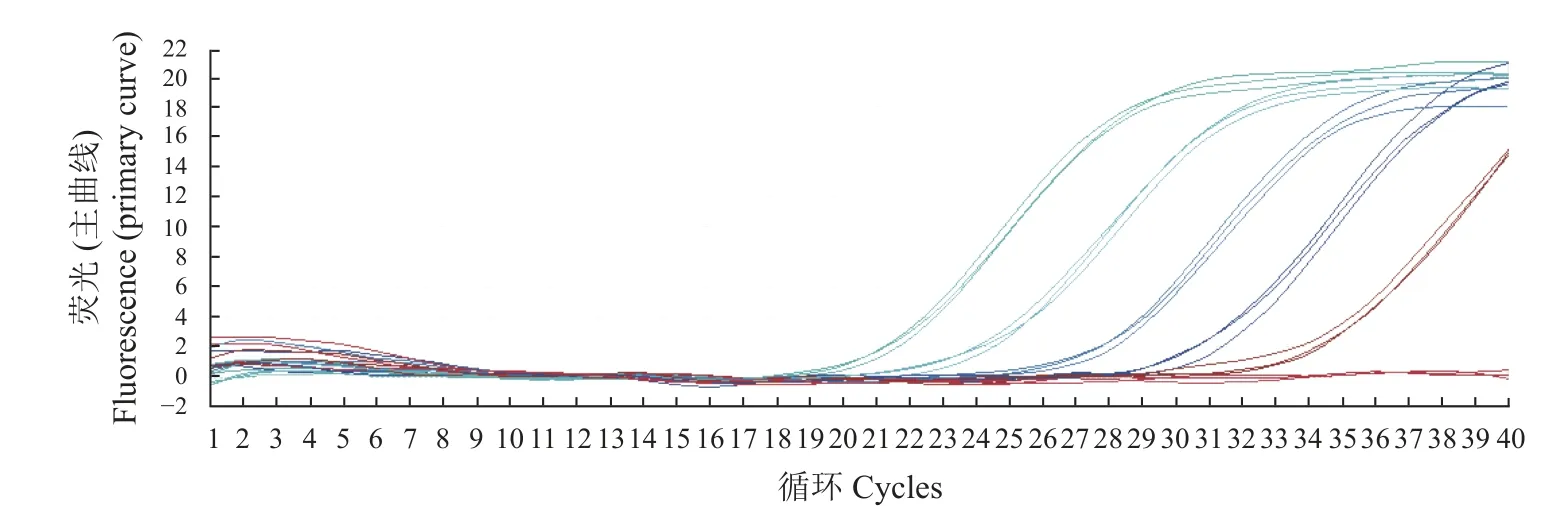
图5 荧光定量PCR重复性Fig.5 Reproducibility of RT-PCR assay
2.6 荧光定量PCR方法的应用
用建立的荧光PCR方法对65份腹泻牛肛门拭子样品进行检测,共有4份样品得到了S型曲线(图6),与阳性数据相符,说明这一方式是可行的,在实际中可以使用到该疾病的流行病学监测以及筛查PI牛等方面。
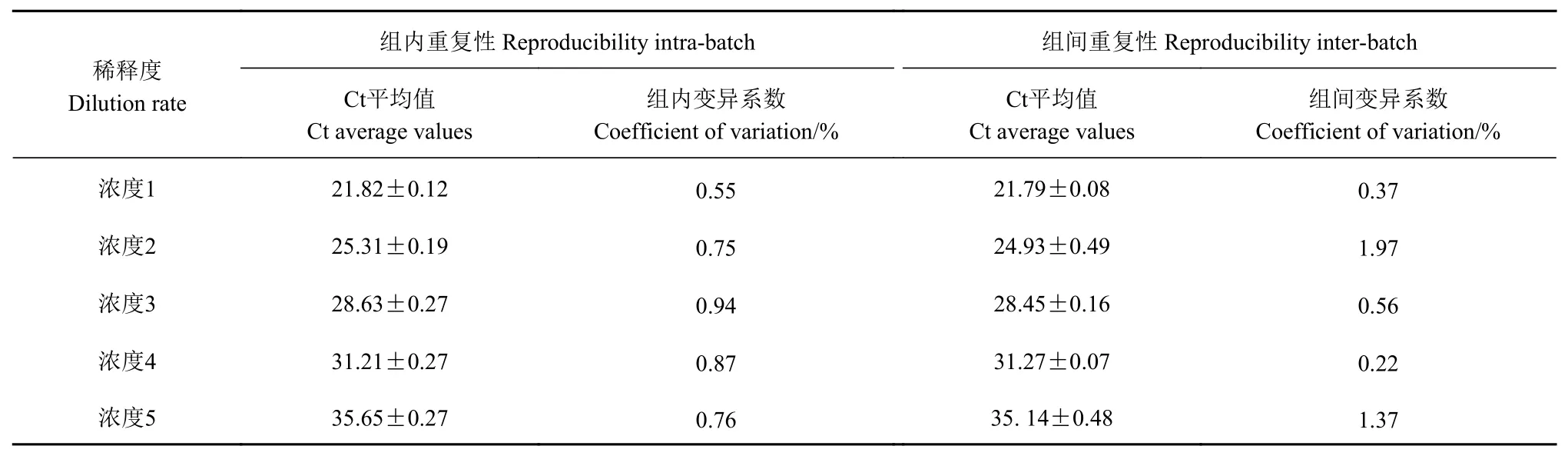
表3实时荧光定量PCR方法的变异系数Table3 Coefficientsof variation between inter- and intra-groupsof RT-PCR assay
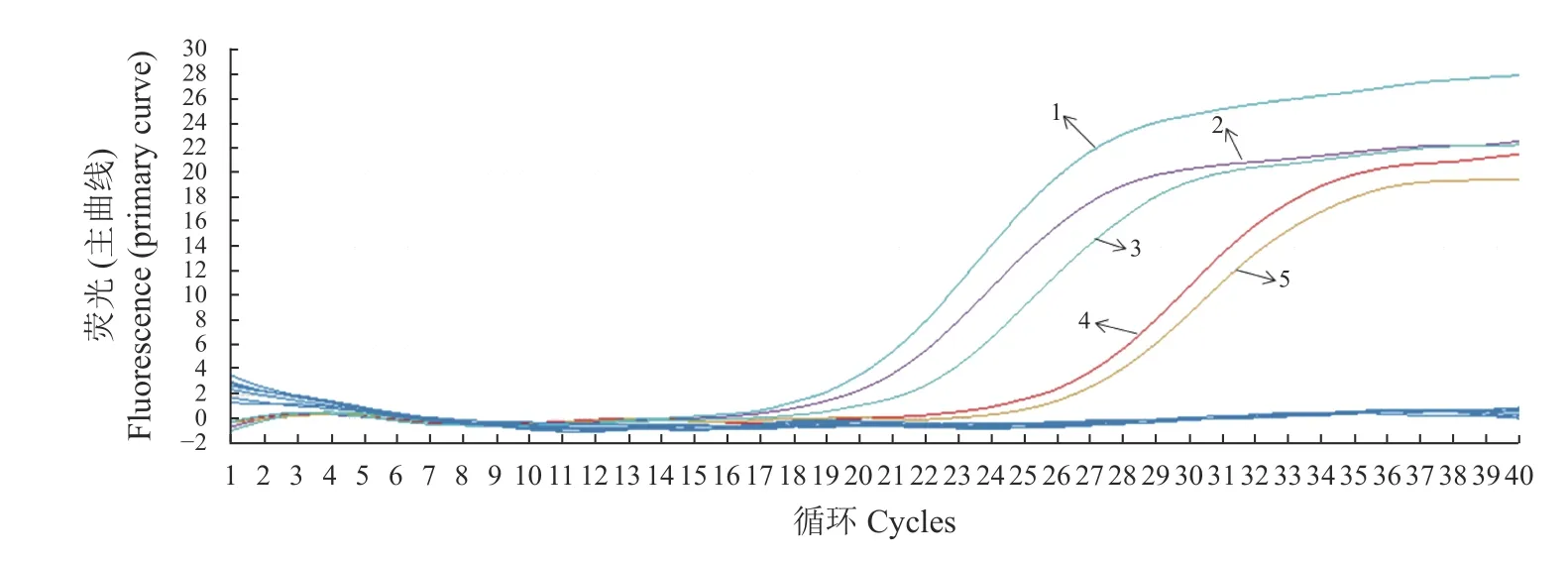
图6 荧光定量PCR方法的应用Fig.6 App lication of RT-PCR assay
3 讨论与结论
早期筛查PI牛是控制该病毒传播的重要措施之一。ELISA检测技术一直被广泛用于检测血液、血清、乳汁、鼻腔和口腔棉拭子中BVDV抗体水平,根据抗体水平判定是否为PI牛,而ELISA往往由于母源抗体的影响造成检测失败[17]。因此近年来国内外研究人员越来越多地利用荧光定量PCR技术检测BVDV,不仅因为其灵敏度高,最重要的原因是能够在早期诊断鉴定PI牛,为此本试验以GenBank中提交的BVDV 5′UTR基因序列进行比对,设计相关的PCR检测方法。
通过特异性、重复性以及敏感性试验,本试验建立的BVDV TaqMan实时荧光定量RT-PCR检测方法,对FMDV、BVDV、IBRV和PRRS等病毒无特异性扩增。该方法灵敏度高,对病毒检测的最低检测灵敏度可达到5.026 7 copies·μL−1,敏感性优于常规的RT-PCR[18];稳定性好,标准曲线相关系数是0.99 6;重复性较好,同一时期组内和不同时期组间变异系数均小于1.0%。
本试验建立的荧光定量PCR方法与常规PCR检测方法相比不需在反转录后再次向反应混合物中添加任何试剂,仅在一支PCR反应管中操作,直接由RNA定量RNA,提高了操作效率,而且减少了开管次数从而有效降低外界其他基因污染的风险[19−20]。
本试验显示该方法专一测定这一病毒,因此该方法既可以用于临床早期发现PI牛,又可以检测细胞中BVDV的增殖情况,这为研究细胞水平上药物抗BVDV及其分子机制提供了检测手段。
