新疆牛、羊和骆驼源产志贺毒素大肠埃希菌的系统进化分群、血清群与毒力基因及耐药性分析
2021-12-31佟盼盼张萌萌陈文霞刘璐瑶唐雪林苏战强谢金鑫
佟盼盼,张萌萌,陈文霞,刘璐瑶,张 凌,唐雪林,苏战强,谢金鑫
(新疆农业大学动物医学学院,乌鲁木齐 830052)
产志贺毒素大肠埃希菌(Shiga toxin-producingE.coli,STEC)是全球公认的食源性致病菌,人类感染后可引起无血性腹泻、出血性结肠炎(hemorrhagic colitis,HC)、溶血性尿毒症综合征(hemolytic uremic syndrome,HUS)及血小板减少性紫癜(thrombocytopenic purpura,TTP)等[1],不同毒力基因的组合与致病力密切相关[2]。
STEC的主要毒力因子志贺毒素(Shiga toxin,Stx)由噬菌体上的stx编码,可抑制宿主细胞蛋白质的合成,包括stx1和stx2,其中stx1基因由3个亚型(stx1a、stx1c和stx1d)组成,stx2基因由7个亚型(stx2a~stx2g)组成[3]。不同亚型或亚型组合可能与疾病的严重程度有关[3-4]。流行病学研究表明,产生stx2a-、stx2c-和stx2d-的STEC菌株往往比携带其他stx亚型的菌株更频繁地从HC和HUS患者中分离出来[5]。另一个重要的毒力因子紧密黏附素由其毒力岛LEE上的eae基因编码,介导细菌定殖和黏附到宿主肠细胞上,在发病机制中发挥重要作用[6]。此外,溶血素基因(hlyA)也与STEC的致病性密切相关,常与腹泻病和HUS相关[7-8]。这些毒力因子以单一或多种组合形式构成一种特定病原体的毒力特征。
STEC主要通过粪-口途径传播,食用未经煮熟的肉制品、未洗净的蔬菜和未经巴氏灭菌的乳制品是人类感染STEC的最主要途径[9-10]。2017年,欧盟报告了6 073例STEC感染病例,据分析,相较于O157非O157血清群感染比例有所增加[11]。牛是STEC的天然宿主,但研究发现羊、骆驼等反刍动物也是STEC的携带者[12-13]。在国内,有关非O157 STEC在牛、牦牛和绵羊上流行的报道较多,而关于骆驼源分离株的报道尚不多见[14-16]。本研究收集牛、羊和骆驼源非O157 STEC菌株,对其进行大肠埃希菌系统进化分群、血清群、毒力基因及耐药性分析,评估这些STEC潜在的风险,为STEC监测和分子流行病学研究提供数据支持。
1 材料与方法
1.1 菌株
2018—2019年,从新疆乌鲁木齐、阿勒泰、伊犁、哈密、巴音郭楞蒙古自治州(巴州)、阿克苏、喀什及和田的养殖场、屠宰场和市场收集牛、羊和骆驼粪便、肛拭子和胴体样品共2 312份,经分离鉴定获得94株非O157 STEC(表1),用含有终浓度15%甘油的生理盐水保菌,并储存于-80 ℃,从最初分离限次传代以确保其遗传稳定性。
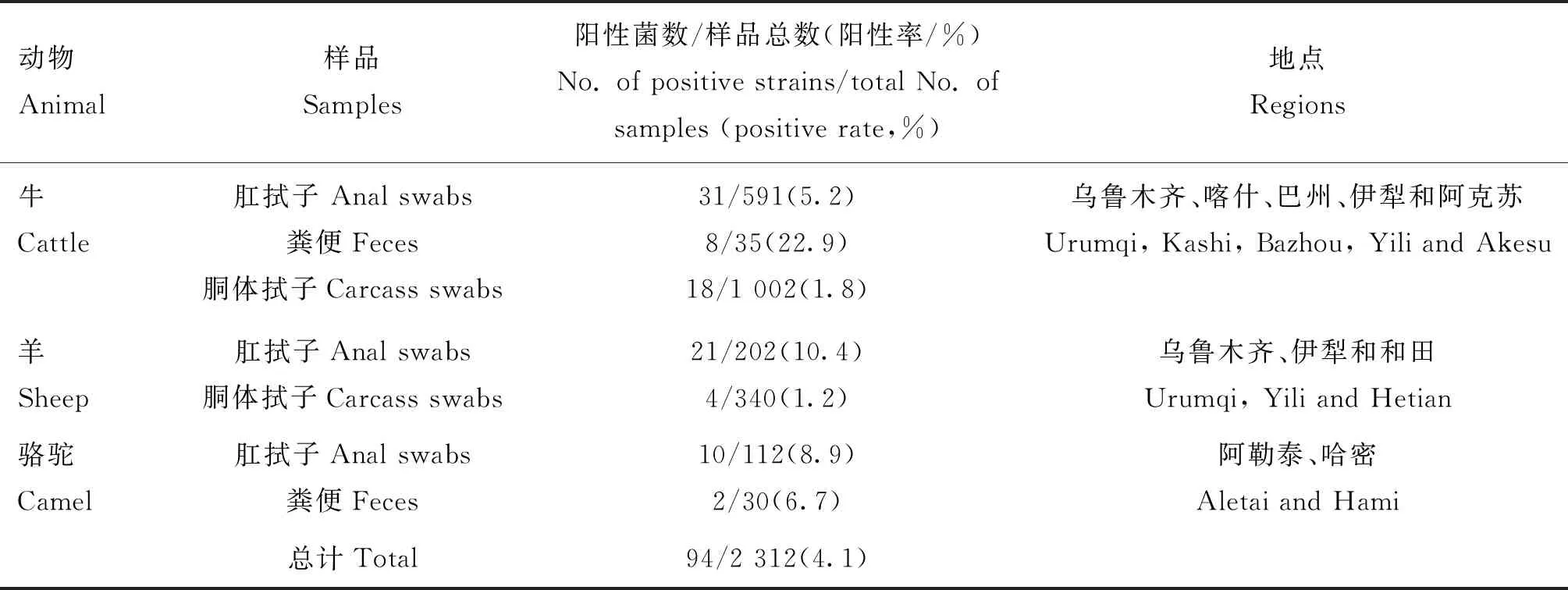
表1 94株牛、羊和骆驼源非O157 STEC分离株的背景信息Table 1 Background information of 94 non-O157 STEC isolates from cattle,sheep and camels
1.2 主要试剂
Thermo PCR反应试剂(2×Taq PCR Green Mix)和Gelgreen(Biotium)购自北京鼎国昌盛生物技术有限责任公司;药敏片购自杭州滨和微生物试剂有限责任公司;EC肉汤、脑心浸液肉汤(BHI)、麦康凯培养基(MAC)、MH肉汤和MH琼脂购自青岛海博生物科技有限公司;药敏质控标准菌株大肠埃希菌ATCC 25922由本实验室保存。系统进化分群、血清群及毒力基因引物均由上海生工生物工程科技服务有限公司合成。
1.3 系统进化分群
将保存的STEC在BHI中复苏,划线接种MAC平板,37 ℃培养16~18 h,取单菌落煮沸裂解制备DNA。按照Clermont等[17]报道的方法对非O157 STEC分离株进行系统进化群(A、B1、B2、C、D、E和F)。第一步是四重PCR扩增chuA、yjaA、arpA、TSPE4.C2基因片段,根据结果分为A或C、D或E、B1、C、F、B2和E群。当四重PCR不能区分A和C或D和E群时,通过第二步PCR扩增trpAgpC或ArpAgpE基因片段进一步确定C或E群。
四重PCR反应体系:12.5 μL Taq Master Mix,1 μL细菌DNA模板,上、下游引物(10 μmol·L-1)各0.5 μL,加入ddH2O至25 μL。反应程序:95 ℃预变性5 min;94 ℃ 10 s,57 ℃(E群)或59 ℃(四重组和C群)20 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
1.4 O血清群鉴定
参照文献[18]采用多重PCR(E.coliO-genotyping PCR)筛选O血清群,用162对引物建立20个多重PCR组(6~9对引物/组),扩增条带大小明显不同。PCR混合物包含10 μL 5 × GoldStar PCR Buffer,1 μL 10 mmol·L-1dNTP Mix,2.5 U GoldStar Best DNA聚合酶,每条引物(10 μmol·L-1)0.5 μL,3 μL 细菌DNA模板,加入ddH2O至50 μL。反应程序:95 ℃预变性5 min;94 ℃ 30 s,57 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
1.5 毒力基因检测
参考文献[19]报道的序列和PCR条件,合成毒力基因eae和hlyA引物,以两种基因各自测序菌株为阳性对照,以大肠埃希菌ATCC 25922为阴性对照。PCR产物经1%琼脂糖凝胶电泳检测,将eae和hlyA阳性扩增产物送至上海生工生物工程有限责任公司进行测序,通过BLAST分析测序结果并统计各菌株毒力基因的携带情况。
1.6 志贺毒素基因亚型检测
采用Scheutz等[3]所述的PCR方法检测stx1和stx2基因亚型,包括stx1a、stx1b、stx1c、stx2a、stx2b、stx2c、stx2d、stx2e、stx2f、stx2g。以10种基因各自测序菌株为阳性对照,以大肠埃希菌ATCC 25922为阴性对照。三重PCR扩增stx1亚型,反应体系:12.5 μL Master mix,stx1a、stx1c和stx1d上、下游引物(10 μmol·L-1)各0.5 μL,1.5 μL细菌DNA模板,加入ddH2O至25 μL。多重PCR扩增stx2亚型,包括10 μL 5×GoldStar PCR Buffer,1 μL 10 mmol·L-1dNTP Mix,2.5 U GoldStar Best DNA聚合酶,每条引物(10 μmol·L-1)0.5 μL,2 μL细菌DNA模板,加入ddH2O至50 μL。反应程序:95 ℃预变性3 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸10 min。为明确同时携带stx23个亚型的菌株,在66 ℃下进行PCR验证。
1.7 药物敏感性试验
参照CLSI标准[20],以大肠埃希菌ATCC 25922为质控菌株,采用K-B纸片法对94株STEC进行药物敏感性检测。18种药敏片:氨苄西林、哌拉西林、头孢噻肟、头孢他啶、头孢吡肟、氨曲南、阿莫西林/克拉维酸、哌拉西林-他唑巴坦、氨苄西林-舒巴坦、庆大霉素、阿米卡星、复方新诺明、氯霉素、左氧氟沙星、环丙沙星、链霉素、四环素和多黏菌素B。将菌株接种于MH平板,37 ℃,培养16~18 h。挑取单菌落接种于2 mL MH培养基中,37 ℃,培养4~5 h。无菌棉签蘸取菌液均匀涂布在MH平板上,用灭菌镊子夹取药敏片贴于平板上,倒置,37 ℃,培养16~18 h,记录结果。根据药敏试验结果,将对三类(每类中一种或以上)或三类以上抗菌药物同时耐药的菌株判定为多重耐药菌[21]。
1.8 ERIC-PCR基因分型
根据Versalovic等[22]报道的方法合成ERIC-PCR引物,对不同动物相同O血清群STEC进行PCR扩增。反应体系:12.5 μL Taq Master Mix,上、下游引物(10 μmol·L-1)各0.5 μL,1 μL细菌DNA模板,加入ddH2O至25 μL。反应程序:94 ℃预变性3 min;94 ℃ 30 s,56.5 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃延伸10 min。
1.9 菌株同源性判断
采用BioNumerics软件进行UPGMA(unweighted pair group method using arithmetic averages)聚类分析,条带位置差异容许度选择1.5%。优化值选择1.5%。如果相似性指数≥85%,则认为菌株具有遗传相关性[23]。
1.10 数据分析
采用IBM SPSS Statistics 21.0进行数据分析。单因素分析采用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
2 结 果
2.1 菌株的系统进化分群
94株非O157 STEC系统进化分群可分为3群,分别为B1群(83/94,88.3%)、E群(7/94,7.4%)和A群(4/94,4.3%)。牛、羊及骆驼源分离株均以B1群为主(牛源52/57,91.2%;羊源24/25,96.0%;骆驼源7/12,58.3%),E群主要为骆驼源STEC(5/7,71.4%),4株A群属于牛源分离株。
2.2 菌株的O血清群鉴定
94株STEC中未检测出O157血清群,其中37株 可确定O血清群,占分离株的39.4%,共检出9个血清群,包括O146(n=14)、O22(n=7)、O3(n=4)、O168(n=4)、O8(n=3)、O167(n=2)、O88(n=1)、O112ab(n=1)和O147(n=1)。
2.3 菌株的毒力基因及志贺毒素基因亚型检测
部分STEC的毒力基因及stx基因亚型检测结果如图1所示。
在94株STEC分离株中,46.8%(44株)仅携带stx1,6.4%(6株)仅携带stx2,46.8%(44株)同时携带stx1+stx2;80.9%(76株)携带hlyA,9.6%(9株)携带eaeA(表2)。羊源和骆驼源STEC均以携带stx1+hlyA为主(分别为68.0%和25.0%),牛源STEC以携带stx1+stx2+hlyA为主(57.9%)。毒力基因组合stx1+stx2+eaeA(1株)和stx2+eaeA+hlyA(1株)仅存在于骆驼源STEC。1株牛源和2株骆驼源STEC携带stx1+stx2+eaeA+hlyA(表3)。

表2 非O157 STEC毒力基因及亚型检测结果Table 2 Virulence genes and subtypes of non-O157 STEC
stx基因亚型检测结果显示,牛、羊和骆驼携带的stx基因亚型包括stx1a、stx1c、stx2a和stx2d(图1c~f)。stx1a主要分布在牛源STEC中,与骆驼源相比,差异显著(P<0.05)。stx1c主要分布在羊源STEC中,骆驼源次之,牛源最少,三者之间相比,差异显著(P<0.05)(表3)。
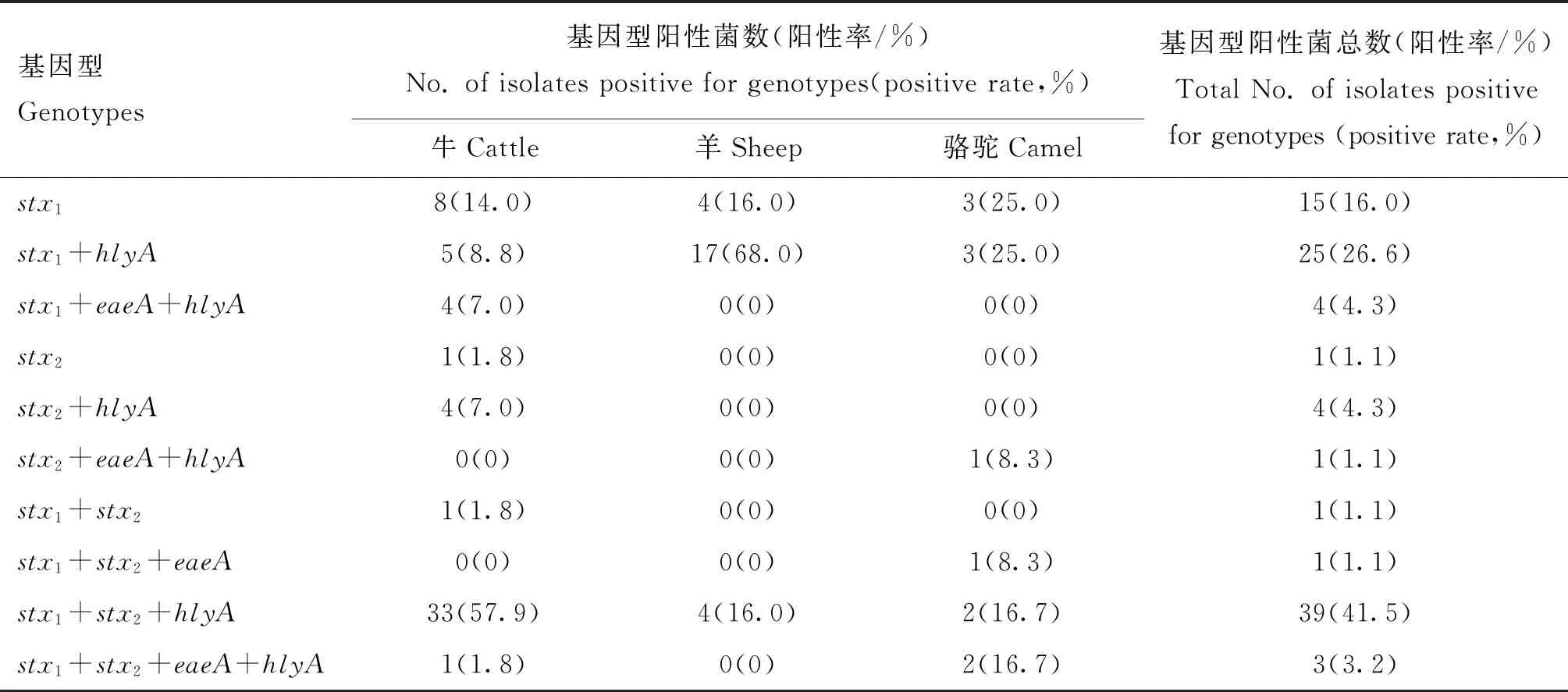
表3 非O157 STEC的毒力基因谱Table 3 Virulence gene profiles of non-O157 STEC
2.4 菌株的药物敏感性测定
药敏试验结果表明,94株非O157 STEC中14株(14.9%)为耐药菌(表4)。对头孢他啶、四环素、头孢噻肟、氨苄西林、氨曲南的耐药率为3.2%~5.3%,对复方新诺明、头孢吡肟、哌拉西林-他唑巴坦、氨苄西林-舒巴坦、阿莫西林-克拉维酸、多黏菌素B的耐药率为1.1%~2.1%。未检测出多重耐药菌,但有2株对β-内酰胺类抗生素的多个药物耐药。
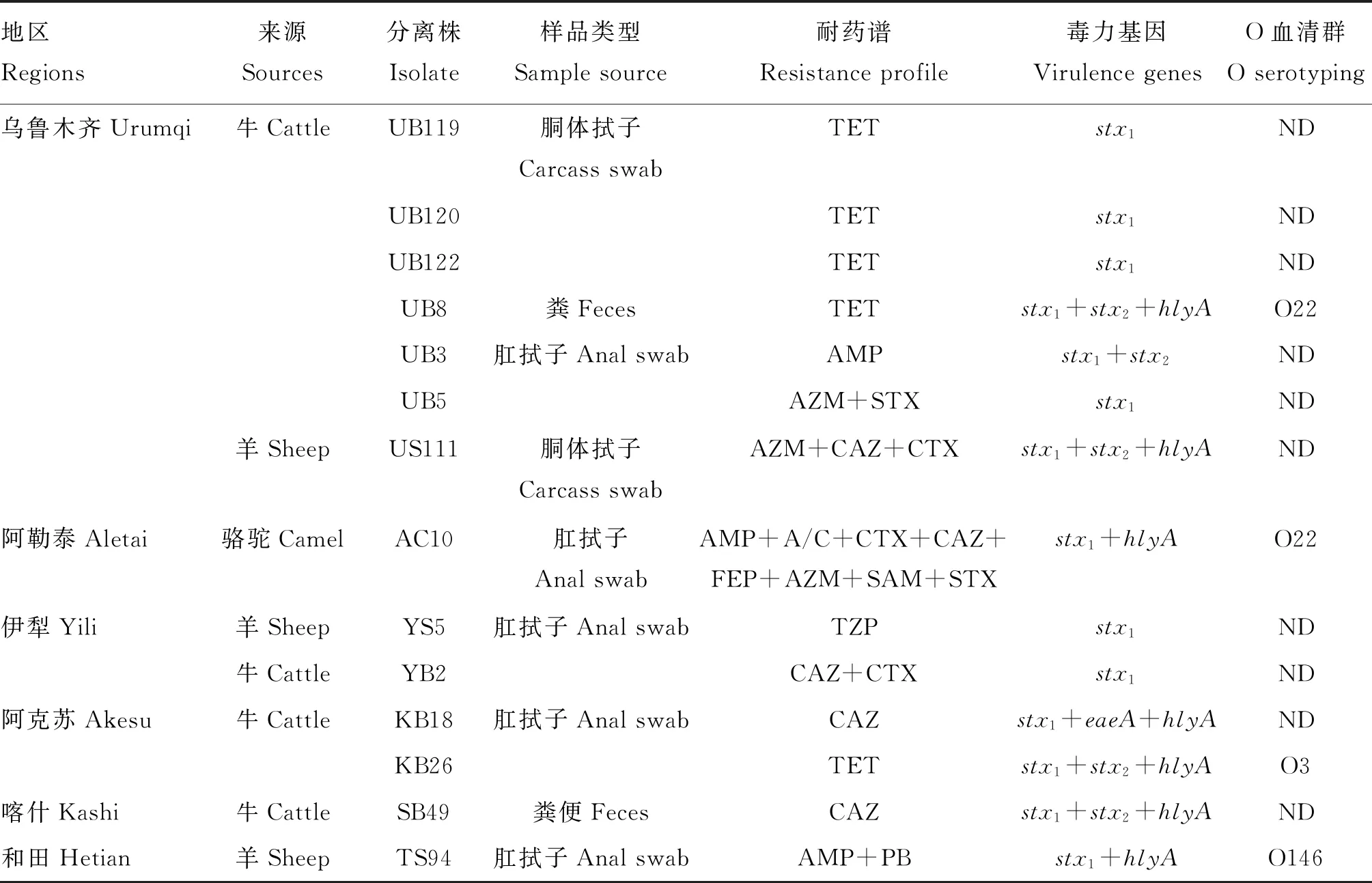
表4 14株非O157 STEC的耐药表型Table 4 Drug resistance phenotypes of 14 non-O157 STEC isolates
2.5 菌株的ERIC-PCR基因分型结果
对24株血清群为O8、O22和O146的牛、羊和骆驼源STEC进行ERIC-PCR基因分型,可分为A、B和C3簇,以B簇为主,各簇之间相似性指数≥ 85%,亲缘关系较近(图2)。不同地区相同或不同动物源的菌株存在相同的指纹图谱,如YS10(羊)和TS12(羊),AC10(骆驼)、UB18(牛)和YS10(羊)。同一地区从牛场粪便、肛拭子到胴体拭子来源的菌株也存在相同的指纹图谱。如UB8(粪便)、UB40(肛拭子)和UB12(胴体拭子)。

a.hlyA;b.eaeA;c.stx1a;d.stx1c;e.stx2a;f.stx2d;1~3.STEC分离株;4.阳性对照;M.DL2000 DNA相对分子质量标准;N.阴性对照a.hlyA;b.eaeA;c.stx1a;d.stx1c;e.stx2a;f.stx2d;1-3.STEC isolates;4.Positive control;M.DNA marker;N.Negative control图1 hlyA、eaeA、stx1a、stx1c、stx2a和stx2d基因PCR扩增产物Fig.1 PCR products of hlyA,eaeA,stx1a,stx1c,stx2a and stx2d genes
3 讨 论
本研究对新疆牛、羊和骆驼源非O157 STEC进行了相对全面的分析。系统进化分群显示牛、羊和骆驼源非O157 STEC均以B1群为主,这与国外报道的牛、羊和骆驼源非O157 STEC的分群结果一致[21-23]。本研究共鉴定出9个血清群,其中5个血清群O8、O22、O88、O147和O167分布于骆驼源STEC,表明骆驼源STEC携带的O血清群更多样化。在牛上经常发现O血清群未知的STEC[24],本研究中O血清群未知的STEC也主要集中于牛源分离株(71.9%,41/57)。据2017年欧盟的报告显示,在羊源STEC中O157、O146和O38血清群最为常见,其中O157、O146可引起人类感染[11],本研究中羊源STEC以O146血清群为主,应引起足够的重视。薛涛等[14]在江苏某牛场发现STEC分离株的优势血清型为O4、O26和O93,顾丛丛等[16]在江苏某羊场发现STEC分离株的优势血清型为O93,表明不同省份动物源STEC携带优势O血清型不同。

TET.Tetracycline;AMP.Ampicillin;TZP.Piperacillin-Tazobactam;CAZ.Ceftazidime;AZM.Ammonia-tronan;STX.Cotrimoxazole;CTX.Cefotaxime;PB.Polymyxin B;A/C.Amoxicillin-Clavulanate;FEP.Cefepime;SAM.Ampicillin-Sulbactam图2 非O157 STEC的ERIC-PCR 基因分型及UPGMA聚类分析Fig.2 Results of ERIC-PCR genotyping and UPGMA clustering of non-O157 STEC
STEC的致病性及其导致的临床症状与毒力基因密切相关[25]。临床上经常从腹泻或HUS患者中分离到同时携带eae和stx2基因的STEC,eae基因与引起人类HUS疾病的STEC菌株关系密切[24]。本研究中1株骆驼源STEC同时携带eae和stx2基因,且eae基因在骆驼源STEC中的检出率最高(P<0.05),然而关于骆驼源STEC毒力和致病性的研究相对较少。本研究中羊源STEC均未携带eae基因,在江苏羊源STEC分离株中也很少出现eae基因[16]。作者发现牛源STEC的毒力基因谱最为多样化(占所有毒力组合的80%),且以携带stx1+stx2+hlyA(57.9%)为主(表2),表明stx编码的噬菌体在牛上广泛传播。本研究中,stx1a主要分布于牛源STEC,stx1c主要分布于羊源STEC,表明不同stx基因亚型可能与宿主动物种类相关。stx2基因是从HUS患者分离的STEC中发现的最普遍的毒素基因型,但携带不同stx2亚型的STEC与HUS的相关性存在显著差异[5],其中stx2a和stx2d与HC、HUS关系密切[26-27]。本研究中,stx2a主要分布于牛源分离株,stx2d常见于牛、羊源STEC[28],41.7%骆驼源STEC携带stx2d(5/12),表明骆驼也是stx2d的储存库。
近年来,动物源非O157 STEC的耐药性逐渐增强,本研究中STEC耐药株集中在牛源分离株上,其耐药率(17.5%,10/57)高于先前新疆牛源非O157 STEC的耐药率(11.5%)[29],且50%的牛源STEC对四环素耐药,这与Dong等[30]的研究结果一致。本研究中的STEC多对1~2种抗生素耐药,总体上耐药率不高,多重耐药不严重(14.9%,14/94),但这些菌株中存在对β-内酰胺类的多个药物耐药的现象,甚至出现对多黏菌素耐药的菌株,提示在临床上需谨慎用药。ERIC-PCR技术因操作简单、快速、准确而得到了广泛应用,扩增的目的条带为肠杆菌基因间ERIC序列,这些序列具有高度的同源性。郑晓风等[31]采用ERIC-PCR方法分析牛源和羊源的非O157 STEC之间的亲缘关系较近。本研究利用ERIC-PCR分型结果显示,不同地区的牛、羊和骆驼源的非O157 STEC之间亲缘关系较近,预示着STEC的传播不局限于同一地区,也可能通过动物的转场在不同地区不同物种间交叉传播。
4 结 论
从牛、羊、骆驼的粪便、肛拭子和胴体上分离的非O157 STEC血清群丰富,毒力基因谱多样化,且具有一定的耐药性,这些菌株潜在感染人类的风险,因此,不仅需要持续监测,而且要制定干预这些菌株污染肉品的方案,从而最大限度地降低非O157 STEC感染人类的风险。
