甘露糖修饰的壳聚糖聚乳酸-羟基乙酸共聚物纳米微球作为口蹄疫病毒核酸疫苗递送载体的特性评价
2021-12-31张中旺张富东吕建亮李嘉豪
李 显,张中旺,张富东,吕建亮,李嘉豪,潘 丽
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 OIE/中国国家口蹄疫参考实验室,兰州 730064)
自Illum等[1]提出壳聚糖微粒作为鼻黏膜疫苗载体以来,其发展已有20多年。壳聚糖是由几丁质脱乙酰化得到的一种天然的生物可降解聚合物(图1),具有无毒、黏附性好、生物利用度和电荷密度高等优点,因而在生物医学研究中具有广阔的应用前景[2]。与几丁质相比,壳聚糖有一个独特的特点,即氨基葡萄糖残基C-2位置存在伯胺[3-4],大量氨基的存在不仅与其脱乙酰度密切相关,也为其改性提供了可能性。各种化学基团的修饰决定了壳聚糖的功能和性质,例如为了提高壳聚糖在疫苗递送中的溶解性对其进行甲基化修饰,得到季铵化亲水性衍生物三甲基壳聚糖[5-6]。对其进行硫代化修饰,改性后的壳聚糖衍生物具有高渗透性、生物黏附性、高溶解度和原位凝胶性能[7]。此外,由于壳聚糖表面具有伯氨基的特性,也常用于接枝其他高分子化合物,如带正电荷的壳聚糖包覆带负电荷的PLGA,以提高对黏膜疫苗递送的免疫应答[8-9]。
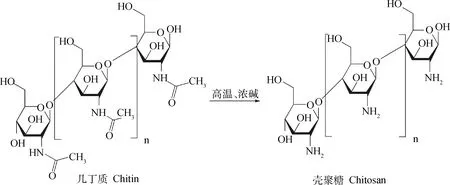
图1 几丁质脱乙酰化得到壳聚糖Fig.1 Deacetylation of chitin to produce chitosan
对于疫苗的递送来说,还可利用壳聚糖表面官能团容易修饰的特点,添加靶向抗原递呈细胞(antigen-presenting cells,APCs)的化学基团,实现靶向递送。APCs(如树突状细胞、巨噬细胞)表面表达一系列病原体识别受体(PRRs),包括Toll样受体(TLRs)[10]和C型凝集素受体(CLRs)[11-12]。甘露糖受体(mannose receptor,MR)存在于巨噬细胞和树突状细胞上,属于CLRs家族成员。巨噬细胞表达的MR识别并内吞以甘露糖基为末端的甘露糖基衍生物,将其转运到早期的核内体,核内体中的抗原被定位于溶酶体,抗原片段被降解加工呈递给MHC分子,刺激适应性免疫反应[13]。
在过去的几年中,甘露糖基化的壳聚糖颗粒被用于不同抗原的递呈中,并且取得了良好的预期效果[14-16]。但甘露糖基化的壳聚糖纳米微球作为FMDV核酸疫苗递呈载体却鲜有报道。根据实验室之前研究结果(未发表),选择A型口蹄疫病毒的代表性毒株FMDV/MM、FMDV/WH09和FMDV/AF72的若干抗原表位,分别为T细胞表位VP1(21-60aa),B细胞表位VP1(140-160aa)、VP1(200-212 aa),通过Linker(GGGGS)2进行3种毒株表位的重复串联得到FMDV TB表位的序列并构建真核表达质粒。因此,本研究以构建的含有FMDV TB表位基因的真核表达质粒为对象,对MCS-PLGA-NPs作为FMDV核酸疫苗递送载体的特性进行评价,为下一步该递呈载体携带核酸靶向APCs表面甘露糖受体和应用于动物免疫的研究奠定基础。
1 材料与方法
1.1 质粒及细胞
真核表达质粒pBudCE4.1-EGFP购自淼灵生物技术有限公司,质粒pUC57-TB-FL由南京金斯瑞生物技术有限公司优化合成,RAW264.7细胞由兰州兽医研究所口蹄疫防控技术创新团队提供。
1.2 主要试剂
质粒小提试剂盒、DNA胶回收试剂盒均购自OMEGA Bio-Tek公司(美国),DNA Marker DL5000(TaKaRa)购自宝生物工程有限公司,工具酶HindⅢ、SalⅠ、T4 DNA连接酶均购自NEB公司(美国),博来霉素、TAE电泳液购自北京索莱宝公司,核酸染料购自英潍捷基(上海)贸易有限公司,琼脂糖购自北京全式金生物技术公司,酵母提取物、胰化蛋白胨购自英国OXOID公司,低分子量壳聚糖、甘露糖、氰基硼氢化钠、聚乙烯醇(PVA)均购自Sigma公司,聚乳酸-羟基乙酸共聚物(PLGA50:50,黏度0.29 dL·g-1)购自山东省医疗器械研究所,无内毒素质粒中量提取试剂盒购自OMEGA公司,高糖DMEM basic培养基、10%胎牛血清、青-链霉素均购自美国Gibco公司,DAPI染料、10×PBS、4%多聚甲醛组织细胞固定液均购自索莱宝公司,DNase Ⅰ购自日本TaKaRa公司,琼脂糖购自BIOWESTE公司(西班牙),Cy3荧光素购自Mirusbio公司,HRP标记的兔源抗A型FMDV多克隆抗体,由本实验室制备并保存,二氯甲烷、无水乙醇、冰醋酸均购自国药集团化学试剂有限公司。
1.3 主要仪器
电热恒温水浴锅(DK-8D型,上海精宏实验设备有限公司);立式电压力灭菌器(上海申安医疗器械厂),PCR扩增仪、电泳仪、凝胶成像仪(Bio-Rad,美国);磁力搅拌器(84-1A型,上海司乐仪器有限公司);水循环式真空泵(SHB-Ⅲ型,郑州长城科工贸有限公司);电子分析天平(Sartorius BAS124S型,赛多利斯科学仪器有限公司);电动搅拌器(JJ-1型,常州国华电器有限公司);低温冷冻干燥仪(CSSS-4型,Gene Company Limi)元素分析仪(Elementar公司,德国);双面超净工作台(苏净安泰);二氧化碳细胞培养箱(Thermo,美国);倒置光学显微镜(Nikon,日本);扫描电子显微镜(JSM-6701F);粒径测定仪(ZS90,美国);电泳仪(Bio-Rad,美国)、凝胶/蛋白质紫外成像系统(Bio-Rad ALD 1244型,美国);酶标仪(Thermo,美国);激光共聚焦显微镜(TCS SP8,德国徕卡)。
1.4 真核过表达质粒pBudCE4.1-EGFP-TB的构建
根据实验室之前构建合成的质粒pUC57-TB-FL为模板质粒,通过设计引物扩增出目的基因TB。引物序列及酶切位点详见表1。然后按照Zheng等[17]所述方法,将扩增的TB基因通过HindⅢ和SalⅠ酶切位点插入连接到真核表达载体pBudCE4.1-EGFP上,构建出含有绿色荧光蛋白基因的重组A/FMDV TB表位基因真核表达质粒pBudCE4.1-EGFP-TB。

表1 引物序列Table 1 Primers sequence used in the experiment
1.5 甘露糖基化壳聚糖的制备
采用甘露糖的醛基与壳聚糖分子表面氨基进行西佛碱反应,然后在氰基硼氢化钠的还原作用下得到甘露糖修饰的壳聚糖衍生物(图2)。制备方法参考Zhou等[18]所述,并在此基础加以改进。1)将 壳聚糖(500 mg,1倍量)加入30 mL甲醇∶超纯水=1∶1的混合溶液中,此时壳聚糖呈粉末状分散于混合溶液。加入溶液体积1%的醋酸后,溶液立刻变黏稠,状态呈透明胶状,若此时磁力搅拌器无法令其剧烈搅拌,将体系移至机械搅拌下。加入甘露糖(81 mg,0.15倍量)反应过夜,约10 h。加入氰基硼氢化钠(50 mg,0.45倍量),此时体系出现大量气泡浮于溶剂表面,强力搅拌使体系均匀反应约6 h。反应体系放大时按放大倍数增加药品和溶剂的用量;2)后处理:向反应体系中加入大量乙醇使产物分散,真空抽滤得到产物。将产物再溶于乙醇中分散约20 min,抽滤,重复3次,得到块状琼脂样产物。将产物溶于超纯水中分散一次,抽滤得到的产物冷冻干燥,得到成品。将得到的成品取30 mg 50 ℃真空干燥过夜,用微量元素分析仪测定合成物中碳、氮、氢的元素含量,根据化学式计算甘露糖修饰的壳聚糖衍生物的取代度(Z%)。燃烧法测定各元素占比。重复测量3次。
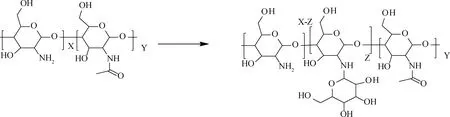
图2 甘露糖基化壳聚糖合成线路Fig.2 Synthetic circuit diagram of mannylated chitosan
1.6 MCS-PLGA-NPs制备及表征
采用双重乳化挥发法(W/O/W)制备MCS-PLGA-NPs,制备方法参考Zhou等[18]所述,并在此基础上加以改进。将1%的PLGA二氯甲烷溶液作为油相O,去离子水为水相W;二者混合冰浴超声3 min,形成初乳W/O;再将初乳迅速倒入等体积0.5%甘露糖基化壳聚糖溶液和2%PVA溶液中,冰浴超声5 min,形成复乳W/O/W;将复乳置于40 ℃水浴,磁力搅拌4 h挥发有机溶剂;4 ℃,12 000 r·min-1离心30 min,收集沉淀,去离子水洗涤2~3次,冻干后-20 ℃ 保存。将得到的MCS-PLGA-NPs重悬于去离子水中,用粒径仪测定颗粒的粒径、zeta电位;再将纳米微球稀释至合适浓度置于铜柱,自然干燥后喷金处理,进行扫描电镜观察。
1.7 MCS-PLGA-NPs吸附质粒能力的测定
称取适量纳米微球至离心管中,与适量质粒DNA(1 μg·μL-1)涡旋混匀,使纳米微球的质量与质粒DNA的质量比(w∶w)分别为20∶1、40∶1、60∶1、80∶1和100∶1,室温孵育30 min。将各质量比的样品进行1%的琼脂糖凝胶电泳,观察纳米微球与质粒DNA的结合情况。
1.8 MCS-PLGA-NPs结合质粒DNA抵抗DNaseⅠ的降解
纳米微球与质粒DNA质量比60∶1进行室温孵育30 min。根据杨蕴琦等[19]所述方法,按以下条件设置试验组:M组,裸质粒DNA;1组,裸质粒DNA+DNaseⅠ;2组,纳米微球结合质粒DNA;3组,纳米微球结合质粒DNA +0.5%SDS处理;4组,纳米微球结合质粒DNA+DNase Ⅰ处理后再用0.5%SDS处理组。然后,进行1%琼脂糖凝胶电泳。
1.9 MCS-PLGA-NPs细胞毒性的检测
采用CCK-8法检测MCS-PLGA-NPs细胞毒性。将RAW264.7细胞接种至96孔板中,37 ℃,5%CO2培养箱培养12 h;用DMEM将纳米微球稀释至浓度为100、80、60、40、20和10 μg·mL-1的混悬液,加至96孔板中,100 μL·孔-1,同时设空白对照组,每组重复6次,置细胞培养箱中继续培养24 h;加入CCK-8,10 μL·孔-1,继续培养1 h;酶标仪检测OD450 nm值,计算细胞存活率。
细胞存活率(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100%
A(加药):具有细胞、CCK8溶液和药物溶液的孔的吸光度;
A(空白):具有培养基和CCK8溶液而没有细胞的孔的吸光度;
A(0加药):具有细胞、CCK8溶液而没有药物溶液孔的吸光度。
1.10 小鼠巨噬细胞RAW264.7对MCS-PLGA-NPs-DNA复合物的摄取
采用激光共聚焦试验观察巨噬细胞对MCS-PLGA-NPs-质粒DNA复合物的摄取。质粒DNA用荧光素Cy3标记,然后将Cy3标记的质粒与纳米微球以60∶1的质量比结合后,纳米微球-DNA复合物与RAW264.7细胞共同孵育30 min,激光共聚焦观察质粒与纳米微球的结合情况以及细胞对纳米微球-DNA复合物的摄取情况。
1.11 MCS-PLGA-NPs-DNA复合物在RAW264.7细胞中的表达验证
将小鼠巨噬细胞RAW264.7接种至12孔板,细胞密度约为5×105个·孔-1,5%CO2、37 ℃培养箱培养12 h后,将MCS-PLGA-NPs与真核表达质粒pBudCE4.1-EGFP-TB按方法“1.7”中获得的最适吸附效率结合与RAW264.7细胞共孵育,同时将空白细胞作为阴性对照。24 h后弃掉培养基,每孔加入500 μL 4%多聚甲醛,室温固定15 min,1×PBS溶液洗涤3次,每次5 min;加入300 μL DAPI溶液,室温染色8 min,1×PBS溶液洗涤3次,荧光显微镜观察绿色荧光蛋白的表达情况。然后收取、处理表达绿色荧光蛋白的细胞样品,用抗FMDV的兔源特异性多克隆抗体对表达的重组TB蛋白进行Western blot鉴定。
1.12 统计学分析
使用GraphPad Prism 8.0软件对试验数据进行t检验,以P<0.05差异为有统计学意义。
2 结 果
2.1 含绿色荧光蛋白基因的重组A/FMDV TB表位基因真核表达质粒的构建
对获得的真核表达质粒pBudCE4.1-EGFP-TB进行双酶切鉴定,结果如图2所示,载体片段大约5 kb,目的基因片段大小约为597 bp,测序结果与预期一致。

1.重组质粒pBudCE4.1-EGFP-TB;2.重组质粒pBudCE4.1-EGFP-TB Hind Ⅲ和SalⅠ的双酶切鉴定;M.DL5000 DNA相对分子质量标准1.pBudCE4.1-EGFP-TB;2.pBudCE4.1-EGFP-TB digested with HindⅢ and SalⅠ;M.DL5000 DNA marker图3 重组真核表达质粒pBudCE4.1-EGFP-TB的酶切鉴定Fig.3 The identification of plasmid pBudCE4.1-EGFP-TB by double enzyme digestion
2.2 甘露糖基化壳聚糖的获得
假设壳聚糖的去乙酰度为X%,乙酰度为Y%,
则X%+Y%=1
(式1)
设此时壳聚糖的C元素(分子量12)与N元素(分子量14)的质量比为A,去乙酰基的糖原有6个C原子,非去乙酰基的糖原则有8个C原子,则
A=(6*X%*12+8*Y%*12)/[14*(X%+Y%)]
(式2)
当甘露糖修饰后,设C元素与N元素的质量比为A’,取代值为Z%,去乙酰基的糖原有6个C原子,非去乙酰基的糖原有8个C原子,甘露糖修饰的糖原则有12个C原子,则
A’=[ 6*(X-Z)%*12+12*Z*12+8*Y%*12]/[14*((X-Z)%+Z%+Y%)]
(式3)
将式3化简得到取代值的计算式为
Z%=(14A’+24*X%-96)/72
(式4)
将元素分析测得的数值与壳聚糖去乙酰度代入(式4)即可计算出甘露糖修饰的壳聚糖衍生物的取代值。得到4批甘露糖修饰的壳聚糖衍生物,取代值分别为10.60%、6.33%、6.72%和7.89%,见表2。
表2 元素分析测得的衍生物N、C、H的数值Table 2 Derivatives N,C,H values measured by elemental analysis
2.3 MCS-PLGA-NPs制备及表征
制备的纳米微球在纳米粒度仪下进行测定,测得其平均粒径分布在255 nm,见图4A,分散系数PDI为0.213,分散性良好,平均zeta电位为+19.9 mV,见图4B,表明纳米微球在水溶液状态下具有结合带负电荷质粒DNA的能力。扫描电镜下观察,纳米颗粒呈均一的球形,表面略微粗糙,粒径大小为100~300 nm,与动态光散射测定的粒径分布一致,见图5。

A.MCS-PLGA-NPs粒径分布图;B.MCS-PLGA-NPs zeta电位图A.Size distribution of MCS-PLGA-NPs;B.Zeta potential of MCS-PLGA-NPs图4 MCS-PLGA-NPs粒径分布和zeta电位Fig.4 Size distribution and zeta potential of MCS-PLGA-NPs

图5 MCS-PLGA-NPs扫描电镜图Fig.5 SEM of MCS-PLGA-NPs
2.4 MCS-PLGA-NPs吸附质粒能力的测定
凝胶电泳结果显示,MCS-PLGA-NPs吸附质粒的能力随其质量的增加而增加。当纳米微球与质粒DNA质量比60∶1时,质粒DNA能完全结合在纳米微球上,见图6。因而,选择纳米微球与质粒DNA质量比为60∶1作为后续试验的最佳结合比。

M.质粒DNA;1.纳米微球与质粒DNA质量比为20∶1;2.纳米微球与质粒DNA质量比为40∶1;3.纳米微球与质粒DNA质量比为60∶1;4.纳米微球与质粒DNA质量比为80∶1;5.纳米微球与质粒DNA质量比为100∶1M.Plasmid DNA;1:The mass ratio of nanospheres to plasmid DNA is 20∶1;2.The mass ratio of nanospheres to plasmid DNA is 40∶1;3.The mass ratio of nanospheres to plasmid DNA is 60∶1;4.The mass ratio of nano-microspheres to plasmid DNA is 80∶1;5.The mass ratio of nanospheres to plasmid DNA is 100∶1图6 MCS-PLGA-NPs吸附质粒能力的凝胶电泳图Fig.6 Gel electrophoresis of plasmid adsorption capacity of MCS-PLGA-NPs
2.5 MCS-PLGA-NPs结合质粒DNA抵抗DNaseⅠ的降解能力
琼脂糖凝胶阻滞试验表明,当纳米微球与质粒DNA质量比60∶1时,通过静电吸附的质粒DNA完全结合在纳米颗粒上(组2)。即使在电场条件下,带负电的质粒DNA也很难从纳米颗粒上解离下来,纳米微球-DNA复合物完全被滞留在加样孔中(组2);纳米微球结合质粒DNA+SDS处理组表明,阴离子活性剂SDS能使质粒DNA从纳米微球上解离下来(组3);纳米微球结合质粒DNA + DNase Ⅰ处理后再用SDS处理组表明,质粒DNA结合在纳米微球上可以在一定程度上抵抗DNase Ⅰ的降解(组4)。详见图7。
-.没有;+.有;M.质粒DNA;1.DNaseⅠ处理的质粒DNA;2.MCS-PLGA-NPs-DNA复合物(w∶w=60∶1);3.经 0.5%SDS处理的纳米微球-DNA复合物;4.DNaseⅠ处理过的纳米微球-DNA复合物,再经0.5%SDS处理后的上清-.Indicates no;+.Indicates yes;M.Plasmid DNA;1.Plasmid DNA digested with DNaseⅠ;2.MCS-PLGA-NPs-DNA complex (w∶w=60∶1);3.Nanosphere-DNA complex treated with 0.5% SDS;4.The supernatant of nanosphere-DNA complex digested with DNaseⅠand then treated with 0.5% SDS图7 MCS-PLGA-NPs-DNA复合物抵抗核酸酶降解的凝胶电泳图Fig.7 Gel electrophoresis of MCS-PLGA-NPs-DNA complex resist degradation by DNase Ⅰ
2.6 MCS-PLGA-NPs细胞毒性的检测
CCK8试验结果显示,10 μg·mL-1组与60 μg·mL-1组的MCS-PLGA-NPs与RAW264.7细胞孵育24 h后,对细胞存活率影响无明显变化(P=0.121 2)。虽然100 μg·mL-1组与10 μg·mL-1组的纳米微球对细胞存活率影响有显著性差异(P<0.01),但该组细胞存活率仍能达到85%以上,表明MCS-PLGA-NPs毒性较低。见图8。

NS.无显著差异;*.P<0.05;**.P<0.01NS.No significant difference;*.P<0.05;**.P<0.01图8 MCS-PLGA-NPs的细胞毒性Fig.8 Cytotoxicity of MCS-PLGA-NPs
2.7 小鼠巨噬细胞RAW264.7对MCS-PLGA-NPs-DNA复合物的摄取
质粒DNA被荧光素Cy3标记后,按照MCS-PLGA-NPs与质粒DNA质量比为60∶1进行室温结合30 min,然后与RAW264.7细胞共孵育30 min。激光共聚焦结果表明,Cy3荧光质粒DNA成功吸附在MCS-PLGA-NPs表面并且小鼠巨噬细胞RAW264.7能很好地摄取微球-质粒DNA复合物。详见图9。

A.MCS-PLGA-NPs结合未被Cy3标记的质粒DNA激光共聚焦图像;B.MCS-PLGA-NPs结合被Cy3标记的质粒DNA激光共聚焦图像;DIC.明场;Cy3.经Cy3标记的质粒DNA在绿色激光器下的状态;DAPI.经DAPI染色的细胞核;MERGE.DIC、Cy3、DAPI的叠加图A.Confocal laser image of MCS-PLGA-NPs combined with plasmid DNA not labeled with Cy3;B.Confocal laser image of MCS-PLGA-NPs combined with plasmid DNA labeled with Cy3;DIC.Bright field;Cy3.The state of the Cy3-labeled plasmid DNA under the green laser;DAPI.DAPI-stained cell nucleus;MERGE.Overlay images of DIC,EGFP,and DAPI in three states图9 RAW264.7细胞摄取MCS-PLGA-NPs-DNA复合物激光共聚焦图像Fig.9 Confocal laser images of MCS-PLGA-NPs-DNA complex were captured by RAW264.7 cells
2.8 MCS-PLGA-NPS加载的质粒DNA在小鼠巨噬细胞RAW264.7中的表达
荧光显微镜观察结果显示,绿色荧光蛋白正确表达,表明MCS-PLGA-NPs具有脂质体类似的性质,可以携带质粒进入细胞表达。详见图10。为了进一步确定重组蛋白TB的表达,用抗FMDV的兔源特异性多克隆抗体对TB蛋白进行Western blot鉴定,得到目的蛋白大小约22 ku,见图11。结果表明,重组蛋白TB在RAW264.7中进行了表达。
A.空白细胞荧光显微镜图像;B.MCA-PLGA-NPs-DNA复合物与细胞共孵育后24 h荧光显微镜图像;DIC.明场;EGFP.表达的绿色荧光蛋白;DAPI.经DAPI染色的细胞核;MERGE.DIC、EGFP、DAPI三种状态下的叠加图A.Fluorescence microscope image of blank cells;B.Fluorescence microscope image of MCA-PLGA-NPs-DNA complexes incubated with cells for 24 hours;DIC.Bright field;EGFP.Expressed green fluorescent protein;DAPI.DAPI stained cellular nucleus;MERGE.Overlay images of DIC,EGFP,and DAPI in three states图10 MCS-PLGA-NPs吸附的DNA在细胞中的表达Fig.10 Expression of DNA adsorbed by MCS-PLGA-NPs in cells

1.阴性对照;2~4.TB蛋白1.Negative control;2-4.TB protein图11 兔源FMDV多克隆抗体对TB蛋白进行Western blot鉴定Fig.11 Identification of TB protein by Western blot with rabbit FMDV polyclonal antibody
3 讨 论
核酸疫苗的低免疫原性一直是其应用的主要限制,许多策略已经被研究来提高疫苗诱导的免疫应答效力[20]。阳离子壳聚糖以其良好的生物性能被广泛应用于DNA[17,20-21]、RNA[22-24]的递送。本试验利用阳离子壳聚糖表面易被修饰的特点,将一定量的小分子甘露糖通过化学反应连接到壳聚糖表面,模拟机体识别病原的模式,利用非病毒载体达到抗原的靶向递送。研究发现甘露糖受体介导的抗原摄取与未经甘露糖受体识别的抗原相比,将抗原递呈到T细胞的效率提高了大约100倍[25],这就意味着在短时间内抗原递呈细胞可以摄取更多的抗原来激发更强的免疫应答反应。最近的研究表明,壳聚糖纳米颗粒还具有逃逸溶酶体的能力,使抗原免受溶酶体酸性环境的破坏[26],抗原利用水平大幅提高。
壳聚糖表面较高的甘露糖修饰度,会使壳聚糖表面的伯氨基集团减少,这导致壳聚糖纳米微球难以制备和被细胞摄取[27],甘露糖取代度在4%~21%不影响壳聚糖成球,并且能很好地发挥修饰后的免疫功能作用[28-30]。在本研究中,甘露糖的取代度在5%~10%,并且利用表面带负电荷的PLGA作为阳离子壳聚糖纳米微球的内核,更利于壳聚糖纳米微球的形成。除此之外,带负电荷的核酸吸附在壳聚糖的表面会占据一定的氨基,与甘露糖取代壳聚糖表面的伯氨基共同作用,减弱壳聚糖正电荷的性能。基于以上考虑,选用低取代度的甘露糖基用以试验的验证研究。
本研究通过超声乳化挥发的方法制备MCS-PLGA-NPs,然后将质粒DNA通过静电作用吸附在其表面。在先前的研究中,Zhao等[31]利用超声乳化挥发的方法将新城疫病毒DNA疫苗作为水相包裹在壳聚糖PLGA纳米微球的内部,得到纳米微球直径为699.1 nm±5.2 nm,包封率为98.1%,zeta电位为+6.35 mV并且可以缓慢释放包裹的DNA。Lebre等[20]在其研究中表明,质粒DNA是以静电吸附的方式结合在了壳聚糖纳米微球的表面。事实上,质粒DNA确实以静电吸附的方式结合在壳聚糖纳米微球的表面。壳聚糖是几丁质脱乙酰化得到的产物,这就使得壳聚糖本身含有大量的伯氨基。在水溶液状态下,壳聚糖表面带有大量的正电荷,即使壳聚糖包裹了水溶液状态下带有负电荷的PLGA,所制得纳米微球的Zeta电位值仍然很高。Zhao等所制备的壳聚糖PLGA-DNA复合物zeta电位低的原因可能是除了包裹在纳米微球内部的DNA,还存在部分质粒DNA吸附或包埋在纳米微球的表面。在疫苗递送中,壳聚糖纳米微球的直径越小越容易进入细胞,从而提高核酸疫苗的递送效率。采用Zhao等的方法(超声功率50 W)得到的纳米微球粒径过大,虽然可以通过增大超声功率来改变微球大小,但是,过大的超声功率会大大损伤质粒DNA(质粒250 W功率超声1 min即可全部断裂,结果未展示)。综合以上考虑,本研究先制备粒径较小的MCS-PLGA-NPs,然后再将质粒DNA吸附其表面。
诸多文献报道壳聚糖纳米粒子吸附质粒DNA后形成的壳聚糖-DNA复合物可以使DNA免受DNase I的降解[32-35]。根据现有文献报道,将其保护质粒DNA免受DNase I的降解的原理解释为:DNA与壳聚糖形成壳聚糖-DNA复合物时,DNA包裹在壳聚糖内部和包埋在壳聚糖表面,使DNA免受DNase I损坏。而在本研究中,质粒DNA不参与纳米微球制备的过程,通过吸附在壳聚糖表面也能对质粒DNA抵抗DNase I降解产生一定的保护作用。对此现象的猜测:壳聚糖是一种带有大量正电荷的二元线形聚合物,通过静电力作用,DNA吸附在壳聚糖表面,类似镶嵌,使DNA免受DNase I的降解。详见图12。
A.DNA包裹和包埋在壳聚糖粒子中;B.DNA镶嵌在壳聚糖PLGA纳米微球上A.DNA is wrapped and embedded in chitosan particles;B.DNA is embedded in chitosan PLGA nanospheres图12 质粒DNA免受DNase I的降解的原理Fig.12 Principle of protecting plasmid DNA from degradation by DNase I
壳聚糖作为一种非病毒基因传递系统受到研究人员的关注,但由于带负电荷的DNA与带正电荷壳聚糖之间存在较强的相互作用,其转染效率较低[20]。这种低转染效率又可以解释为含有大量DNA的壳聚糖粒子在细胞表面附着不良、壳聚糖-DNA复合物无法逃逸溶酶体降解以及DNA从壳聚糖粒子中释放不佳[20]。目前研究表明,载体和质粒DNA之间平衡和适度的相互作用是成功转染的因素之一,负电荷成分的加入可能有利于提高转染效率[36-38]。海藻酸盐[36]、聚谷氨酸[37-38]、人血清白蛋白[20]的加入降低了壳聚糖与DNA的相互作用强度,从而提高了转染效率。本研究中,加入带负电荷的PLGA作为壳聚糖纳米微球的内核与低甘露糖修饰共同作用可能也有助于提高壳聚糖递送系统的转染效率(未验证)。总之,作者成功制备了MCS-PLGA-NPs并利用其加载FMDV核酸疫苗在细胞中进行成功表达,为FMDV核酸疫苗的递送研究提供了新的方向和见解,也为该递送载体携带特定抗原靶向APCs表面甘露糖受体以及应用于动物免疫的研究奠定基础。
4 结 论
成功制备了MCS以及MCS-PLGA-NPs;明确了MCS-PLGA-NPs与质粒DNA质量比60∶1时,吸附效果最好;MCS-PLGA-NPs加载FMDV核酸疫苗可以在细胞中进行表达。本研究为后续FMDV核酸疫苗的递送研究奠定了基础。
