幼龄大鼠异位气管移植致闭塞性细支气管炎动物模型的构建*
2021-12-30辜淑君陈德晖张抗抗麦凯琳顾莹莹古梓壕
辜淑君, 陈德晖△, 张抗抗, 麦凯琳, 顾莹莹, 古梓壕
(广州医科大学附属第一医院 1儿科,2病理科,广东广州510120)
闭塞性细支气管炎(bronchiolitis obliterans,BO)是一种由小气道损伤后炎症及纤维化病变引起的慢性气流阻塞性疾病[1]。BO 的发生常与严重感染、急性肺损伤、异体移植术后、吸入有毒物质和自身免疫性疾病等有关[2]。成人BO 多与器官移植后宿主免疫反应有关,约50%肺移植术后患者可发生BO[3],3年病死率高达65%。
“BO”是病理诊断,指气道内2 mm以下的小气道细支气管黏膜下或外周炎症细胞浸润和纤维化致管腔狭窄,目前BO 的致病机制尚未明了,良好的动物模型有助于阐明BO 的发病机制和探索新的治疗方法。移植后BO 常见移植物抗宿主反应引起细支气管广泛炎症反应甚至管腔闭塞的改变。因此,本文拟构建幼龄大鼠异位气管移植的动物模型,以评估移植后幼龄大鼠细支气管在不同时点的病理改变。
材料和方法
1 实验材料
SPF 级 Wistar 大鼠 63 只和 SD 大鼠 21 只,雄性,约3 周龄左右,体重在60~70 g 左右,均为南方医科大学动物中心提供。本研究所有动物的处理及实验操作均通过广州医科大学动物管理与使用伦理委员会审批。
2 方法
2.1 实验分组 术前2 组大鼠常规饲养1 周适应环境后随机分成2 组并做好标记。实验幼龄大鼠主要分为异型移植(SW,n=42)组和同型移植(WW,n=42)组。
SW 组:SD 大鼠为供体(n=21),Wistar 大鼠为受体(n=21),供体和受体随机配对后进行异位气管移植,将供体气管移植到受体颈背部皮下,分别在移植后第7、14 和28 天不同时段收取移植气管,每个时段收取7只受体大鼠的样本。
WW 组:供体(n=21)和受体(n=21)均为Wistar大鼠,供受体随机配对后进行异位气管移植,将供体气管移植到受体颈背部皮下,分别在移植后第7、14和28 天不同时段收取移植气管,每个时段收取7 只受体大鼠的样本。
2.2 供体气管的获取 两组供体大鼠使用2%戊巴比妥纳(40 mg/kg)[4]腹腔注射麻醉后仰卧位在手术台上固定,颈胸部备皮。外科无菌操作下行颈胸部正中切口切开皮肤,钝性分离颈部纤维及肌肉组织,充分暴露气管,解剖游离气管旁纤维组织、神经、血管及食管,用外科缝合线分别在左、右主支气管叉处及环状软骨处与气管上段结合处结扎并离断整根气管,用无菌生理盐水反复冲洗数次后放入含无菌生理盐水的培养皿中,并放入冰盒中备用。
2.3 供体气管植入受体 予受体Wistar 大鼠2%戊巴比妥纳(40 mg/kg)[4]腹腔注射麻醉成功后以俯卧位固定在手术台上,颈背部备皮。无菌操作下于颈背部正中处剪一长约2 cm小口,充分游离皮下组织,使其形成一个小囊腔[5],用沾有生理盐水的湿棉球清洁囊腔中渗出的血液,将移植气管植入,并以外科缝合线逐层缝合囊腔周围组织使气管固定于囊腔中。外科缝合线缝合切口皮肤,再次消毒皮肤切口。
2.4 术后管理 术后将受体大鼠单独置于清洁级鼠房内观察,全部大鼠30 min 内清醒,肌力逐渐恢复,刺激疼痛有反应。
术后大鼠正常饲养,每日每只大鼠大腿肌肉注射青霉素20万U,连续3 d,使用碘伏消毒切口连续1周。每日观察并记录受体大鼠的切口生长状况、活动状况、体重、饮食、精神变化、毛发、排泄情况及对外界刺激反应等。
2.5 样本采集 分别于移植后第7、14 和28 天对2组受体大鼠在无菌操作下进行以下实验步骤采集标本:(1)收取受体大鼠移植气管:2组受体大鼠麻醉成功后,无菌操作下切开受体大鼠颈背部皮肤,取出移植气管,气管放入10%中性甲醛中固定待病理检查;(2)受体大鼠肺组织的获取:充分将肺与周围组织分离,充分暴露后,结扎左主支气管,右肺行肺泡灌洗,收取肺泡灌洗液后结扎右主支气管并切取左右肺叶,存于10%中性甲醛溶液中,并标记。
2.6 组织学分析 将甲醛固定好的供体气管及受体肺组织进行石蜡常规包埋,制成4 μm 的切片,进行HE 及免疫组化染色。组织切片描述与分析:HE和免疫组化染色后在光学显微镜下观察移植气管及受体大鼠肺小气道的上皮细胞完整程度,纤维化程度、管腔闭塞程度及炎症细胞浸润程度。
3 统计学处理
使用SPSS 16.0统计软件进行数据分析,使用统计软件Prism 5(Graphpad)行统计学做图及分析。计量资料以均数±标准差(mean±SD)表示,两组间比较使用t检验,以P<0.05为差异有统计学意义。
结 果
1 动物的一般情况
所有大鼠至标本采集阶段存活情况良好,无死亡。从供体气管获取至气管异位移植完毕平均用时(18±5)min。异型移植(SW)组与同型移植(WW)组受体大鼠术后无死亡,切口无感染。取少量动物连续观察SW 组与WW 组受体大鼠术前和术后7 d的体重增长均无差异(P>0.05),全体动物体重变化的定量分析统计结果见表1。
2 受体大鼠样本的病理学观察
2.1 受体大鼠样本的HE 染色结果 WW 组移植气管的病理学观察:移植后第7 天时见移植气管上皮细胞完整,可见轻微炎症细胞浸润,纤维结缔组织增生不明显(图1A);第14天见移植气管炎部分症细胞浸润,伴有部分纤维结缔组织增生(图1B);第28 天见移植气管炎症细胞浸润增多,伴有部分纤维结缔组织增生(图1C)。SW 组移植气管病理结果:移植后第7 天时见移植气管部分上皮细胞丢失,黏膜下层可见少量中性粒细胞和淋巴细胞浸润,管腔内部分纤维结缔组织增生(图1D);第14天见移植气管上皮细胞丢失,可见黏膜下层有大量炎症细胞浸润,纤维结缔组织增生使管腔大部分闭塞,气管壁周围纤维结缔组织增多(图1E);第28 天见移植气管上皮细胞严重丢失,黏膜下层可见慢性炎症细胞浸润,增生的纤维结缔组织使管腔完全闭塞,管壁周围纤维组织增生明显(图1F)。

表1 SW组与WW组受体大鼠移植术前及术后体重变化Table 1. Comparison of the body weight between the recipient rats of SW group and WW group(g. Mean±SD. n=21)
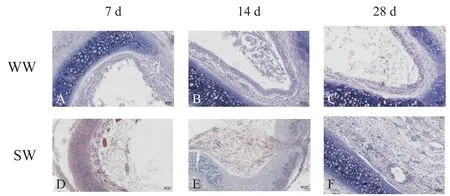
Figure 1. Histopathological changes of the transplanted trachea on the 7th(A and D),14th(B and E)and 28th(C and F)days after transplantation in SW group and WW group(HE staining,×400).图1 SW组和WW组移植后7、14 和28 d移植气管组织的病理学变化
WW 组受体肺组织的病理学观察:气管移植后第7 天时肺组织病理学改变不明显,气管上皮细胞完整,气管壁无增厚,炎症细胞浸润不明显,肺泡无明显破坏(图2A);第14天时肺组织细支气管周围炎症细胞浸润不明显,上皮细胞少量脱落,气管壁增厚不明显,气管周围小血管壁增厚不明显,肺泡无明显破坏(图2B);第28 天肺组织细支气管上皮细胞少量脱落,气管周围炎症细胞部分浸润,气管壁轻度增厚,肺泡壁周围有少量炎症细胞浸润(图2C)。SW组受体肺组织病理结果:供体气管移植后第7 天,受体肺组织组织病理学改变轻微,气道上皮细胞较完整,管壁增厚不明显,仅有少量炎症细胞浸润,气管周围小血管壁轻度改变,肺泡周围少量炎症细胞浸润(图2D);第14天肺组织细支气管上皮细胞部分脱落,黏膜褶皱增多,气管壁轻度增厚,肺泡周围少量炎症细胞浸润伴肺泡破坏增多,气管周围小血管壁增厚(图2E);第28 天肺组织细支气管炎症细胞浸润增多,纤维化明显,伴有小血管管壁增厚,肺泡壁周围可见少量炎症细胞浸润(图2F)。
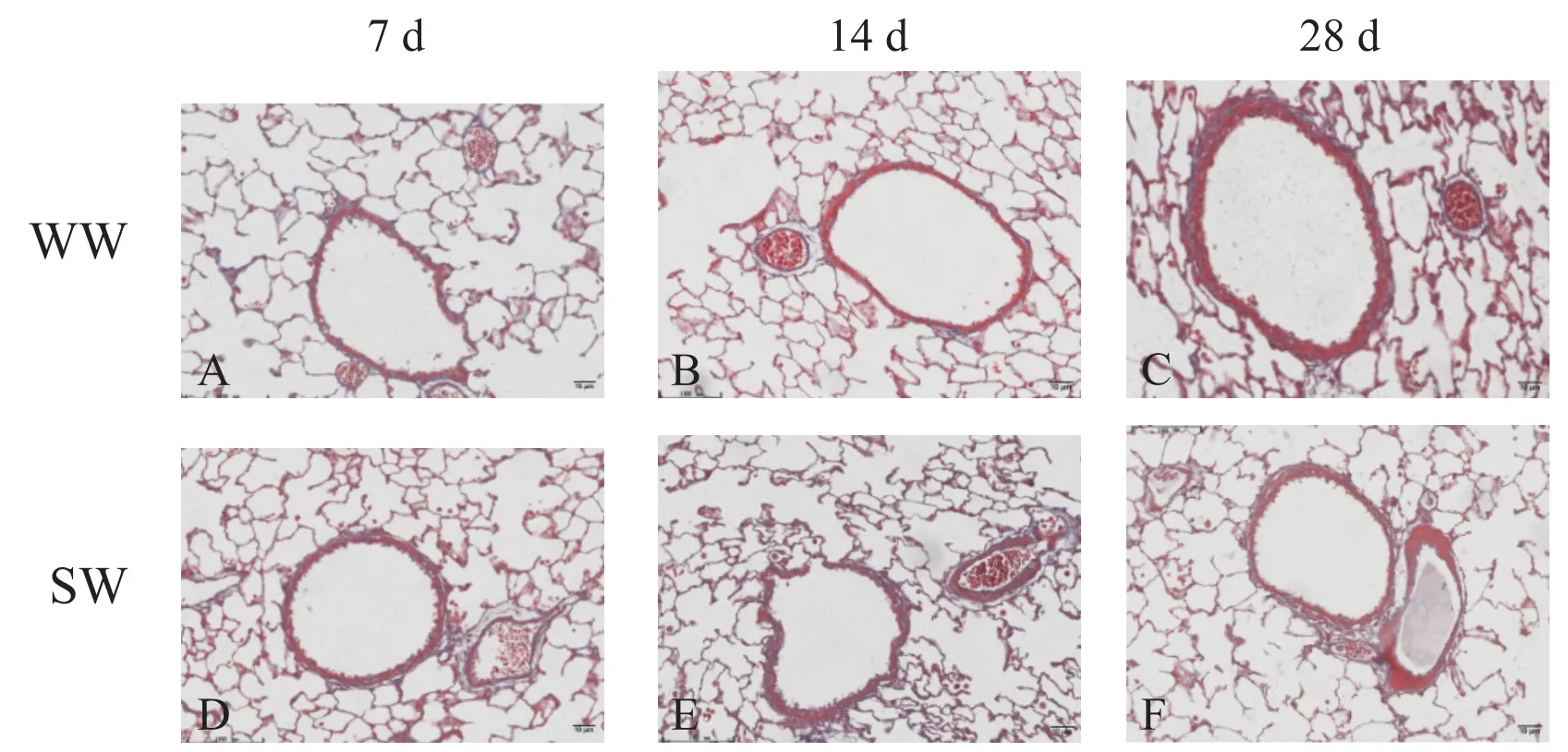
Figure 2. Pathological changes of lung tissue of recipient rats on the 7th(A and D),14th(B and E),and 28th(C and F)days after transplantation in SW group and WW group(HE staining,×200).图2 SW组和WW组移植后7、14和28 d受体大鼠肺组织的病理学变化
2.2 免疫组化染色观察 (1)α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA):WW 组移植后7、14和28 d 的免疫组化染色显示气道管壁连续性较完整,肌纤维破坏不明显;SW 组在移植后7、14 和28 d免疫组化染色显示气道平滑肌连续性较差,肌纤维破坏明显,平滑肌层断裂明显(图3A);(2)波型蛋白(vimentin):WW 组在移植后 7、14 和 28 d 的 vimentin免疫组化染色阳性较弱,气道管壁及周围纤维化不明显;SW 组在移植后 7、14 和 28 d 的 vimentin 免疫组化染色阳性较WW 组明显,且可看到SW 组小气道管壁周围纤维化较明显,还伴有炎症细胞增多(图3B);(3)E-钙黏蛋白(E-cadherin,E-Cad):WW组气道管壁在移植后7、14 和28 d 较完整,上皮细胞少量脱落;SW 组上皮细胞脱落程度在移植后7、14 和28 d 较WW组严重(图3C)。
讨 论
BO 是一种以细支气管炎性弥漫损伤为主所致的慢性气流受限综合征,病理主要表现为细支气管的部分或完全闭塞,临床表现为持续咳嗽、喘息和呼吸困难。文献报道显示,BO 发生发展的常见诱发因素多为严重感染、急性肺损伤或异体移植术后、吸入有毒物质和自身免疫性疾病等[2],引起BO 的病因较多,其中感染后BO 在儿童BO 最为常见。闭塞性细支气管炎患儿喘息、低氧血症和啰音可持续数月至数年,最后发展为复发性肺炎、复发性或慢性肺不张、肺心病、胸部畸形和杵状指等[6]。当感染后BO患儿存在严重的气流阻塞、肺功能持续降低、严重依赖氧疗的终末阶段BO 患儿可考虑进行肺移植[7]。成人多为移植后BO,与移植后移植物抗宿主反应相关。有文献显示肺移植后的闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)进行肺再移植可提高患者存活率[8]。
随着器官移植技术的发展,BO 作为异基因造血干细胞移植(hematopoletic stem cell transplantation,HSCT)和肺移植等器官移植后并发症的发生率越来越高,这促使人们去深入研究BO 的发病机制及干预靶点。因此,构建一个合格的BO 动物模型有助于模拟临床致病过程,并对进一步探讨其潜在病理生理机制和开发新的BO 防治措施是非常有意义的。目前BO 存在多种动物模型,包括啮齿类动物和大型动物的原位肺移植、原位气管移植和气管皮下、体表、腹腔[9]和肺内等不同部位的异位移植。本研究成功建立一种幼龄SD 大鼠和Wistar 大鼠的气管异位移植致闭塞性细支气管炎的动物模型。结果提示实验组SW 组的病理表现有气道部分上皮细胞丢失、纤维结缔组织增生、气管炎症细胞浸润增多及气道官腔部分闭塞或完全闭塞等的改变,与Lewis 及B-N 大鼠异位气管移植模型报道基本相似[5],成功地模拟了临床BO 炎症细胞浸润,结缔组织增生直到管腔闭塞的发展过程与病理学形态表现。由HE 染色可以看到,SW 组在移植后 7、14 和 28 d 移植气管上皮细胞丢失、炎症细胞浸润、纤维组织增生以及管腔闭塞程度都比WW 组严重。免疫组化染色也显示,SW 组样本气道平滑肌断裂程度、管周纤维化程度及气道上皮细胞脱落程度比WW 组更严重。考虑是SW 组气管异位移植产生排斥反应更为强烈,产生大量炎症因子释放致组织损伤和异常修复。E-cad 是一类存在与于所有上皮组织中的跨膜糖蛋白,是调节细胞间黏附反应的的主要介质,对调节细胞运动、黏附和维持细胞形态具有重要作用[10],其表达减弱甚至消失时,细胞间的黏附能力降低,从而更易出现细胞脱落或转移。
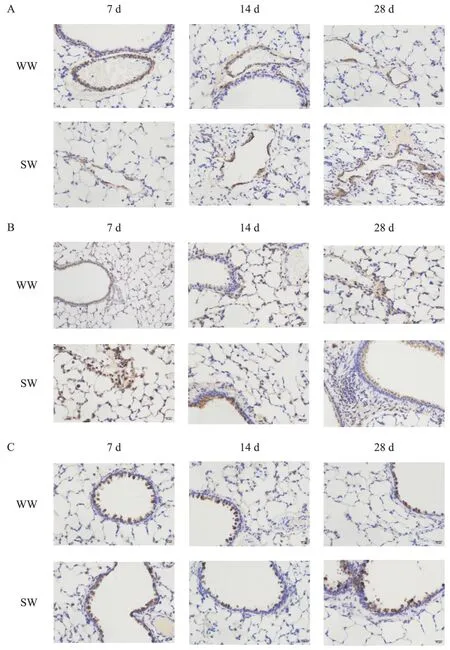
Figure 3. Immunohistochemical observation on the expression of α-SMA(A),vimentin(B),and E-Cad(C)in the lung tissues of recipients on the 7th,14th and 28th days after transplantation in SW and WW groups(×200).图3 SW组和WW组移植后7、14和28 d受体肺组织α-SMA、vimentin和E-cad表达变化的免疫组化观察
本研究使用3~4 周幼龄SPF 级SD 大鼠和Wistar大鼠进行颈背部异位气管移植构建BO 动物模型模拟儿童期BO 病程病理发展变化,实验简单,相对肺或气管原位移植大鼠模型操作更容易,可重复性强,术后管理容易,可较好地避免了手术感染风险及减少了模型大鼠死亡风险。异位气管移植基本模拟了临床BO 病理组织损害,可应用于移植后BO 机制研究[11]。对比气管异位移植腹腔大网膜所致移植后BO模型[9],颈背部环境可以排除腹腔体液的干扰,且更接近于生理气管颈部微环境。但不足之处是相对于原位气管移植,气管异位移植由于气管周围环境完全封闭,气管腔没有空气流通的环境。此外,儿童BO 主要在小气道发生病变,而异位气管移植模型采用的是大气道主气管进行造模,在反映小气道发生病变可能较原位肺移植后BO 模型的病理改变较轻。但与其他BO 移植模型相比,在病理改变与实验可行性上颈背部异位气管移植构建BO 模型有很大优势,对今后儿童BO 致病机制的研究可提供重要的数据支持。
综上所述,本研究所构建的幼龄大鼠异位气管移植动物模型的气管病理改变可以诱发造模大鼠细支气管气道上皮细胞的脱落、纤维结缔组织增多及淋巴细胞的浸润和气道管腔闭塞等改变,与Genden等[12]所构建的BO动物模型病理改变相似,为成功构建的幼龄大鼠异位气管移植BO 动物模型,可为后续研究移植后BO机制与干预提供了实验平台。
