日粮添加18β-甘草次酸对羔羊断奶应激的影响
2021-12-29陈鹏飞赵正伟马丽娜高海慧马友记
■陈鹏飞 赵正伟 王 锦 马 青 马丽娜 高海慧 马友记
(1.甘肃农业大学动物科学技术学院,甘肃兰州 730070;2.宁夏农林科学院动物科学研究所,宁夏银川 750002)
滩羊羔羊断奶是其生长发育阶段的一个重要转折过程。羔羊断奶时自身的消化及免疫系统尚未完全发育成熟,加之与母羊隔离、日粮营养及状态、饲养方式和环境等因素的变化,不可避免地引起羔羊一系列心理和生理的应激反应,导致断奶羔羊消化不良、生长发育受阻、免疫力下降等断奶应激反应[1-2]。断奶应激可引起羔羊生长性能、激素、血清和抗氧化等指标的变化[1,3-4]。羔羊断奶后出现严重应激往往造成死亡或者育肥期体弱多病[5]。Hulbert 等[6]认为羔羊在断奶后由于断奶应激导致羔羊在断奶时出现“生长性休克”或负增长,使羔羊的成活率和育成率大大降低。成为我国养羊业需要解决的技术难题之一[7]。
18β-甘草次酸是甘草的主要活性成分,具有抗过敏、消炎、抗菌、抗感染、抗病毒、抗氧化及抗溃疡等多种药理作用[8]。国内外对18β-甘草次酸主要研究报道为抗肿瘤方面,在羔羊断奶应激方面的应用研究报道较少。本研究主要在断奶羔羊日粮中添加18β-甘草次酸,研究其对断奶羔羊生长性能、抗氧化、免疫因子等方面的影响,从而为18β-甘草次酸在断奶羔羊日粮中的添加以降低羔羊断奶应激提供理论依据。
1 材料与方法
1.1 试验材料与仪器
试验材料:饲料添加剂18β-甘草次酸,购于甘肃泛植制药有限公司,规格为98%;BC-5000 Vet 全自动五分类动物血液细胞分析仪试剂购自深圳迈瑞生物医疗电子股份有限公司;AST、ALP 试剂盒,购自中生北控股份有限公司;SOD、GSH-Px、MDA、T-AOC试剂盒,购于北京华英生物技术研究所;IFN、IL-2、IL-4、IL-10试剂盒,购于北京华英生物技术研究所。
试验仪器:迈瑞BS-420全自动生化仪,生产厂家为深圳迈瑞生物医疗电子股份有限公司;A6 半自动生化仪,生产厂家为北京松上技术有限公司;华卫德朗DR-200BS酶标分析仪,生产厂家为无锡华卫德朗仪器有限公司。
1.2 试验设计与试验饲粮
选取60 日龄断奶羔羊48 只,随机分成3 组,每组16 只,公母各半。基础日粮及营养水平见表1,试验组分别在基础日粮中添加0.3%、0.2%、0%18β-甘草次酸。试验Ⅰ组饲喂添加0.3%18β-甘草次酸的日粮;试验Ⅱ组饲喂添加0.2%18β-甘草次酸的日粮;对照组饲喂添加0%18β-甘草次酸的日粮。以断奶当日记做试验0 d,正式期从-30 d 开始,断奶后30 d 试验结束。比较日粮中添加不同比例18β-甘草次酸,对断奶羔羊生产性能、抗氧化、免疫等指标的影响。
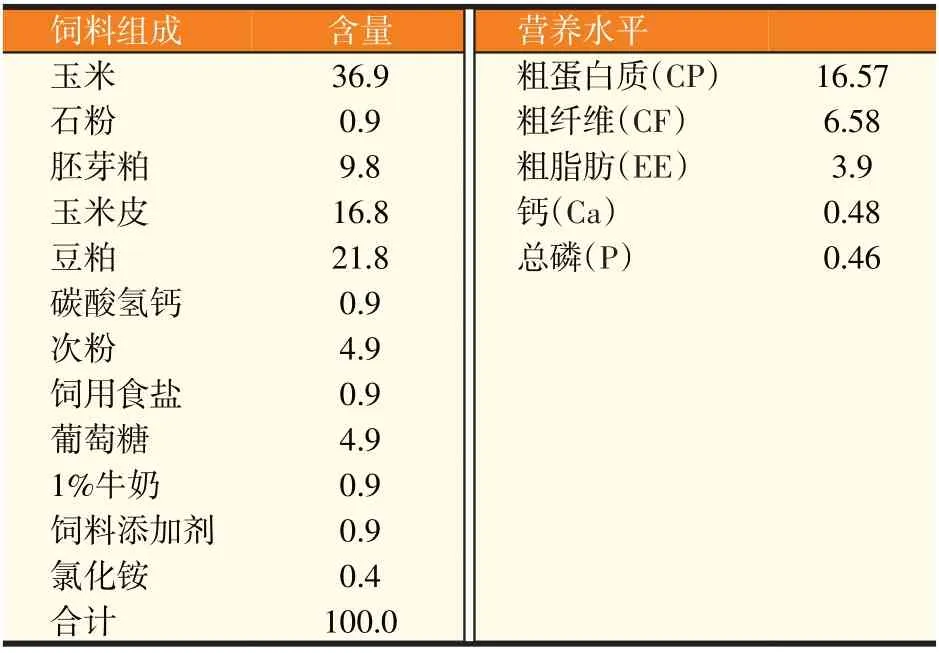
表1 试验羊基础日粮组成及营养水平(干物质基础,%)
1.3 测定指标及方法
1.3.1 饲料营养测定测定出日粮中CP、EE、CF、Ca、P 的含量。依据GB/T 6432—2018、GB/T 6433—2006、GB/T 6437—2018等标准,采用8400 型全自动定氮仪、2050 脂肪测定仪、2010 纤维素分析仪、220FS 原子吸光分光度计、722S可见光分光度计测定。
1.3.2 生长性能指标测定
以断奶当日记做试验0 d,分别在-30、0、10、20 、30 d 羔羊个体空腹活重称重1 次。计算每组羔羊试验期内的增重、断奶后每隔10 d增重、料重比等。
1.3.3 血液指标测定
试验羊颈静脉采集全血10 mL分别装入5 mL抗凝管和5 mL促凝管,抗凝血0~4 ℃保存,将0、30 d抗凝全血在迈瑞BC-5000 Vet全自动五分类动物血液细胞分析仪上测定WBC、LYM、RBC、PLT、PCT 含量;促凝血室温静置30 min,2 000 r/min离心5min,上清液分装于Eppendorf管中,置于-20 ℃保存备用。使用中生北控股份有限公司试剂盒,比色法测定0、30 d血清中AST、ALP含量;使用北京华英生物技术研究所试剂盒,比色法测定0、10、20 d血清中SOD、GSH-Px、MDA、TAOC含量;使用北京华英生物技术研究所试剂盒,酶免法测定-30、0、30 d血清中IFN、IL-2、IL-4、IL-10含量(因为经费不足,只测了一部分)。
1.4 数据统计与分析
采用Excel 2007 软件对数据进行预处理,通过SPSS 25.0 分析软件对所得数据进行正态分布检验,符合正态分布后进行单因素方差分析。若有显著差异则采用LSD 法对组间差异进行多重比较,采用正交多项式比法确定18β-甘草次酸添加水平的线性和二次效应。P<0.01 为差异极显著,P<0.05 为差异显著,P>0.10 为差异不显著,0.05≤P≤0.10 为有显著趋势。
式中,当k取得l时,|S(k)|取得最大值,因此,得到速度估计值为vr=cl/2NMΔfTr,速度无模糊范围为(-c/4NΔfTr,c/4NΔfTr),速度分辨率为Δv=c/2NMΔfTr。当M取值512,根据表1雷达参数计算可得,速度无模糊范围为(-1 171.9 m/s,1 171.9 m/s),速度分辨率为4.58 m/s。可见,互相关FFT法测速范围很大,但是其精度很低,远不能满足线性相位速度补偿误差的要求。因此,为实现距离像的精确补偿,仍需进一步高精度测量。
2 结果与分析
2.1 18β-甘草次酸对断奶羔羊生长性能的影响(见表2)

表2 不同添加量18β-甘草次酸对断奶羔羊生长性能的影响
由表2可见,羔羊断奶前后饲喂添加不同量18β-甘草次酸的日粮,试验Ⅰ组、试验Ⅱ组、对照组-30、0、10、20 d 体重差异不显著;与对照组相比试验Ⅰ组、试验Ⅱ组30 d 体重差异不显著(P>0.05),但试验Ⅰ组体重为各组中最高,且试验Ⅰ组、试验Ⅱ组与对照组呈阶梯状下降;与对照组相比0~10 d 增重试验Ⅰ组差异显著(P<0.05),试验Ⅱ组差异极显著(P<0.01);与对照组相比11~20 d 增重试验Ⅰ组差异显著(P<0.05);与对照组相比21~30 d 增重试验Ⅰ组、试验Ⅱ组差异显著(P<0.05)。试验Ⅰ组、试验Ⅱ组、对照组21~30 d 料重比分别为1.90、2.00、2.97。试验Ⅰ组、试验Ⅱ组、对照组0~30 d 羔羊腹泻发病病例分别为1、2、4例。
2.2 18β-甘草次酸对断奶羔羊血常规的影响(见表3)

表3 不同添加量18β-甘草次酸对断奶羔羊血常规的影响
由表3可见,羔羊断奶前后饲喂添加不同量18β-甘草次酸的日粮,30 d 试验Ⅰ组WBC 与试验Ⅱ组差异显著(P<0.05);0、30 d 与试验Ⅱ组相比RBC 试验Ⅰ组、对照组差异显著(P<0.05);与对照组相比0、30 d PLT试验Ⅰ组差异显著(P<0.05);与对照组相比0 d PCT 试验Ⅰ组差异显著(P<0.05),与对照组相比30 d PCT试验Ⅰ组差异极显著(P<0.01),与试验Ⅱ组相比30 d PCT 试验Ⅰ组差异显著(P<0.05);与试验Ⅱ组相比30 d AST试验Ⅰ组差异显著(P<0.05);与试验Ⅱ组相比30 d AST对照组组差异极显著(P<0.01)。
2.3 18β-甘草次酸对断奶羔羊血清抗氧化物指标的影响(见表4)
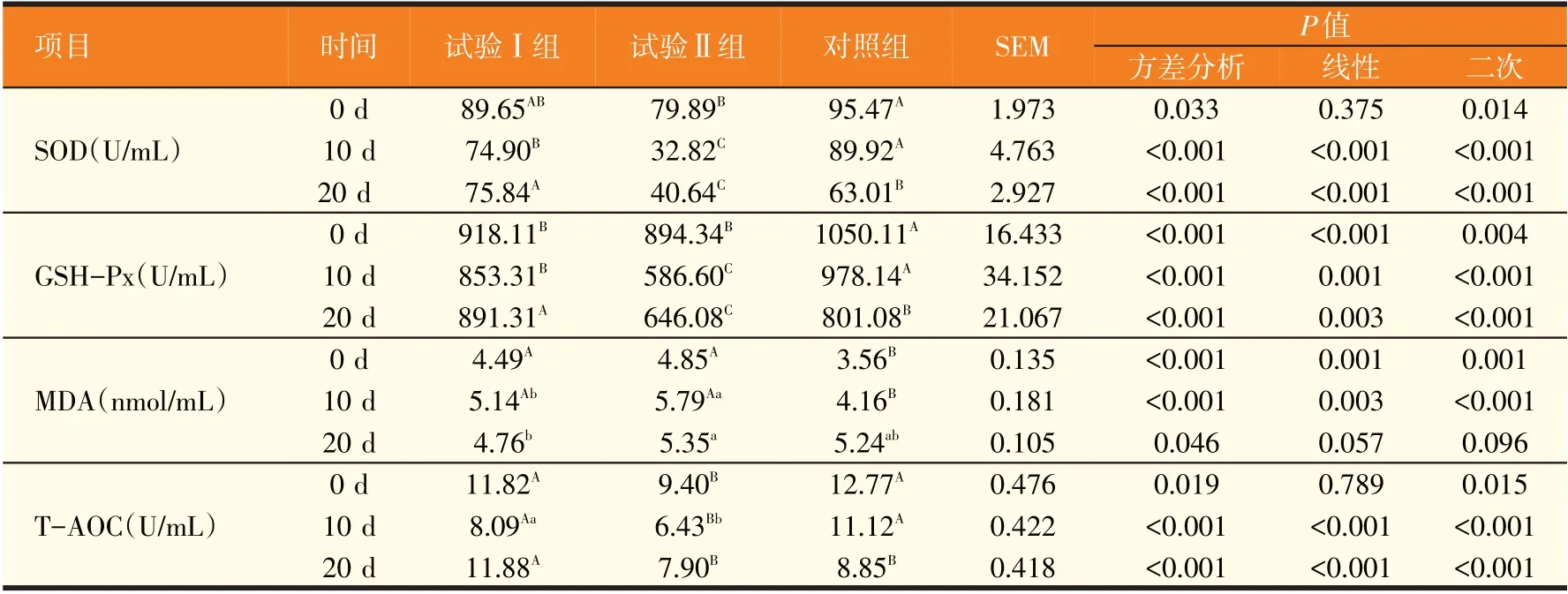
表4 不同添加量18β-甘草次酸对断奶羔羊血清抗氧化指标的影响
由表4可见,羔羊断奶前后饲喂添加不同量18β-甘草次酸的日粮,与对照组相比,0 d SOD试验Ⅱ组差异极显著(P<0.01);与对照组相比,10 d SOD试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比,20 d SOD 试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比,0 d GSH-Px试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比,10 d GSH-Px试验Ⅰ组差异极显著(P<0.01);与对照组相比,20 d GSH-Px试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比,0 d MDA试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比,10 d MDA 试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比,20 d MDA各试验组差异不显著(P>0.05);与对照组相比,0 d TAOC 试验Ⅱ组差异极显著(P<0.01);与对照组相比,10 d T-AOC试验Ⅱ组差异极显著(P<0.01);与对照组相比,20 d T-AOC试验Ⅰ组差异极显著(P<0.01)。
2.4 18β-甘草次酸对断奶羔羊免疫因子的影响(见表5)
由表5 可见,羔羊断奶前后饲喂添加不同量18β-甘草次酸的日粮,与对照组相比-30 d IFN 试验Ⅰ组差异极显著(P<0.01);与对照组相比0 d IFN 试验Ⅰ组差异显著(P<0.05),试验Ⅱ组差异极显著(P<0.01);与对照组相比30 d IFN 试验Ⅰ组差异显著(P<0.05),试验Ⅱ组差异极显著(P<0.01);与对照组相比-30 d IL-2 试验Ⅰ组差异极显著(P<0.01);与对照组相比0 d IL-2试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比30 d IL-2 试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比-30 d IL-4 试验Ⅰ组差异显著(P<0.05);与对照组相比0 d IL-4试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比30 d IL-4 试验Ⅱ组差异极显著(P<0.01);与对照组相比-30 d IL-10 试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比0 d IL-10 试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01);与对照组相比30 d IL-10 试验Ⅰ组差异极显著(P<0.01),试验Ⅱ组差异极显著(P<0.01)。
3 讨论
3.1 日粮中添加18β-甘草次酸对断奶羔羊生长性能的影响
羔羊因断奶导致氧化应激时,体内产生大量的自由基,破坏生物膜,致使肠黏膜通透性升高、肠源性感染增加,采食量下降,生长性能降低[9-12]。而生长性能是评价一段时间内动物生长发育的重要指标[13]。日粮中添加0.3% 18β-甘草次酸的试验Ⅰ组断奶后30 d体重为各组中最高,添加0.2% 18β-甘草次酸的试验Ⅱ组体重也高于对照组。何子双等[14]研究发现,在代乳粉中添加甘草次酸饲喂7日龄公仔猪能促进其生长。罗宗刚等[15]试验表明,甘草渣能提高育肥猪的生长性能,与本研究结果一致。研究发现试验Ⅰ组与试验Ⅱ组断奶后0~10、11~20、21~30 d,3 个阶段增重均比较平稳,而对照组断奶后3 个阶段增重起伏变化较大,维持时间较长,有报道表明羔羊在断奶应激后,会表现出补偿性生长[16],与本研究一致,可见断奶应激会对羔羊生长产生持续性影响。但添加18β-甘草次酸的试验Ⅰ组与试验Ⅱ组并没有出现补偿性生长,表明18β-GA 可抵抗羔羊因断奶应激导致的生长性能下降。
3.2 日粮中添加18β-甘草次酸对断奶羔羊抗氧化能力的影响
氧化还原反应是生物体化学反应途径以及细胞功能活动的基础[21],维持机体稳态依赖于机体氧化系统和抗氧化系统的动态平衡,活性氧自由基(ROS)产生过量或者机体抗氧化系统遭到破坏,这种动态平衡被打破,引起氧化应激[22]。研究表明,仔猪断奶氧化应激时,机体氧自由基产生增多,抗氧化能力下降[23-24]。氧化应激可大量产生MDA,是反应细胞膜氧化损伤的重要指标[25]。本研究发现试验Ⅰ组、试验Ⅱ组、对照组羔羊断奶后20 d 血液中MDA 含量比0 d 分别高5.67%、9.34%、32.06%,可见羔羊断奶后应激持续时间较长,体内产生大量MDA。饲喂含有18β-甘草次酸日粮的试验Ⅰ组与试验Ⅱ组MDA产生量明显低于对照组。车丽涛等[26]研究甘草次酸可降低青年母猪的血清MDA 含量。GA 对典型自由基具有较强的清除作用,如过氧化氢(H2O2)、超氧阴离子(O2-)及羟基(-OH)等[27],且清除能力与甘草次酸水平呈显著相关性,邢燕等[28]研究发现,高浓度甘草次酸造成ROS 类物质释放受遏制。SOD、GSH-Px可有效清除自由基,其活性高低可反映机体清除自由基的能力。T-AOC反映机体防御体系总体抗氧化能力的强弱[26]。本研究发现羔羊断奶后0 d 到20 d各组SOD、GSH-Px、TAOC 含量均下降,试验Ⅰ组20 d SOD、GSH-Px、TAOC均极显著高于对照组,可见断奶后羔羊抗氧化能力下降,但饲喂日粮中添加0.3% 18β-甘草次酸可抵抗断奶应激对机体抗氧化能力的影响。蔡东森[29]研究表明,饲料中添加甘草次酸可显著提高团头鲂的抗氧化能力一致。
3.3 日粮中添加18β-甘草次酸对断奶羔羊免疫功能的影响
大量研究表明,氧化应激与机体免疫功能密切相关,鱼体长期处于氧化应激状态下,机体的免疫器官会受到不同程度的损伤,从而导致机体免疫力下降,造成疾病或死亡的发生[30]。试验Ⅰ组羔羊断奶后30 d血中WBC、LYM、PLT均高于对照组,与甘草酸可使动物WBC、LYM 含量增加,提高动物机体免疫水平[31]的研究一致。本研究发现日粮中添加18β-甘草次酸的试验Ⅰ组、试验Ⅱ组IFN、IL-2 血清含量在0、30 d 均高于对照组,表现为差异显著或极显著。而IL-4、IL-10 含量在0、30 d 均低于对照组。Bordbar 等[32]发现甘草次酸能增加Th1 细胞因子IFN、IL-2 的分泌,Kong 等[33]的研究中也证实了甘草次酸可下调炎症因子IL-4、TNF-α、IL-10的表达。IFN具有抗病毒、抑制细胞增殖、调节免疫及抗肿瘤作用,IL-2 为多向性作用的细胞因子,可促进淋巴细胞生长、增殖、分化,能活化T 细胞,促进细胞因子产生;IL-4 可辅助B 细胞分化为抗体分泌细胞,参与IgE 抗体的合成和变态反应过程,在炎症反应中起关键作用[34],在机体免疫过程中IFN、IL-2增强了免疫调节功能,产生、活化更多的T 细胞和细胞因子,IL-4、IL-10 增强了变态反应,使动物机体炎症、过敏反应加强,对照组IL-4、IL-10 均高于试验Ⅰ组和试验Ⅱ组,可能与断奶后羔羊腹泻数量增加有关。
4 结论
本试验结果可知,日粮中添加0.3%的18β-甘草次酸可显著提高断奶后30 d内羔羊的体重,增强断奶羔羊抗氧化应激能力,提高血清中SOD、GSH-Px、TAOC并降低MDA含量;提高断奶羔羊IFN、IL-2,降低炎性因子IL-4、IL-10产生。可见日粮中添加0.3%的18β-甘草次酸可提高断奶羔羊的生长性能,提高机体抗氧化能力,增加机体免疫力,降低因断奶应激诱发的腹泻发病数,降低羔羊消化道炎症反应。
