非小细胞肺癌患者肿瘤微环境中TAMs及PD-1表达水平及与临床预后的关系
2021-12-29张佳秀邓林锋石建邦吴健卫
张佳秀 邓林锋 石建邦 吴健卫▲
1.江西省九江市第一人民医院呼吸内科,江西九江 332000;2.江西省九江市第一人民医院检验科,江西九江 332000
目前,肺癌严重威胁我国国民健康,仍是我国现阶段发病率和致死率最高的恶性肿瘤[1]。肺癌分小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)两种,其中NSCLC约占肺癌的85%,预后差,5年生存率不足15%[2]。随着研究的深入,有学者发现,肿瘤的发生、发展、复发和转移与肿瘤微环境中非肿瘤细胞成分密切相关[3]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAMs)占肿瘤微环境中炎症细胞总数的30%~50%,巨噬细胞在不同的微环境中表现出不同的活化状态(M1 与 M2)[4]。程序性死亡受体 1(programmed death receptor-1,PD-1)能有效抑制T、B细胞的功能和增殖,参与肿瘤微环境形成[5]。本研究以NSCLC患者为研究对象,检测患者肺癌组织、癌旁组织标本中M1型、M2型TAMs及PD-1的表达水平,旨在观察不同临床预后因素及1年生存状态下TAMs表型和PD-1表达水平分布特征。
1 资料与方法
1.1 一般资料
选取2019年1月至12月于九江市第一人民医院胸外科初次确诊且择期手术的76例NSCLC患者作为研究对象。纳入标准:①患者病理性组织为NSCLC;②依据国际抗癌联盟(UICC)第八版肺癌分期标准[6]术后病理分期为Ⅰ~Ⅲa期;③择期行根治手术;④术前未行放疗或者化疗治疗;⑤首发病例,临床病理资料较为齐全;⑥癌旁正常组织采自同一位患者。排除标准:①患者合并自身免疫性疾病或者感染性疾病;②患者病例资料不完整者;③患者合并其他任何系统肿瘤;④凝血功能异常者;⑤严重慢性病史者;⑥失访者。本研究经九江市第一人民医院医学伦理委员会审核批准,研究对象均了解研究方案并签署知情同意书。
1.2 方法
1.2.1 记录患者的一般情况 包括年龄、性别、肿瘤分期、肿瘤类型、分化程度,所有患者完善相关检查后进行择期手术,术中采集肿瘤组织和癌旁正常组织,送快速病理与免疫组化检测,对所有患者进行为期1年的随访,记录患者1年内生存率。
1.2.2 组织样本处理 肿瘤组织离体后半小时内于肿瘤组织纵切面的非坏死区域采集标本,充分采集体积大小为0.5 cm×0.5 cm×0.5 cm的癌组织,于肿瘤组织的边缘5 cm处采集以上正常的肺部黏膜相应癌旁组织样本,离体后均经过DEPC水进行清洗,送快速病理与免疫组化检测。
1.2.3 PD-1、CD86、CD206荧光染色 ①固定:室温下4%的多聚甲醛固定细胞,充分孵育10 min,PBS清洗3次,每次15 min。②抗原修复:将玻片置于提前加热好的抗原修复液进行抗原修复,温度保持95℃,继续加热10 min,过程中防止煮沸,完成后PBS溶液清洗3次,每次5 min。③通透:PBS溶液孵育10 min,采用Triton X-100进行透膜处理,室温下20 min,完成后PBS溶液清洗3次,每次5 min。④封闭与免疫染色:含有1%的BSA的甘氨酸进行封闭,37℃ 30 min,完毕后进行抗体染色,一抗 PD-1(1∶200)和一抗 CD8(1∶200)、一抗 CD86(1∶1500)以及一抗 CD206 抗体(1∶100)按比例稀释后室温下湿盒中孵育1 h,完毕后PBS溶液洗涤3次,每次5 min。常温下,二抗GAR AF488抗体(绿色荧光,1∶200)按比例采用1%的BSA稀释,避光条件下室温孵育1 h。完成后PBS溶液洗涤3次,每次5 min。⑤复染:采用0.1 μg/ml的DAPI染色液染核15 min,完毕后PBS溶液清洗3次,每次5 min。⑥封片:采用抗荧光淬灭剂进行封片,完成后4℃保存待检。⑦荧光显色与分析:采用OLYMPUS VS-ASW 2.9系统20倍物镜下进行拍照,Image-pro Plus 6.0软件进行定量分析,根据HIS选色方案判定面积,筛除小于50像素的非特异性杂点,对PD-1、CD86、CD206标记的阳性细胞进行记录。
1.3 观察指标
①观察被纳入NSCLC患者肿瘤组织与癌旁组织PD-1、CD86、CD206荧光染色阳性表达;②NSCLC患者肿瘤组织与癌旁组织PD-1、CD86、CD206表达的相关性;③不同临床预后因素下TAMs表型和PD-1表达水平分布特征;④NSCLC患者1年生存率的影响因素。
1.4 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t检验;计数资料用率表示,两组间比较采用χ2检验,相关性分析采用Pearson相关性分析;采用COX回归分析NSCLC患者1年生存率的影响因素,以P<0.05为差异有统计学意义。
2 结果
2.1 PD-1、CD86、CD206在NSCLC肿瘤组织中的表达
NSCLC患者癌组织PD-1、CD206阳性表达高于癌旁组织,CD86阳性表达低于癌旁组织,差异有统计学意义(P<0.05)(表 1,图 1,封三)。
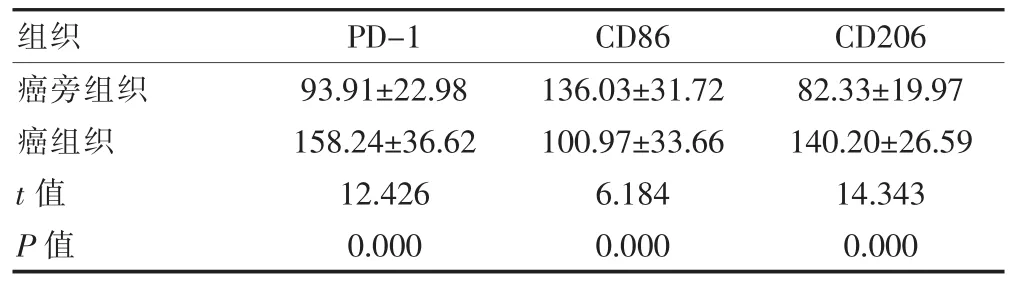
表1 NSCLC患者癌旁组织和癌组织PD-1、CD86、CD206免疫荧光染色阳性细胞数的比较
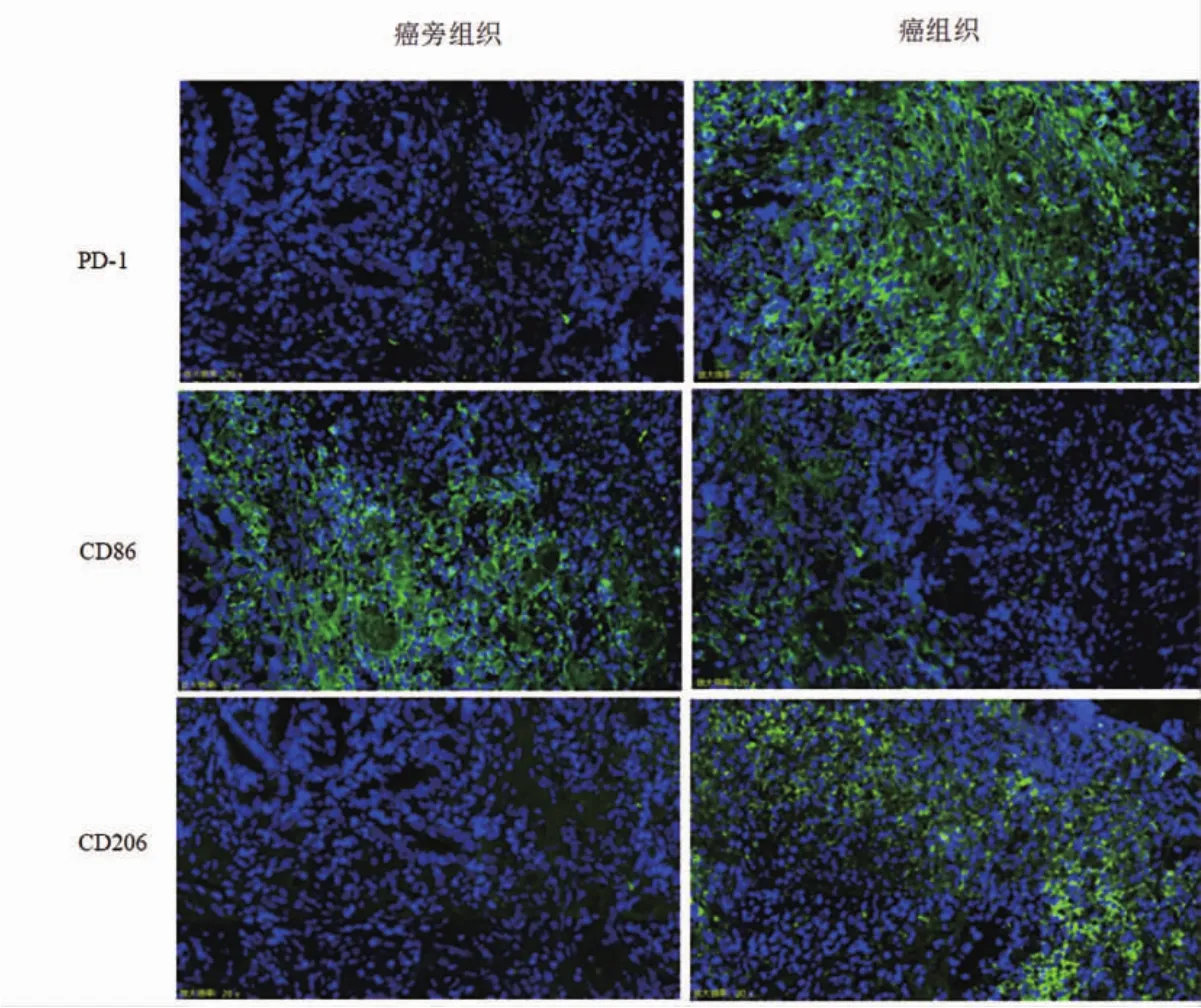
图1 NSCLC患者癌旁组织和癌组织PD-1、CD86、CD206免疫荧光染色图(200×)(见内文第6页)
2.2 NSCLC患者肿瘤组织与癌旁组织PD-1、CD86、CD206表达的相关性分析
NSCLC患者癌旁组织 PD-1、CD86、CD206阳性表达两两间均无相关性(P>0.05)。癌组织PD-1和CD206阳性表达成正相关(P<0.05),癌组织PD-1和CD86、CD86 和 CD206 无明显相关性(P>0.05)(表 2~3)。

表2 NSCLC患者癌旁组织PD-1、CD86、CD206表达的相关性分析(r值/P值)
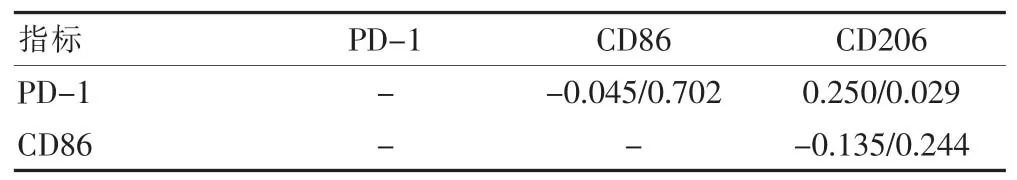
表3 NSCLC患者肿瘤组织PD-1、CD86、CD206表达的相关性分析(r值/P值)
2.3 NSCLC患者不同临床预后因素下PD-1、CD86、CD206表达分布
不同性别和年龄 NSCLC患者的 PD-1、CD86、CD206表达比较,差异无统计学意义(P>0.05)。腺癌PD-1阳性表达水平高于鳞癌,差异有统计学意义(P<0.05)。高分化CD86表达水平高于低分化和中分化,差异有统计学意义(P<0.05);高分化和中分化CD206表达水平低于低分化,差异有统计学意义(P<0.05)。临床Ⅲ期和Ⅱ期PD-1阳性表达水平高于Ⅰ期,差异有统计学意义(P<0.05);临床Ⅲ期和Ⅱ期CD86阳性表达水平低于Ⅰ期,差异有统计学意义(P<0.05)。浸润性生长患者的CD206表达水平高于非浸润性生长,差异有统计学意义(P<0.05)(表 4)。
表4 NSCLC患者不同临床预后因素下PD-1、CD86、CD206表达分布(±s)
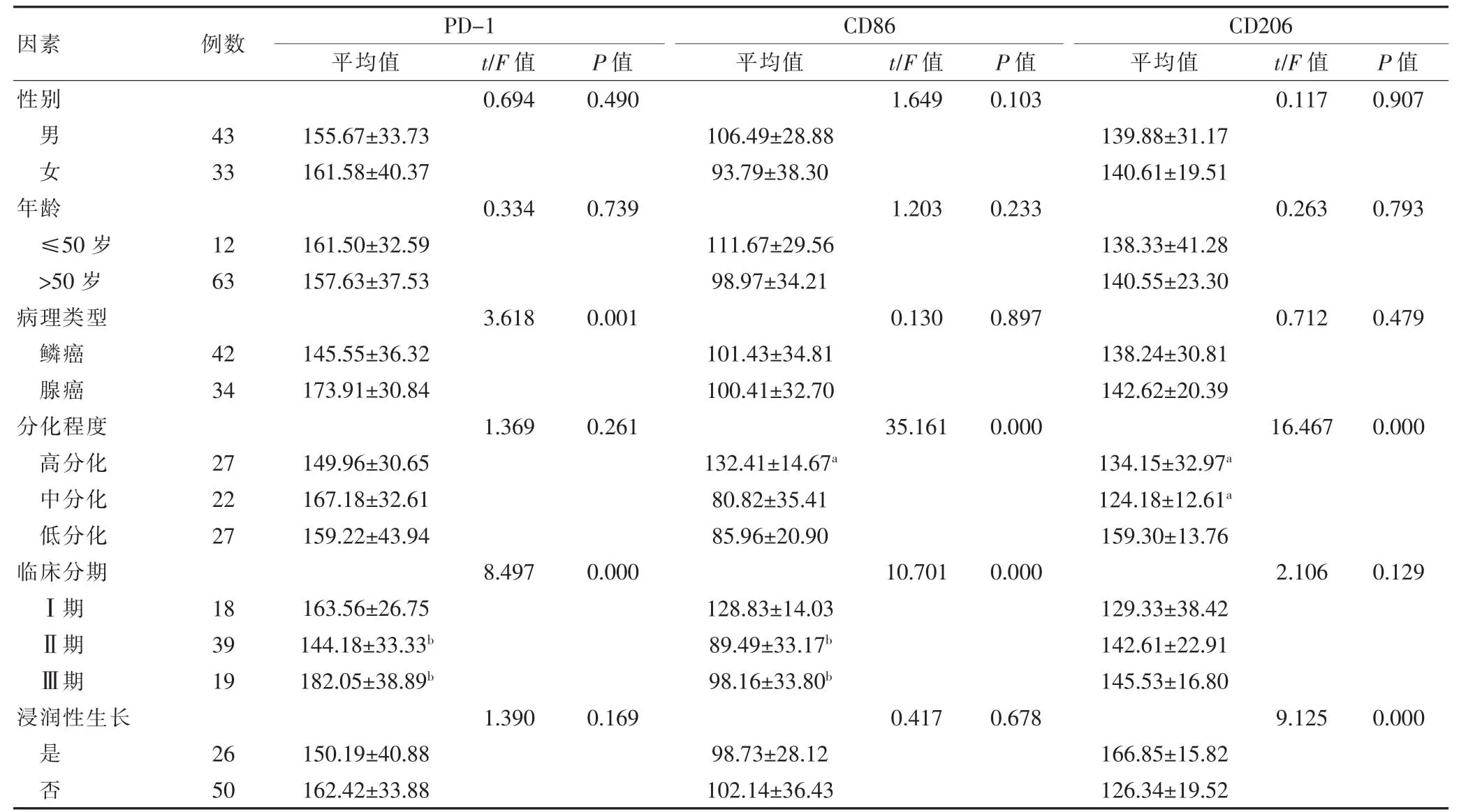
表4 NSCLC患者不同临床预后因素下PD-1、CD86、CD206表达分布(±s)
与低分化比较,aP<0.05;与 1 期比较,bP<0.05
因素 例数 PD-1平均值 t/F值 P值images/BZ_13_1145_372_1166_414.pngCD86平均值 t/F值 P值images/BZ_13_1716_372_1737_414.pngCD206平均值 t/F值 P值性别0.6940.4901.6490.1030.1170.907男女43 33 155.67±33.73 161.58±40.37 106.49±28.88 93.79±38.30 139.88±31.17 140.61±19.51年龄≤50岁>50岁病理类型鳞癌腺癌分化程度高分化中分化低分化临床分期Ⅰ期Ⅱ期Ⅲ期浸润性生长12 63 42 34 27 22 27 18 39 19 161.50±32.59 157.63±37.53 145.55±36.32 173.91±30.84 149.96±30.65 167.18±32.61 159.22±43.94 163.56±26.75 144.18±33.33b 182.05±38.89b 0.334 3.618 1.369 8.497 1.390 0.739 0.001 0.261 0.000 0.169 111.67±29.56 98.97±34.21 101.43±34.81 100.41±32.70 132.41±14.67a 80.82±35.41 85.96±20.90 128.83±14.03 89.49±33.17b 98.16±33.80b 1.203 0.130 35.161 10.701 0.417 0.233 0.897 0.000 0.000 0.678 138.33±41.28 140.55±23.30 138.24±30.81 142.62±20.39 134.15±32.97a 124.18±12.61a 159.30±13.76 129.33±38.42 142.61±22.91 145.53±16.80 0.263 0.712 16.467 2.106 9.125 0.793 0.479 0.000 0.129 0.000是否26 50 150.19±40.88 162.42±33.88 98.73±28.12 102.14±36.43 166.85±15.82 126.34±19.52
2.4 NSCLC患者1年生存率的影响因素
所有患者生存随访截止时间为2021年3月,76例NSCLC患者死亡18例,存活58例,1年生存率为76.32%。将纳入因子进行变量赋值,性别(男=1,女=0)、肿瘤类型(鳞癌=0,腺癌=1)、分化程度(高分化=1,中分化=2,低分化=3)、临床分期(Ⅰ期=1,Ⅱ期=2,Ⅲ期=3)、浸润性生长(否=0,是=1),年龄、PD-1、CD86、CD206表达水平均为连续变量,结果显示,PD1和CD206是NSCLC 患者 1年生存率的危险因素(P<0.05)(表 5)。
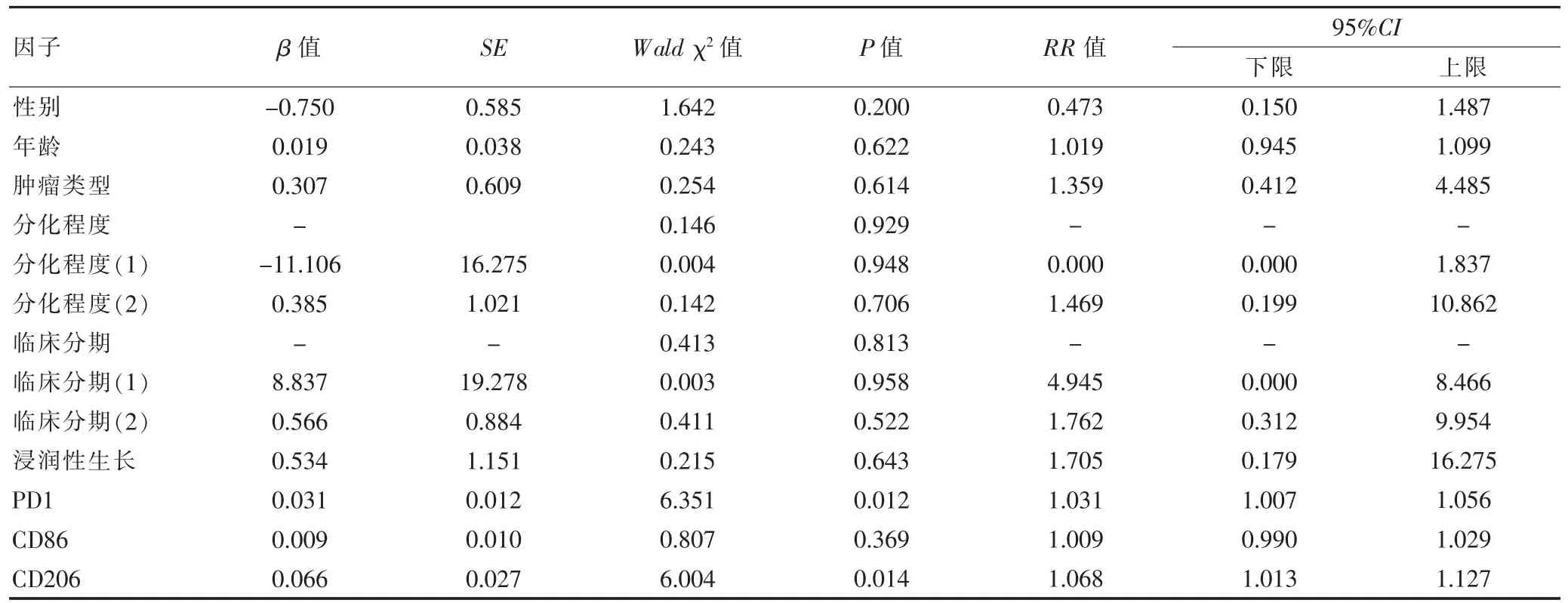
表5 NSCLC患者1年生存率的COX回归分析
3 讨论
NSCLC是临床常见的恶性肿瘤,患者发病后病情进展早期多隐匿,速度快,多数病患在确诊时已经步入中晚期阶段,预后较差,患者的五年生存率低于15%[2],国内学者相关研究[7]报道,NSCLC患者1年生存率为50%~80%,本研究纳入的76例NSCLC患者1年生存率为76.32%,与上述研究报道基本一致,可见NSCLC患者1年生存率不容乐观。因此NSCLC的临床治疗仍存在诸多难点,患者预后状态的提升仍面临巨大挑战,为有效提升患者的治疗效果,使其生存时间及生活质量得到提高,有必要探索更加高效的治疗模式,对NSCLC患者的临床预后具有十分重要的临床意义。
现已证实,PD-1在正常健康机体组织中,仅在巨噬细胞中活化表达,但在多种类型癌变组织中能够检测到PD-1蛋白的活化表达,如乳腺癌[8]、黑色素瘤[9]、肾癌[10]等,这一特征提示其在正常机体组织中的表达可能受到非常严格的转录后调控,但在恶性肿瘤组织中的调控机制出现异常,从而引起PD-1的异常过表达现象,并对肿瘤疾病本身发生及进展发挥着助推作用[11-12]。本研究结果显示,PD-1在NSCLC患者肿瘤组织中表达明显高于癌旁组织,且腺癌患者PD-1阳性表达水平高于鳞癌,临床Ⅲ期和Ⅱ期患者PD-1阳性表达水平高于Ⅰ期,差异有统计学意义(P<0.05),一方面提示PD-1在NSCLC肿瘤组织中存在异常高表达状态,另一方面证实PD-1在肺腺癌肿瘤组织中高表达,且具有促癌特性。CD86和CD206分别是M1型巨噬细胞和M2型巨噬细胞表面的特异性抗体,在肿瘤的发生和发展中扮演不同的角色,M1型巨噬细胞属激活型,M2型巨噬细胞在肿瘤发展过程中能够有效激活M1型巨噬细胞,破坏肿瘤微环境[13-14];此外,肿瘤发生和进展过程中巨噬细胞功能异常紊乱,M2型巨噬细胞多表现为异常极化现象,促进肿瘤组织的重塑,推动相关肿瘤组织细胞的发展过程[15]。本研究结果显示,NSCLC患者癌组织CD86阳性表达低于癌旁组织,且高分化患者CD86表达水平高于低分化和中分化,临床Ⅲ期和Ⅱ期CD86阳性表达水平低于Ⅰ期,差异有统计学意义(P<0.05),提示M1型巨噬细胞在肿瘤的发展过程中的抑制状态,有望成为肿瘤代谢调节和免疫治疗的新靶点[16],但本研究COX回归分析中CD86与患者1年生存率未表现出明显相关性。本研究结果还显示,NSCLC患者癌组织CD206阳性表达高于癌旁组织,高分化和中分化CD206表达水平低于低分化,浸润性生长患者CD206表达水平高于非浸润性生长,差异有统计学意义(P<0.05),进一步证实M2型巨噬细胞的促癌作用,且M2型巨噬细胞浸润性明显高于M1型巨噬细胞,与巨噬细胞在多种肿瘤因子和炎症因子作用下向M2型巨噬细胞极化有关[17]。
有学者在研究中指出,予以机体PD-1抗体阻断可提升巨噬细胞吞噬率[18]。PD-1和B7H1基因缺陷小鼠的基础研究发现,小鼠细菌的负荷能力明显降低,同时巨噬细胞的吞噬能力明显升高,免疫耐受性上升,生存期明显改善[19]。B7H1基因与巨噬细胞表面抗原递呈相关分子表达有关,可能参与巨噬细胞的极化[20],上述研究提示PD-1与巨噬细胞的极化状态以及炎症反应可能同样存在一定的关系。本研究对NSCLC患者肿瘤组织PD-1、CD86和CD206阳性表达进行相关性分析,结果显示,NSCLC患者肿瘤组织PD-1表达与CD206阳性表达成正相关(P<0.05),由于M2型巨噬细胞具有促癌作用,故有理由推测PD-1可能参与M2型巨噬细胞的异常极化,共同促进癌症的进展,有待进一步研究证实。此外,COX回归分析显示,PD-1与CD206高阳性表达均是NSCLC患者1年内死亡率的危险因素,二者有望成为NSCLC患者治疗新靶点。
综上所述,NSCLC癌组织及癌旁组织中PD-1、CD86和CD206的表达存在明显差异,PD-1高表达、M2型巨噬细胞的高浸润特性可明显增加患者1年内死亡率。
