慢性阻塞性肺疾病急性加重期患者8-OHdG、8-iso-PG及ET-1水平与认知功能的相关性
2021-12-29杨思伟余美琼
袁 圆,杨思伟,余美琼
慢性阻塞性肺疾病(chronic obstructive pul‐monary disease,COPD)作为呼吸科常见的疾病之一,COPD 多发于秋冬寒冷季和中年人群。相关数据显示,我国从2014 年至2018年40 岁以上COPD发病率已由8.7% 上升至13.7%,具有高发病率、高致残率、高病死率、治疗费用高的特点[1]。其早期临床特征主要表现为咳嗽、咳痰、呼吸困难和胸闷等,不及时治疗,进一步可发展为肺源性心脏病和呼吸衰竭等常见慢性呼吸道疾病,严重危害患者生命安全。COPD 的具体发病原因比较复杂,目前普遍认为机体的炎症反应是导致COPD 的主要原因[2]。同时,氧化应激反应在COPD 炎症反应的发生发展中也起到不容忽视的作用。大量研究发现,氧化应激反应加速人体的炎症反应发生,对各器官功能和中枢神经造成损伤,当中枢神经遭受损伤时,会出现认知功能障碍[3]。相关研究显示,稳定期COPD 患者约10% 会出现认知功能障碍,而急性加重期会高达22.6%,如需机械通气则增至43%[4]。8-羟基脱氧 鸟 苷(8 - hydroxy-2′- deoxyguanosine, 8-OHdG) 是DNA 氧化损伤的重要生物学标志物,COPD 患者血清8-OHdG 水平明显升高[5]。8-异前列腺素( 8-isoprostaglandin,8-iso-PG) 是一种能够准确反映患者体内氧化应激状态的特异性标志物[6]。内皮素-1(endothelin-1,ET-1)是一种重要的促炎因子,血中ET-1 水平与机体认知功能呈显著正相关[7]。同时,大量研究显示,在COPD患者血清中8-OHDG、8-iso-PG、ET-1 水平呈增高状态,在急性加重期更为明显[8],而上述因子又均与认知功能具有密切关系,因此,8-OHdG、8-iso-PG、ET-1 可能与COPD 患者并发认知障碍具有密切相关性。本研究选择8-OHdG、8-iso-PG、ET-1 作为研究指标,探讨8-OHdG、8-iso-PG、ET-1 与AECOPD 患者认知功能障碍的相关性及临床意义。
1 资料与方法
1.1 一般资料 选取2019 年4 月-2021 年4 月在自贡市第一人民医院治疗的35 例慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstruc‐tive pulmonary disease,AECOPD)患者为AECOPD组,其中男21 例,女14 例,年龄46~70(61.79 ±7.53)岁,病程3~7(4.89±4.11)年;选取同期符合慢性阻塞性肺疾病急性稳定期(stable chronic ob‐structive pulmonary disease,SCOPD)患 者31 例 为SCOPD 组,其 中 男19 例,女12 例,年 龄44~81(65.82±8.64)岁,病程4~9(5.91±4.23)年;两组COPD 患者均是入院前6个月内按慢性阻塞性肺疾病全球倡议(global initiative for chronic obstructive lung disease,GOLD) 分 级 为Ⅲ级( 重 度30%≤FEV1% 预计值<50%)。同期在我院体检中心进行正常体检的健康人员30 例,设为对照组。经检验,各组基线资料无统计学意义(P>0.05)。
1.2 纳入与排除
1.2.1 纳入标准 ①所有COPD 入选患者均符合GOLD 中 的COPD 诊 断 标 准[9];②AECOPD 诊 断 标准:咳嗽、咳痰、气短情况短期内加重,可伴有发热感染表现,呼吸道症状加重超过平日的情况,需改变过往的治疗方式缓解症状;③SCOPD 诊断标准:咳嗽、咳痰、气短或喘息等症状稳定或轻微,病情基本恢复到急性加重期前状态;④所有入选患者及成员均签署知情同意书,且本研究通过我院伦理委员会批准(伦理号2021010)。
1.2.2 排除标准 ①合并有肺炎等呼吸系统疾病患者;②合并有心肌疾病、冠状动脉粥样硬化性心脏病等心血管疾病患者;③合并肿瘤及脏器功能不全的患者;④合并精神异常等不能配合完成研究的患者。
1.3 方法
1.3.1 认知功能评定 所有入选患者及成员应用蒙特利尔认知评估量表(Montreal cognitive assess‐ment,MoCA)进行认知功能评定,AECOPD 组患者于入组之后在安静和清醒状态下,SCOPD 组及对照组人员于入组当日,由同一批培训过的护士提问,入选对象回答的形式进行评定,患者量表包括视空间与执行能力、命名能力、语言能力、注意力、延迟回忆、抽象能力及定向力7 个认知领域,总分30 分,≥26 分为正常,分值越低表示认知功能障碍越严重。
1.3.2 8-OHdG、8-iso-PG、ET-1 检测 AECOPD 组患者于入院次日清晨,SCOPD组及对照组患者于入院当日清晨空腹抽取外周静脉血5 mL,3 000 r/min离心10 min 取上清,-80 ℃储存。采用酶联免疫吸附(enzyme linked immuno sorbed assay,ELISA)法测定血清8-OHDG、8-iso-PG、ET-1表达水平,试剂均由美国R&D公司提供。所有操作严格依据相关说明书步骤进行操作。
1.4 统计学处理 应用SPSS19.0 软件,计数资料以率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差()表示,多组间采用单因素方差分析,组内两两比较采用t检验,采用Pearson 相关系数对MoCA 评分与8-OHdG、8-iso-PG、ET-1 水平的相关性进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 MoCA 评分比较3 组MoCA 评分显示,AE‐COPD 组各项认知领域及MoCA 总分低于SCOPD组和对照组(P<0.05),SCOPD组命名能力与语言能力与对照组比较无统计学差异(P>0.05),其余领域与总分则显著低于对照组(P<0.05),表1。
表1 3组MoCA评分情况(±s)
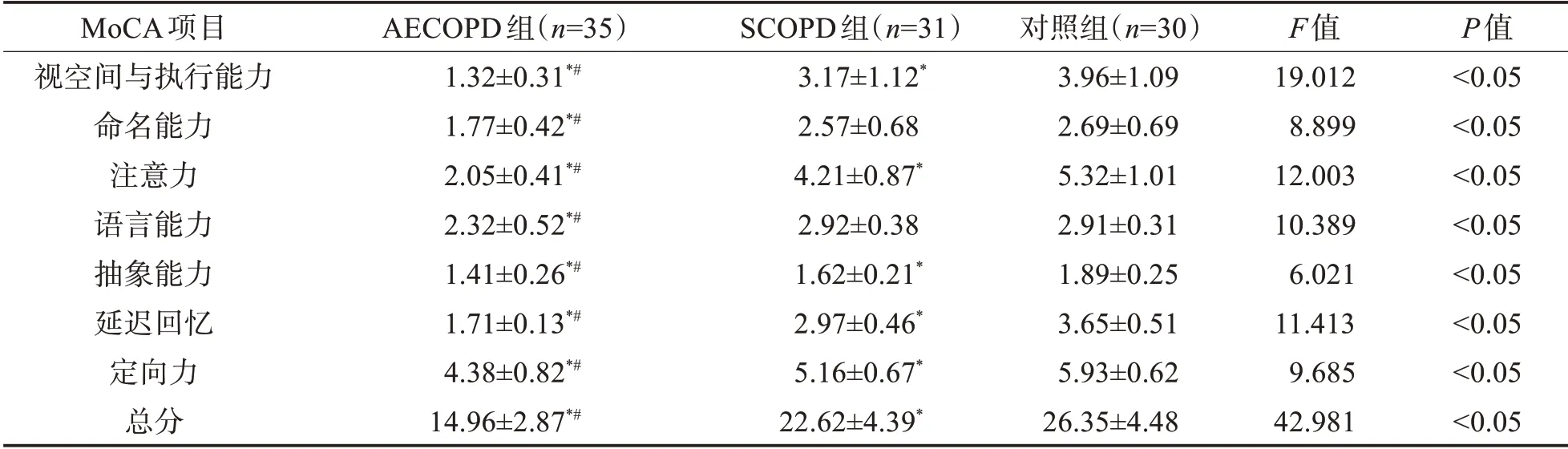
表1 3组MoCA评分情况(±s)
与对照组比较*P<0.05,与SCOPD组比较#P<0.05
MoCA项目视空间与执行能力命名能力注意力语言能力抽象能力延迟回忆定向力总分AECOPD组(n=35)1.32±0.31*#1.77±0.42*#2.05±0.41*#2.32±0.52*#1.41±0.26*#1.71±0.13*#4.38±0.82*#14.96±2.87*#SCOPD组(n=31)3.17±1.12*2.57±0.68 4.21±0.87*2.92±0.38 1.62±0.21*2.97±0.46*5.16±0.67*22.62±4.39*对照组(n=30)3.96±1.09 2.69±0.69 5.32±1.01 2.91±0.31 1.89±0.25 3.65±0.51 5.93±0.62 26.35±4.48 F值19.012 8.899 12.003 10.389 6.021 11.413 9.685 42.981 P值<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05
2.2 8-OHdG、8-iso-PG、ET-1 水平比较 AECOPD组和SCOPD 组8-OHdG、8-iso-PG、ET-1 水平显著高于对照组(P<0.05),两两比较AECOPD 组各项指标水平显著高于SCOPD组(P<0.05),表2。
表2 3组8-OHdG、8-iso-PG、ET-1水平比较(±s)

表2 3组8-OHdG、8-iso-PG、ET-1水平比较(±s)
与对照组比较*P<0.05,与SCOPD组比较#P<0.05
组别AECOPD组SCOPD组对照组FP例数35 31 30- -8-OHdG(ng/mL)13.89±4.18*#6.56±2.56*2.17±0.63 27.832 0.000 8-iso-PG(pg/mL)35.63±6.59*#22.19±5.62*17.63±3.69 12.649 0.001 ET-1(pg/mL)94.86±21.52*#59.87±16.28*19.96±4.26 19.563 0.001
2.3 MoCA 评分与8-OHdG、8-iso-PG、ET-1 水平的相关性分析 经Pearson 检验,COPD 急性加重患者血清8-OHdG、8-iso-PG、ET-1 水平与MoCA 评分呈负相关(P<0.05),表3。

表3 3组MoCA评分与8-OHdG、8-iso-PG、ET-1水平的相关性
3 讨论
COPD 是以不间断性气流受限为主要临床特征并伴有全身炎症反应的呼吸系统疾病,随着病情的进展可诱发高碳酸血症或低氧血症。2017 年GOLD 指南中指出COPD 通常与气道和肺脏对有毒颗粒或气体的慢性炎症反应增强有关,由于气道与肺脏长期低氧或与有毒物质接触可导致其清除自由基力减弱,从而使机体细胞内自由基的产生和清除平衡打破,发生氧化应激反应,同时,产生的大量活性氧又具有细胞毒性反应,通过损伤DNA、蛋白质等进行诱导细胞凋亡,对周围组织、细胞进行破坏。目前,国内已有大量研究证实,COPD 患者认知功能普遍存在明显下降[10]。
8-OHdG 是DNA 氧化损伤的最终产物,主要有大量活性氧自由基攻击组织细胞核及线粒体DNA中鸟嘌呤碱基第8 位碳原子而生成[5]。8-OHdG 在阿尔茨海默病中表达水平明显增高,表明8-OHdG可从多疾病角度评估患者认知功能,但8-OHdG 在COPD 患者中作用研究甚少,在急性加重期更少。本研究显示,在COPD 患者体内8-OHdG 水平急性加重期显著高于稳定期和对照组,稳体期患者体内8-OHdG水平高于对照组。本研究分析其机制可能为:AECOPD 患者体内氧化与抗氧化失衡,产生氧化应激,氧化应激直接损失肺内基质蛋白,破坏肺泡结构,从而形成肺气肿,影响患者肺功能。
8-iso-PG 不仅在氧化应激加重时大量生存,在血清、尿、呼出气体均能检测到[6],有研究表明,免疫球蛋白E、转化生长因子β1、白介素-6参与了哮喘和COPD 的气道炎症和肺损伤,在该病中具有重要作用[11],但8-iso-PG 与COPD 的发病以及急性加重风险尚不确定。本研究发现,在COPD 患者体内8-iso-PG 水平急性加重期显著高于稳定期和对照组,稳定期患者体内8-iso-PG 水平高于对照组。其具体机制目前尚不清楚,本研究推测可能与8-iso-PG可刺激血管和心肌细胞的增值和分化以及ET-1 的释放有关,加重肺组织的损伤。
ET-1是一种重要的血管活性物质,是血管内皮损伤性疾病的共同致病因子,具有收缩气管、支气管以及促进血管平滑肌增值的作用[7]。本研究发现,在COPD患者体内ET-1水平急性加重期显著高于稳定期和对照组,稳体期患者体内ET-1 水平高于对照组。其机制可能为:当肌体发生氧化应激反应时,ET-1引起血管内皮细胞内分泌异常导致微循环血管内皮细胞受损、通透性改变和舒张功能紊乱,同时通过刺激兴奋性氨基酸释放致使钙内流导致细胞凋亡,从而影响人体肺功能。
本研究显示,AECOPD 患者MoCA 分数最低,SCOPD 患者其次,对照组分数最高;而AECOPD 患者的血清8-OHdG、8-iso-PG、ET-1水平最高,SCOPD患者其次,对照组最低。进一步相关性分析显示AECOPD 患者和SCOPD 患者血清8-OHdG、8-iso-PG、ET-1 水平均与MoCA 评分呈负相关,AECOPD组Pearson相关系数更高,说明COPD血清8-OHdG、8-iso-PG、ET-1 水平与COPD 认知功能障碍呈正相关。这可能是因为氧化应激加速人体炎症反应,影响肺功能,此时对氧需求较大的中枢系统成为靶器官,同时ET-1与8-OHdG、8-iso-PG一同参与了AE‐COPD 患者认知障碍的发生与发展,促进炎症反应使花生四烯酸代谢产生大量氧自由基进一步加重脑损伤。
本研究存在的不足:①样本量较小,存在一定局限性;②缺乏一些认知受损的相关实验室指标;③对认知状态评价影响的因素较多,研究中无法做到全部纳入,后续还需进行更多的基础研究进行验证。
综上所述,8-OHdG、8-iso-PG、ET-1 与AECOPD患者认知功能呈正相关,可在一定程度上反应患者认知障碍程度。
