Raptor对髓系细胞破骨分化与骨吸收的抑制作用
2021-12-28赖玲林李素娟胡楚璇陈燕陈力何娟卢慧勤
赖玲林 李素娟 胡楚璇 陈燕 陈力 何娟 卢慧勤
1广东省第二人民医院临床研究部,广州 510317;2广东省第二人民医院药学部,广州 510317
骨质疏松症是以低骨密度及骨组织微构造退变为特性的一种全身性代谢骨病,伴有骨脆性增加,容易发生骨折,是当前世界上绝经后妇女、中老年人中发病率、病死率及保健费用损耗较大的疾病之一[1]。同时骨质疏松对许多疾病的发病率和病死率影响巨大,随着社会老年化的进程,重视骨质疏松症的发生发展是临床的研究热点。骨质疏松的发病机制主要是机体破骨细胞功能得到加强,作为骨组织成分的一种,破骨细胞功能增强会导致骨形成及骨吸收失偶联,使骨质量降低与骨量减少,最终导致骨质疏松症的发生[2]。现有的治疗药物双磷酸盐、雌激素及其受体调节剂、降钙素等由于其不可避免的不良反应,使用风险很大[3]。因此寻找新的治疗方案成为了骨质疏松临床治疗的研究热点。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)相 关 调 节 蛋 白(regulatory associated protein of mTOR,Raptor)是丝氨酸/苏氨酸激酶功能性复合物mTORC1的重要组分,在细胞生长、细胞周期、细胞分化、自噬和氨基酸摄取中都能发挥关键作用[4]。近期一项研究表明,mTORC1能够刺激Paget病患者的破骨细胞形成[5],但Raptor 是否在其中发挥作用尚未得知。于2020 年1 月至2021 年6 月本研究通过体外实验来探讨Raptor 对小鼠髓系细胞破骨分化与骨吸收的影响及其作用机制,以期为临床治疗骨质疏松提供新的思路与证据。
1 材料与方法
1.1 实验试剂 髓系细胞提取试剂盒购自中国上海晶抗生物工程有限公司;SYBR Green 染料购自中国北京索莱宝科技有限公司;PCR 引物由中国上海生工生物工程股份有限公司合成;破骨分化相关基因转录因子(spi-1 proto-oncogene,PU.1)、组织蛋白酶K(cathepsin K,CTSK)、Fos 蛋白(c-Fos)以及β-肌动蛋白(β-actin)抗体均购自美国ThermoFisher Scientific 公司;ELISA 试剂盒购自中国上海酶联生物科技有限公司。
1.2 实验动物 健康雄性6~8 周龄清洁级B6/C57 小鼠10 只购自北京大学医学部[生产许可证为SCXK(京)2018-0010],采用标准饲料与饮用水喂养,饲养温度保持在(25±2)℃,相对湿度保持在(40±2)%。对动物房进行定期消毒和通风,总共进行适应性饲养7 d后进行实验。敲除组通过基因敲除构建髓系细胞特异性敲除Raptor小鼠模型。
1.3 方法
1.3.1 样本收集 两组小鼠正常饲养14 d 后处死,并收集血清以及通过试剂盒分离髓系细胞,在含有10%小牛血清的培养皿中培育一段时间后通过100 μg/L 的sRANKL诱导形成破骨细胞。
1.3.2 免疫印迹试验(Western blot) 将收集到的处理后细胞悬液在离心半径10 cm 的条件下,以1 200 r/min离心5 min 后,弃去上清液,然后加入RIPA 裂解液和PMSF 蛋白酶抑制剂提取总蛋白,提取出的蛋白放入10 ml EP 管中,然后向其中加入5 倍体积的十二烷基磺酸钠,混匀后放入95~100 ℃沸水中水煮变性,冷却后放入-20 ℃备用。每次向准备好的电泳配件中加入10 μl 蛋白,设置电泳条件为80 V 恒压,30 min,结束后改变电泳条件为120 V 恒压,50~60 min。当所需的蛋白分子量所在区域有一定分离度时可提前停止电泳。之后进行转模,条件为200 mA 恒流,按分子量确定时间。转膜后分别孵育破骨分化相关基因PU.1、CTSK、c-Fos 抗体与相对应的辣根过氧化物酶标记的二抗,最后将含有蛋白标记的膜洗净,涂上化学发光显影液通过显影仪拍照,对结果用ImageJ 软件对灰度值进行系统性分析。
1.3.3 反转录-聚合酶链反应(RT-PCR) 将将收集到的处理后细胞悬液在离心半径10 cm的条件下,以1 200 r/min离心5 min 后,弃去上清液,向沉淀中加入适量TRIzol 试剂,在冰上孵育5~10 min后加入预冷过的氯仿0.2 ml。继续冰上孵育5 min 后1 200 r/min 离心15 min,转移水相,加入等体积异丙醇后再次离心10 min,弃上清液。加预冷75%乙醇溶液洗涤,弃上清后风干,加入40~200 μl的无酶水溶解制得RNA 备用。通过制备的RNA 反转录成cDNA,然后加入SYBR Green 染料与正反向引物混合离心(引物序列见表1),随后于PCR仪上进行扩增,循环完成后做溶解曲线。以采集到的荧光信号值(Ct 值)进行相对定量分析,比较2 组细胞中JAK3的mRNA 表达水平。
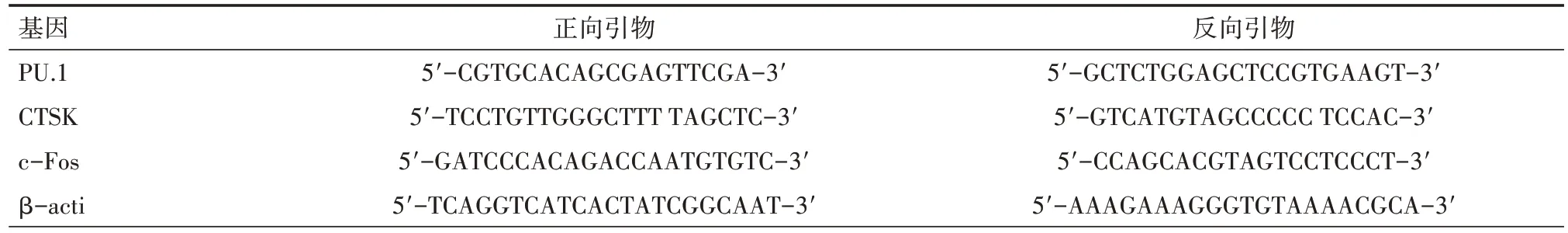
表1 破骨分化相关基因引物序列
1.3.4 酶联免疫吸附试验(ELISA) 取出部分小鼠血清,在离心半径10 cm 的条件下,以1 200 r/min离心5 min后转移上清液至干净的EP 管,按照ELISA 试剂盒步骤对样本骨吸收代谢产物I 型胶原C 端肽(C-telopeptide of type I,CTXI)、I 型胶原 N 端肽(N-telopeptide of type I,NTX1)及尿羟脯氨酸(U-Hydroxyproline,U-HYP)进行标记,通过酶标仪测量450 nm 处的吸光度,并以标准曲线来计算其中U-CTXI与U-NTXI含量。
1.4 统计学处理 所有结果取得数据都是基于3次及以上重复实验获得,且计量资料符合正态分布,并以均数±标准差()表示,组间比较采用独立样本t检验。数据分析所使用的软件为SPSS 22.0 版本,当P<0.05 时为差异有统计学意义。
2 结 果
2.1 Western blot检测2组细胞PU.1、CTSK、c-Fos的蛋白表达情况 采用Western blot技术检测2组破骨分化相关基因蛋白表达水平的变化,结果如图1 所示,与对照组相比,敲除Raptor 后敲除组小鼠髓系细胞中破骨分化相关基因PU.1、CTSK、TRAP 的蛋白表达量显著降低(均P<0.05)。
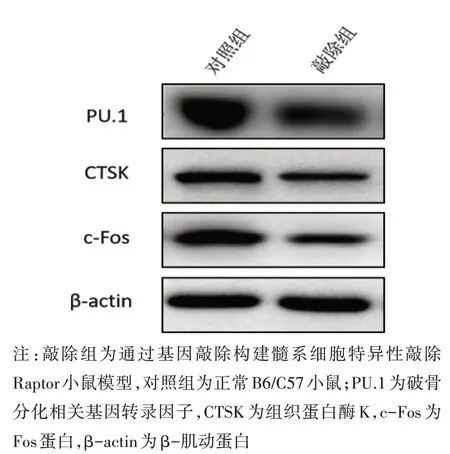
图1 2 组小鼠细胞中破骨分化相关基因的蛋白水平(重复3次)
2.2 RT-PCR 检测 2 组细胞中 PU.1、的 mRNA 表达情况 采用RT-PCR 技术敲除破骨分化相关基因mRNA 表达水平的变化,结果如图2所示,与对照组相比,敲除Raptor后敲除组小鼠髓系细胞中破骨分化相关基因PU.1、CTSK、TRAP 的mRNA 表达量显著降低,与蛋白趋势较为一致(均P<0.05)。
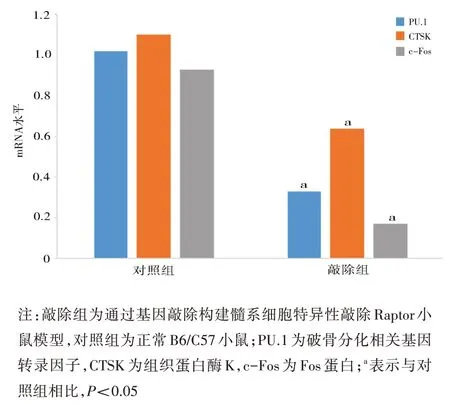
图2 2组小鼠细胞中PU.1、CTSK、c-Fos的mRNA水平(重复3次)
2.3 ELISA 检测2 组细胞中骨吸收指标的表达情况ELISA 结果显示,与对照组相比,Raptor 敲除小鼠血清CTXI、NTX1及U-HYP表达量显著降低,差异均有统计学意义(P<0.05),具体见表2。
表2 2组小鼠细胞中骨吸收代指标CTXI、NTX1及U-HYP的表达情况()
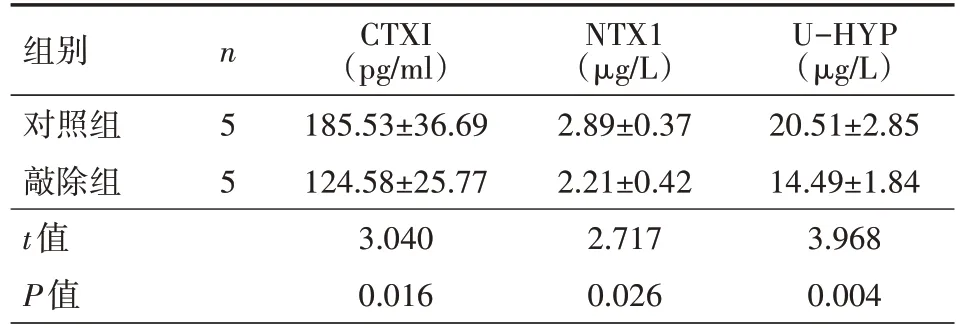
表2 2组小鼠细胞中骨吸收代指标CTXI、NTX1及U-HYP的表达情况()
注:敲除组为通过基因敲除构建髓系细胞特异性敲除Raptor小鼠模型,对照组为正常B6/C57 小鼠;CTXI 为I 型胶原C 端肽,NTX1为I型胶原N端肽,U-HYP为尿羟脯氨酸
U-HYP(μg/L)20.51±2.85 14.49±1.84 3.968 0.004组别对照组敲除组t值P值n 5 5 CTXI(pg/ml)185.53±36.69 124.58±25.77 3.040 0.016 NTX1(μg/L)2.89±0.37 2.21±0.42 2.717 0.026
3 讨 论
骨质疏松症一直是临床治疗的难点问题,其发病机制主要与破骨细胞的增殖分化有关。破骨细胞是一类来源于髓系前体细胞,其分化主要经历了几个重要的分化阶段:造血干细胞分化成髓系前体;髓系前体形成破骨细胞前体;破骨细胞前体再分化形成单个核的破骨细胞;多个单个核的破骨细胞融合形成多个核的成熟的破骨细胞[6]。在健康人体内其骨组织中具有骨吸收功能的破骨细胞与具有骨形成功能的成骨细胞保持着平衡,一旦出现紊乱则会造成不良影响,如破骨细胞分化水平增加会导致骨吸收功能增强,从而导致骨质疏松的发生[7]。目前临床治疗药物均有较大的风险与不良反应,近年来靶向治疗已成为临床研究的热点,以抑制破骨细胞分化形成和骨吸收功能为靶点已经成为目前治疗破骨细胞相关骨代谢疾病的主要策略。
破骨细胞是在骨组织的微环境下产生的,为了在体外获得稳定的破骨细胞,我们通过给予破骨细胞分化因子RANKL 诱导前体细胞破骨分化[8]。Raptor 作为 mTOR 调节蛋白,能够与mTOR 形成关键复合物mTORC1,在细胞的生长发育过程中发挥着重要作用。在本研究中,我们通过敲除小鼠Raptor 基因取得样本并进行一系列实验。PU.1、CTSK、c-Fos 是参与破骨细胞分化成熟的关键基因,其中PU.1 主要参与调控破骨细胞早期分化[9],介导了前体细胞向破骨细胞前体分化的形成和存活;CTSK 能够阻止多个单核破骨细胞融合成成熟的破骨细胞;c-Fos是JNK和ERK信号通路调节破骨细胞形成的重要参与者,参与了调节破骨细胞相关的特异性蛋白的表达,能够通过促使单核细胞更多地向巨噬细胞分化来阻滞破骨细胞定向分化[10]。在本研究中,Western blot 与 RT-PCR 实验结果显示,2 组细胞中成骨细胞分化相关基因PU.1、CTSK、c-Fos 的蛋白及mRNA 表达水平差异均有统计学意义,敲除Raptor基因后细胞PU.1、CTSK、c-Fos 的蛋白及mRNA 较对照组显著降低,提示Raptor基因与破骨细胞的分化具有紧密联系,Raptor在前体细胞分化成成熟的破骨细胞全过程中发挥着关键作用。CTXI、NTX1及U-HYP在之前的研究中与骨密度呈负相关,能够直观地体现骨吸收情况[11],在多项研究中骨质疏松患者体内CTXI、NTX1 及U-HYP 水平均显著高于健康对象者。在本研究中,ELISA 实验结果显示,敲除组血清CTXI、NTX1 及U-HYP 水平较对照组显著降低,提示敲除Raptor基因其骨吸收功能受到了明显抑制,这可能与敲除Raptor抑制了破骨细胞分化进程,从而降低了骨吸收功能有关。
综上所述,本研究通过对实验小鼠进行Raptor 基因敲除,并将提取的前体髓系细胞通过RANKL 进行诱导破骨分化并与未敲除Raptor 的样本进行对比,发现敲除Raptor 能够显著抑制成骨细胞分化相关基因PU.1、CTSK、c-Fos 的蛋白及mRNA 表达水平,降低骨吸收指标CTXI、NTX1 及U-HYP 的表达水平,从而发挥抑制破骨细胞分化的进程。本研究为临床治疗骨质疏松症及其他破骨细胞相关骨代谢疾病提供了新的思路与研究证据。
利益冲突:所有作者声明无利益冲突。
