五灵胶囊联合恩替卡韦治疗慢性乙型肝炎的临床疗效
2021-12-28周晓元罗润齐万蕾王俊洁张宿荣许晓明叶晓光
周晓元 罗润齐 万蕾 王俊洁 张宿荣 许晓明 叶晓光
广州医科大学附属第二医院感染病科(广州 510260)
慢性乙型肝炎(chronic hepatitis B,CHB)是由乙型肝炎病毒(hepatitis B virus,HBV)持续感染引起的肝脏慢性炎症性疾病,临床表现为乏力、厌油、恶心、腹胀、肝区疼痛等症状,伴HBV DNA 阳性,ALT 持续或反复异常,或肝组织学检查加上有肝炎病变,有很高的传染性,一方面严重危害患者的身体健康,另一方面又影响社会公共安全,是需要高度重视的一种疾病。据统计,全球约2.92 亿人为慢性HBV 感染者,我国占约8 600 万例[1],其中CHB 患者有2 000 万~3 000 万例,约1/4~1/3[2]。全球由HBV 感染所导致的肝硬化和肝细胞癌(HCC)患者比例分别为30%和45%[3-4],但我国由HBV 感染所导致的肝硬化和HCC 患者比例更高,分别为60%和80%[5]。面对高比例的HBV 感染所致的肝硬化和HCC,选择强有力药物及时、有效治疗CHB 患者极为重要。迄今为止,尚未研发出对CHB 患者特效的药物。目前,慢乙肝的治疗目标为最大限度地长期抑制HBV 复制,减轻肝细胞炎性坏死及肝纤维化、肝功能衰竭、肝硬化失代偿、HCC 等发生。2015 年和2019 年版慢性乙型肝炎防治指南均推荐恩替卡韦(ETV)为抗乙肝病毒的一线核苷(酸)类似物(NAs),ETV 具有强效、低耐药、安全性高特点,故为临床使用最广的抗乙肝病毒药物。但有研究表明[6-7],单纯使用抗病毒治疗对保肝、抗纤维化以及硬化的效果有限。中医药是中华民族的文化瑰宝,LI 等[8]发现中药复方(调肝益脾方、调肝健脾解毒方)联合ETV 治疗方案的HBeAg清除率优于ETV单药治疗。因此,本研究观察五灵胶囊联合恩替卡韦分散片对CHB 患者的临床疗效,现报告如下。
1 资料与方法
1.1 一般资料回顾性收集广州医科大学附属第二医院感染病科门诊和住院2019 年4 月至2020 年9 月期间诊治的CHB 患者117 例,按治疗方法随机分为观察组62 和对照组55 例。观察组男35 例,女27 例;年龄21~65 岁,平均(43.2±6.3)岁,其中HBeAg 阳性CHB 34 例,HBeAg 阴性CHB 28 例。对照组男29 例,女26 例;年龄26~61 岁,平均(41.6± 9.2)岁;其中HBeAg 阳性CHB 30 例,HBeAg 阴性CHB 25 例。两组患者的一般资料比较差异无统计学意义(P>0.05),具有可比性(表1)。
表1 对照组与观察组CHB 患者一般资料比较Tab.1 Baseline characteristics of treatment group and control group
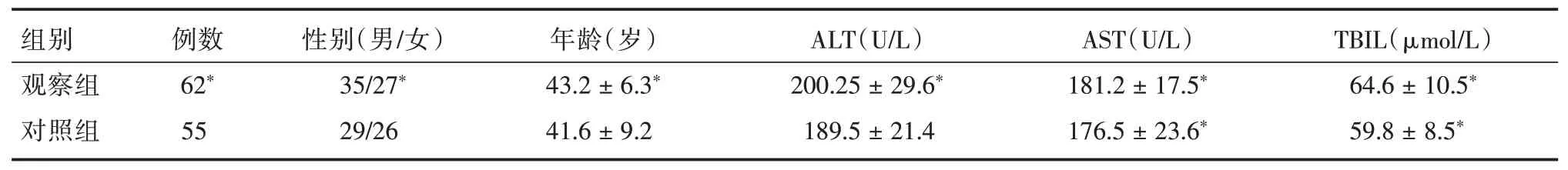
表1 对照组与观察组CHB 患者一般资料比较Tab.1 Baseline characteristics of treatment group and control group
注:观察组与对照组一般资料比较差异均无统计学意义,*P>0.05
1.2 诊断标准参考《慢性乙型肝炎防治指南(2015 年版)》[9]中CHB 的诊断标准:由乙型肝炎病毒持续感染引起的肝脏慢性炎症性的疾病,分为两种HBeAg 阳性和HBeAg 阴性CHB,其中HBeAg阳性CHB 指血清HBsAg 阳性,HBeAg 阳性,HBV DNA 阳性,ALT 持续或反复异常或肝组织学检查有肝炎病变;HBeAg 阴性CHB 指血清HBsAg 阳性,HBeAg 持续阴性,HBV DNA 阳性,ALT 持续或反复异常,或肝组织学检查有肝炎病变。
1.3 纳入与排除标准
1.3.1 纳入标准(1)符合诊断标准;(2)年龄18~65 岁;(3)无相关药物禁忌证、过敏史;(4)初次接受治疗,1 年内未接受过抗病毒药物、免疫调节剂、激素等治疗;(5)依从性良好,无精神病史;(6)患者自愿参与临床试验,均签署知情同意书;(7)受试者纳入时间:2019 年4-9 月。
1.3.2 排除标准(1)重叠其他肝炎病毒、人类免疫缺陷病毒(HIV)感染、自身免疫性疾病、酒精性肝病、中毒性肝损伤等;(2)肝硬化代偿期及失代偿期、肝衰竭、恶性肿瘤等;(3)妊娠妇女、合并血液系统疾病、风湿系统疾病、严重心肺肾及其他全身系统疾病等。
1.4 治疗方法和疗程对照组给予恩替卡韦分散片(正大天晴药业集团股份有限公司生产,国药准字H20100019)0.5 mg 口服,1 次/d,疗程24 周。观察组在对照组治疗的基础上,给予五灵胶囊(清华德人西安幸福制药有限公司生产,国药准字Z20090068)1.75 g 口服,3 次/d,饭后30 min 温开水送下,疗程24 周。
1.5 观察指标(1)分别比较HBeAg阳性和HBeAg阴性CHB 对照组和观察组0、4、12、24 周血清肝功能指标:采用全自动生化分析仪检测ALT、AST及0、24 周TBIL 水平(罗氏诊断产品(上海)有限公司);比较24 周后两组肝功能指标的复常率:ALT恢复正常值上限以下(<50 U/L)、AST 正常值上限以下(<40 U/L)及TBIL正常值上限以下(<22 U/L)。(2)采用放射免疫分析法(RIA)检测对照组和观察组0、24 周的肝纤四项指标:透明质酸(HA)、层粘蛋白(LN)、Ⅳ型胶原(Ⅳ-C)、Ⅲ型前胶原氨端肽(PIIINP)(北京北方生物技术研究所有限公司)。(3)采用实时荧光定量PCR法检测对照组和观察组0、24周的HBV DNA,检测下限以下(<3×103IU/mL)(罗氏诊断产品(上海)有限公司)。(4)采用化学发光免疫测定法(CLIA)检测血清HBeAg、HBsAg 水平(美国Abbott 公司)。
1.6 统计学方法应用SPSS 21.0软件包进行数据分析。符合正态分布的计量资料以均数±标准差表示,0、24 周两组间比较采用t检验,0、4、12、24周两组间比较采用重复测量方差分析;不符合正态分布计量资料以中位数(四分位数)表示,采用Mann-WhitneyU检验;计数资料比较采用χ2检验。以P<0.05 为差异具有统计学意义。肝功能指标复常率采用χ2检验及logistic 回归分析,ALT 累积复常率采用生存分析Kaplan-Meier 方法。
2 结果
2.1 HBeAg 阳性CHB 两组ALT 水平比较采用重复测量方差分析统计学方法,首先通过球形检验(Mauchly′s Test of Sphericity)P>0.05,观察组与对照组相比,治疗后的ALT较治疗前下降差异有统计学意义(处理效应与时间效应的交互作用F=12.76,P<0.05,处理主效应F=13.4,P<0.05),观察组与对照组的ALT都随治疗时间的增长而下降,并且两相邻时间点的下降差异有统计学意义(时间主效应F=310.05,P<0.05),但观察组ALT 随着治疗时间的延长,每个时间点观察(4、12、24 周)与对照组相比都明显下降,观察组治疗终点(24 周)ALT较治疗前下降更有显著,观察组疗效更好(表2)。从图1 中显示,随着治疗时间延长,两组曲线均呈下降趋势,但观察组曲线下降幅度更为明显。
表2 HBeAg 阳性CHB 两组血清肝功能指标ALT 水平比较Tab.2 Comparison of ALT levels between two groups of HBeAg positive CHB

表2 HBeAg 阳性CHB 两组血清肝功能指标ALT 水平比较Tab.2 Comparison of ALT levels between two groups of HBeAg positive CHB
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
2.2 HBeAg 阴性CHB 两组ALT 水平比较球形检验(Mauchly′s Test of Sphericity)P>0.05,观察组与对照组相比,治疗后的ALT 水平较治疗前下降差异有统计学意义(处理效应与时间效应的交互作用F=16.04,P<0.05,处理主效应F=11.04,P<0.05),观察组与对照组的ALT 水平都随治疗时间的增长而下降,并且两相邻时间点的下降差异有统计学意义(时间主效应F=286.12,P<0.05),同样的观察组ALT 水平随着治疗时间的延长,每个时间点观察(4、12、24 周)与对照组相比都明显下降,观察组治疗终点(24 周)ALT 水平较治疗前下降更显著,观察组疗效更好(表3、图1)。
表3 HBeAg 阴性CHB 两组血清肝功能指标ALT 水平比较Tab.3 Comparison of ALT levels between two groups of HBeAg negative CHB

表3 HBeAg 阴性CHB 两组血清肝功能指标ALT 水平比较Tab.3 Comparison of ALT levels between two groups of HBeAg negative CHB
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
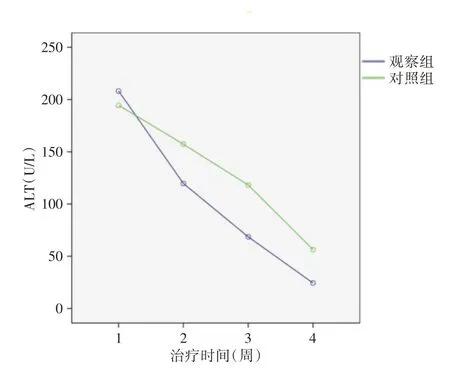
图1 HBeAg 阳性CHB 两组ALT 均值的比较Fig.1 Comparison of ALT levels between two groups of HBeAg positive CHB
2.3 HBeAg阳性CHB两组AST水平比较球形检验(Mauchly′s Test of Sphericity)P>0.05,观察组与对照组相比,治疗后的AST 水平较治疗前下降差异有统计学意义(处理效应与时间效应的交互作用F=7.219,P<0.05,处理主效应F=10.8,P<0.05),观察组与对照组的AST 水平都随治疗时间的增长而下降,并且两相邻时间点的下降差异有统计学意义(时间主效应F=272.98,P<0.05),同样的观察组AST 水平随着治疗时间的延长,每个时间点观察(4、12、24 周)与对照组相比都明显下降,观察组治疗终点(24 周)AST 水平较治疗前下降更有显著,观察组疗效更好(表4)。随着治疗时间延长,两组曲线均呈下降趋势,但观察组曲线下降幅度更为明显(图2)。
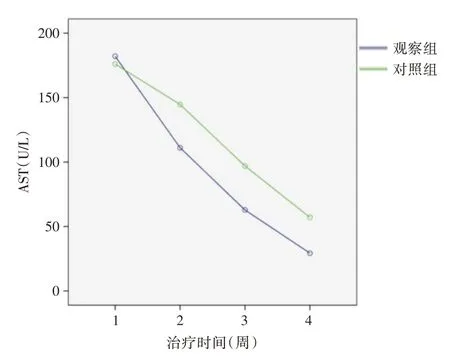
图2 HBeAg 阳性CHB 两组AST 均值比较Fig.2 Comparison of AST levels between two groups of HBeAg positive CHB
表4 HBeAg 阳性CHB 两组血清肝功能指标AST 水平比较Tab.4 Comparison of AST levels between two groups of HBeAg positive CHB

表4 HBeAg 阳性CHB 两组血清肝功能指标AST 水平比较Tab.4 Comparison of AST levels between two groups of HBeAg positive CHB
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
2.4 HBeAg阴性CHB两组AST水平比较球形检验(Mauchly′s Test of Sphericity)P>0.05,观察组与对照组相比,治疗后的AST水平较治疗前下降差异有统计学意义(处理效应与时间效应的交互作用F=8.83,P<0.05,处理主效应F=11.5,P<0.05),观察组与对照组的AST 水平都随治疗时间的增长而下降,并且两相邻时间点的下降差异有统计学意义(时间主效应F=279.47,P<0.05),同样的观察组AST 水平随着治疗时间的延长,每个时间点观察(4、12、24 周)与对照组相比都明显下降,观察组治疗终点(24 周)AST 水平较治疗前下降更显著,观察组疗效更好(表5)。
表5 HBeAg 阴性CHB 两组血清肝功能指标AST 水平比较Tab.5 Comparison of AST levels between two groups of HBeAg negative CHB

表5 HBeAg 阴性CHB 两组血清肝功能指标AST 水平比较Tab.5 Comparison of AST levels between two groups of HBeAg negative CHB
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
2.5 两组治疗前后TBIL 水平比较在治疗24 周末,HBeAg 阳性观察组治疗后的TBIL 水平较治疗前降低(P<0.05),治疗后观察组TBIL 水平明显低于对照组(P<0.05,表6)。HBeAg 阴性观察组治疗后的TBIL 水平较治疗前降低(P<0.05),治疗后观察组TBIL 明显低于对照组(P<0.05,表7)。
表6 HBeAg 阳性CHB 两组血清肝功能指标TBIL 水平比较Tab.6 Comparison of TBIL levels between two groups of HBeAg positive CHB

表6 HBeAg 阳性CHB 两组血清肝功能指标TBIL 水平比较Tab.6 Comparison of TBIL levels between two groups of HBeAg positive CHB
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
表7 HBeAg 阴性CHB 两组血清肝功能指标TBIL 水平比较Tab.7 Comparison of TBIL levels between two groups of HBeAg negative CHB

表7 HBeAg 阴性CHB 两组血清肝功能指标TBIL 水平比较Tab.7 Comparison of TBIL levels between two groups of HBeAg negative CHB
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
2.6 两组治疗前后肝纤维化指标的比较在治疗24 周末,两组血清HA、LN、IIINP、IV-CP 水平均较治疗前下降(P<0.05),但观察组较对照组肝纤维化指标下降更为显著(P<0.05,表8)。
表8 两组血清肝纤维化指标比较Tab.8 Comparison of the liver fibrosis levels between two groups ,μg/L

表8 两组血清肝纤维化指标比较Tab.8 Comparison of the liver fibrosis levels between two groups ,μg/L
注:*与同组治疗前比较,P<0.05;△与对照组治疗后比较,P<0.05
2.7 两组治疗前后血清HBV-DNA 和HBeAg 转阴的情况在治疗24 周末,两组患者HBV-DNA 低于检测下限的比率(χ2=3.81,P>0.05),HBeAg 低于检测下限的比率(χ2=2.23,P>0.05)。
2.8 两组治疗后血清肝功能指标复常率的比较在治疗24 周末,观察组治疗后血清肝功能指标ALT、AST 及TBIL 复常率均显著高于对照组,差异有统计学意义(P<0.05,表9)。以肝功能指标复常为结局拟合logistic 回归模型ALT 回归模型:Logit Y=-0.256+2.49X,OR=12.056(P<0.05),提示观察组是ALT 复常的保护因素,是对照组ALT 复常的12倍;AST 回归模型:Logit Y=-0.721+2.128X,OR=8.56(P<0.05),提示观察组是AST 复常的保护因素,是对照组AST 复常的8.6 倍;TBIL 回归模型:Logit Y=-1.012+0.947X,OR=2.58(P<0.05),提示观察组是TBIL 复常的保护因素,是对照组TBIL复常的2.6 倍,其中,观察组是ALT 复常的最优保护因素。
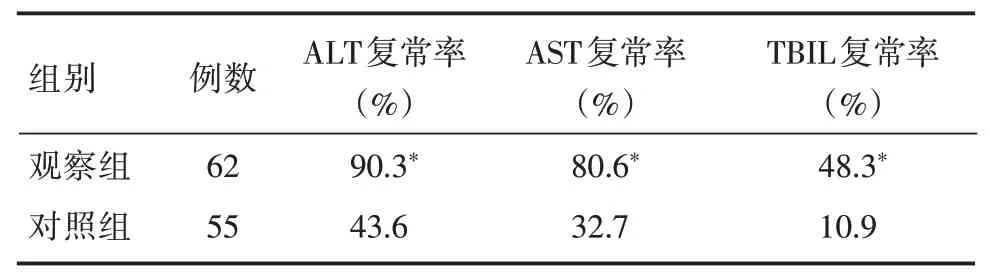
表9 两组治疗后血清肝功能指标ALT、AST 及TBIL 复常率的比较Tab.9 Comparison of ALT、AST and TBIL normalization rate between two groups
2.9 两组治疗前后ALT 累积异常率的比较延长治疗至48 周末,两组ALT 累积异常率生存曲线整体比较有统计学意义(Log Rank:χ2=10.847,P<0.05;Breslow:χ2=11.661,P<0.05),两组ALT累积复常率随时间的推移均有下降的趋势,但观察组下降更为明显,观察组ALT累积异常率小于对照组,即ALT 累积复常率高于对照组。24 周前两组曲线下降幅度小,ALT 累积异常率比较差异无统计学意义(P>0.05),从第24~48周,观察组曲线下降幅度明显增大,与对照组相比ALT累积异常率差异有统计学意义(P<0.05),观察组与对照组的ALT累积异常中位时间分别为24 周和36 周(P<0.05,图3)。
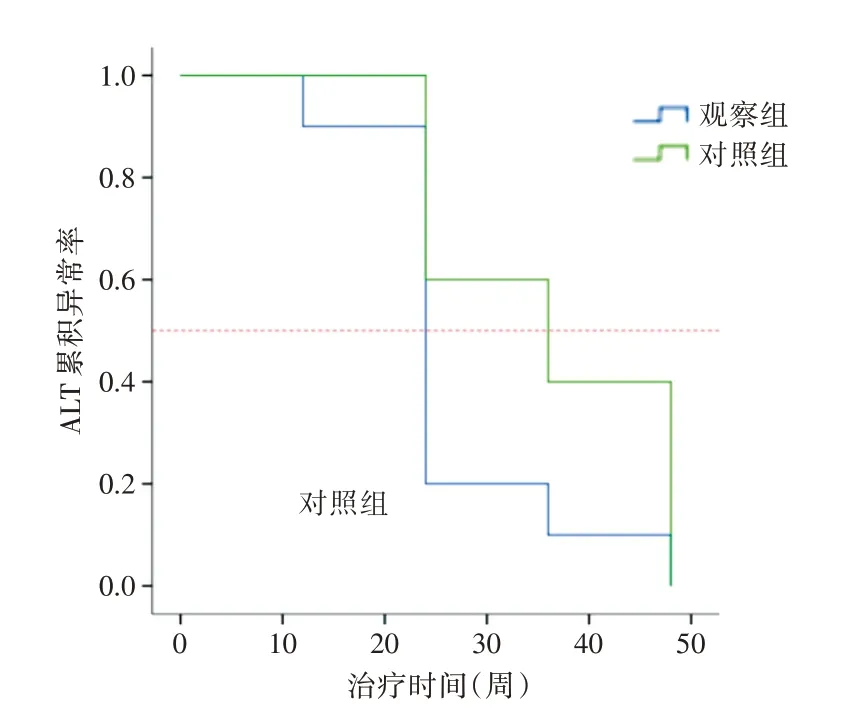
图3 两组治疗过程中ALT 复常中位时间Fig.3 The median time to cumulativly achieve normal ALT level was detected in two groups during the treatment
3 讨论
目前,CHB 依然是肝硬化、HCC 的首要独立危险因素。随着病情进展,引起肝功能异常甚至衰竭、肝纤维化、肝硬化及HCC 等不良后果风险将大幅度提升,使患者的生命安全及生活质量受到极大程度的威胁[10-15]。《慢性乙型肝炎防治指南[9](2015 版)》提出CHB 患者治疗的目标是最大限度地长期抑制HBV 复制,减轻肝细胞炎性坏死及肝纤维化,延缓和减少肝功能衰竭、肝硬化、HCC 及其他并发症的发生,从而改善生活质量和延长生命。对于CHB 患者的治疗,首先需要最大限度的抑制HBV 复制,恩替卡韦是抗病毒药物中核苷(酸)类似物的一线抗乙肝病毒药物,能强有效地抑制HBV 复制。但研究发现[6-7、16],恩替卡韦只能有效抑制HBV 复制,无法完全减轻肝细胞炎症反应,保肝、抗纤维化的能力较弱。单用恩替卡韦抗乙肝病毒治疗24 周肝功能指标ALT、AST 及TBIL 复常率低[17-18],但联合中成药可提高24 周内肝功能复常率[8]。
五灵胶囊主要含五味子、灵芝、丹参、柴胡等,其中五味子醇甲、五味子乙素、隐丹参酮、丹参酮ⅡA、柴胡皂苷D 是抗肝脏损伤的有效成分,而抗肝纤维化的有效成分是二氢丹参酮Ⅰ、柴胡多糖、五味子醇甲。柴胡通过抑制肝脏库普弗细胞(Kupffer cell)释放过量炎症因子:MCP-1、IL-1、TNF-α,减轻肝细胞损伤,从而降低转氨酶[19]。五味子通过有效清除活性氧自由基导致的脂质过氧化,增加肝细胞膜稳定性[20];灵芝促进肝细胞内蛋白合成,修复肝细胞损伤[21]。丹参能有效抑制Ⅲ型肝纤维蛋白的增生,从而抑制HA、LN 的表达,具有抗肝纤维化的功效[22]。因此,五灵胶囊可被认为是有效改善肝功能及抗肝纤维化的中成药。
本研究结果显示,观察组与对照组相比,尽管对照组在治疗4 周、12 周、24 周肝功能指标ALT、AST 及TBIL 水平均有下降趋势,但加入五灵胶囊的观察组下降更大,肝功能明显改善,其中在治疗第4 周时,ALT、AST 下降幅度最为明显。在治疗24 周末,对照组的肝功能指标ALT、AST 及TBIL 复常率低,观察组均显著高于对照组,表示加入五灵胶囊,使肝功能指标复常时间更短,起效更迅速,保护肝脏功能更有效。进一步以肝功能指标复常为结局拟合logistic 回归模型发现,与对照组相比,观察组均是肝功能指标的保护因素,其中观察组的ALT 复常OR 值最高,是对照组的12 倍,表示加入五灵胶囊对肝功能指标的复常是有利的,能使ALT 复常增加12 倍,对于ALT 复常疗效更显著。此外,本研究通过ALT 累积异常率的生存曲线,进一步阐述了ALT 复常的中位时间及两组间的差异,随治疗延长至48 周,观察组与对照着的ALT复常的中位时间分别为24 和36 周,两组曲线均有下降,但观察组下降更为明显,证明了加入五灵胶囊能加快ALT 的复常速度,24~48 周复常速度加快更为明显,提前肝功能完全恢复的时间。在抗纤维化指标方面,治疗24 周,观察HA、LN、IV IV-C、PIIINP 水平下降较为明显,结果表明加入五灵胶囊更有利于肝纤维化的修复改善。
但观察组的HBV-DNA和HBeAg转阴的情况与刘加群等[23]的研究结果不一致,有研究显示[24-26],HBV-DNA 与HBeAg 转阴关系密切。在本研究治疗24 周,两组HBV-DNA 低于检测下限的比率与HBeAg 低于检测下限的比率差异无统计学意义,考虑为样本量小及研究时间较短所致。
值得注意的是,轻度胃肠道反应是五灵胶囊的副作用,本研究观察组在治疗过程中便秘出现几率为1.6%,恶心为3.3%,上腹胀为5%,通过改善服药方法及时间,例如饭后半小时内服药、温开水吞服及去掉胶囊只服胶囊内药粉等,能一定程度上改善患者恶心、上腹胀等胃肠道反应,坚持到治疗终点。
综上所述,对比单一的NAs 治疗CHB 患者,加入五灵胶囊改善肝功能速度加快,治疗第4 周最为明显,肝功能指标复常率高,使ALT 复常增加12 倍,累积复常时间提前至24 周并能有效改善肝纤维化。所以,五灵胶囊在临床治疗中起到“增强剂”的作用,联合ETV 可以实现更快更高的肝功能复常率,为优化现有临床药物的重新组合提供了有效的新证据。本研究的样本量较小,未能进一步分层研究,因此研究具有一定的局限性,结果可能存在一定程度的偏倚,后期可增加样本量、延长治疗观察时间等再进行进一步深入研究。
