卵清蛋白多克隆抗体的制备及其双抗体夹心ELISA检测方法的建立
2021-12-28朱文勇宋绍辉钏鸿云吴雅楠赵蕊蕊廖国阳
李 妮 朱文勇 宋绍辉 钏鸿云 吴雅楠 赵蕊蕊 廖国阳
甲型和乙型流感病毒引起的季节性流感每年在全球可造成(300~500)万例重症病例以及数千人死亡,警示我们开发流感病毒疫苗势在必行[1, 2]。接种疫苗是预防流感最有效的手段,且由于流行毒株每年可能发生不可预测的变化,流感疫苗需要每年进行接种[3~8]。目前,美国食品和药品监督管理局(FDA)批准的流感疫苗主要有3类,即裂解灭活流感疫苗、重组流感疫苗和减毒活疫苗[9]。其中,季节性流感疫苗主要采用鸡胚进行生产,含有鸡胚来源的杂蛋白,所以鸡蛋过敏人群被禁止接种流感疫苗[10]。卵清蛋白(ovalbumin,OVA)是鸡胚中含量最高的蛋白,具有强免疫原性,疫苗中卵清蛋白含量过高会导致不良反应并降低机体对疫苗的耐受性。最近的一项研究表明,大多数鸡蛋过敏患者也可以安全地接种含有少量OVA的流感疫苗[11]。故降低疫苗中卵清蛋白含量是提高疫苗安全性和耐受性的关键因素。以往对卵清蛋白定量常采用 RPHA、单向免疫扩散(SRID)、常规免疫电泳和对流免疫电泳法,但这些方法操作繁琐,敏感度低,不适于准确定量[12~14]。德国赛乐美诊断有限公司研制的OVA定量检测试剂盒Serazym®Ovalbumin操作简便,敏感度高,是国内外主要采用的检测方法。但该试剂盒检测成本较高,不适于在生产工艺中推广应用。故研制一种操作简单、敏感度高、成本低廉的OVA定量检测试剂盒对于鸡胚流感疫苗生产是十分必要的。
本研究描述了一种定量检测OVA含量的双抗体夹心ELISA方法,该方法具有高度特异性及敏感度,且成本低廉,可应用于鸡胚流感疫苗生产中OVA含量的测定,为鸡胚流感疫苗研发中的质量控制提供了支持。
材料与方法
1.主要材料及仪器设备:辣根过氧化物酶标记的兔抗卵清蛋白多克隆抗体(PA1-196-HRP)购自美国Thermo Fisher公司;鸡卵清蛋白参考品原料(A5503-1G)(纯度≥98%)购自美国Sigma公司,赛乐美卵清蛋白定量检测试剂盒Serazym®Ovalbumin购自德国赛乐美诊断有限公司;酶标仪购自美国Bio-Rad公司;隔水式恒温培养箱购自美国Thermo Fisher公司。
2.实验动物:清洁级雌性新西兰大白兔,体质量为2.5~3.0kg,购自昆明医科大学。
3.参考品制备:购自美国Sigma的高纯度卵清蛋白参考品原料采用称重法配制成1.0μg/ml的储液,用购自德国赛乐美的卵清蛋白试剂盒对该参考品浓度进行验证后再分别稀释至20、10、5、2.5、1.25、0.625、0.313ng/ml。
4.兔多克隆抗体的纯化:采用Protein G亲和层析柱对兔抗OVA血清进行纯化,获得兔多抗IgG。亲和层析操作由AKTApurifier层析系统实现,纯化过程中收集流出液和洗脱液样品,通过监控280nm波长处的吸收度(mAU)值来确定收集抗体的时间。对收集到的抗体采用间接ELISA方法测定效价,采用SDS-PAGE测定纯度,采用BCA蛋白定量试剂盒测定浓度。
5.双抗体夹心ELISA检测方法的建立:按以下步骤进行双抗体夹心ELISA实验。捕获抗体100微升/孔包被酶标板,4℃孵育过夜;PBST洗板3次并拍干,加入封闭液(含质量分数1%BSA的PBS),250微升/孔封闭酶标板,37℃孵育2h;PBST洗板3次并拍干,100微升/孔加入抗原,37℃孵育1h;PBST洗板3次并拍干,100微升/孔加入酶标抗体,37℃孵育1h。显色:洗板5次并拍干,100微升/孔加入TMB显色液,37℃避光孵育15min;加入终止液(2mol/L H2SO4),50微升/孔,酶标仪检测450nm波长处A值。
6.方法优化:(1)捕获抗体及酶标抗体浓度的确定:采用棋盘滴定法,将捕获抗体稀释至4、3、2.5、2μg/ml包被酶标板,以浓度为20ng/ml的标准品作为阳性对照,PBS作为阴性对照,酶标抗体稀释至浓度为0.5、0.25、0.125μg/ml加入酶标板,每种条件做两个复孔,其余步骤同第5项。根据比较不同抗体浓度组合下,阳性对照检测结果(P)比阴性对照检测结果(N)的值(P/N)来确定最适抗体浓度。(2)封闭液确定:捕获抗体及酶标抗体均采用第6项确定的最适浓度,以浓度为20ng/ml的标准品作为阳性对照,PBS作为阴性对照,分别用不同封闭液(未封闭、PBS稀释的1%BSA、2%BSA,1%BSA+1%蔗糖,2%BSA+2%蔗糖)于37℃封闭2h,每种条件做2个复孔,比较P/N值的大小选择最适封闭液配方。(3)判断标准的确定:采用优化后的体系检测51份阴性样本,计算cut-off值作为判断标准。
7.方法的验证:(1)线性范围及敏感度验证:将卵清蛋白标准品分别稀释为20、10、5、2.5、1.25、0.625、0.313、0.156、0.078、0.039、0.020、0.010ng/ml进行检测,每个浓度设置3次重复。对标准品浓度及对应吸光度值进行直线回归分析,并计算相关系数r2。根据“方法优化”项确定的cut-off值判断该体系的敏感度。(2)重复性验证:板内重复性实验:随机选取阴性和阳性样本各5份同时设置空白对照组和阴性对照组,每份样本做3个复孔,于同一块酶标板上检测,计算同一份样本板内的变异系数[CV(%)]。板间重复性实验:取3块酶标板,对上述进行板内重复性检验的样本进行检测,每份样本做3个复孔,计算同一份样本板间的变异系数。(3)特异性验证:用建立的方法分别对甲肝病毒、Vero细胞上清液、流感病毒、新型冠状病毒、肺炎支原体、脱脂奶粉、0.01mol/L PBS、BSA、鸡蛋蛋清、鸭蛋蛋清、鹌鹑蛋蛋清、鸡胚培养流感病毒H3N2单价原液、鸡胚培养流感病毒H3N2尿囊收获液、Sigma鸡卵清蛋白标准品、solarbio鸡卵清蛋白标准品、赛乐美试剂盒卵清蛋白标准品(20ng/ml)等16份样本进行检测,根据“方法优化”项确定的cut-off值验证该方法的特异性。(4)准确度验证:随机选取4个批次的流感病毒裂解疫苗半成品用建立的方法和购自赛乐美的卵清蛋白检测试剂盒进行检测,比较建立的方法检测结果与试剂盒检测结果符合率,评价建立的方法检测样本的准确性。(5)稳定性验证:从来自鸡胚流感裂解疫苗生产工艺的样本中选择强阳性样本、弱阳性样本和阴性样本各3份。用该方法预包被后于-20℃冻存1周、1个月、3个月及6个月的酶标板对上述样本进行稳定性试验。
结 果
1.兔抗OVA血清纯化验证结果:经Protein G层析柱亲和层析可有效分离血清中的杂蛋白(图1中a~b段),收集获得高纯度的IgG抗体(图1中c~d段)。对收集的抗体进行SDS-PAGE电泳,结果显示只有相对分子质量为57.92kDa和35.44kDa的重链、轻链各一条,表明亲和层析纯化后得到了纯度较高的兔抗OVA多抗(图2)。间接ELISA方法测得多抗的效价为1∶64000,BCA法测得蛋白浓度为12.0mg/ml。

图1 纯化兔抗OVA血清的亲和层析图谱a~b.流穿峰;c~d.洗脱峰
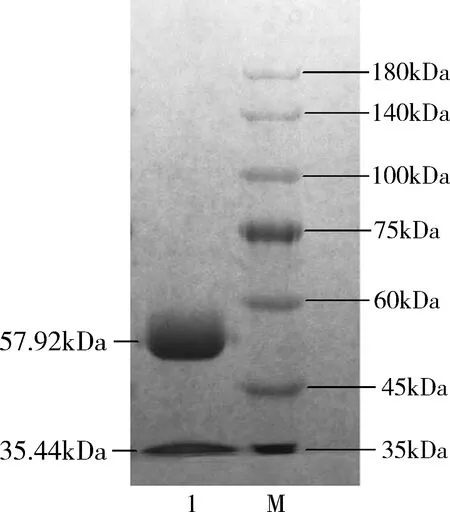
图2 兔抗OVA血清亲和层析纯化后SDS-PAGE电泳图1.收集的洗脱液;M.蛋白marker
2.方法优化的结果:(1)最适捕获抗体和酶标抗体浓度:当捕获抗体浓度为2.5μg/ml,酶标抗体浓度为0.5μg/ml,P/N值最大,为38.483。故选择捕获抗体及酶标抗体最适工作浓度分别为2.5μg/ml和0.5μg/ml(表1)。(2)最适封闭液:当用1%BSA+1%蔗糖封闭时,P/N值较大,为45.526,故选择1%BSA+1%蔗糖作为最适封闭液配方(表2)。(3)判断标准的确定:51份阴性样本检测结果平均值为0.065,标准差为0.023,在要求99%(单侧)可信度条件下,采用以吸光度均值+3倍标准差作为阳性判断值[15]。计算得cut-off值为0.134,故检测结果>0.134时判断为阳性,检测结果≤0.134则判为阴性。
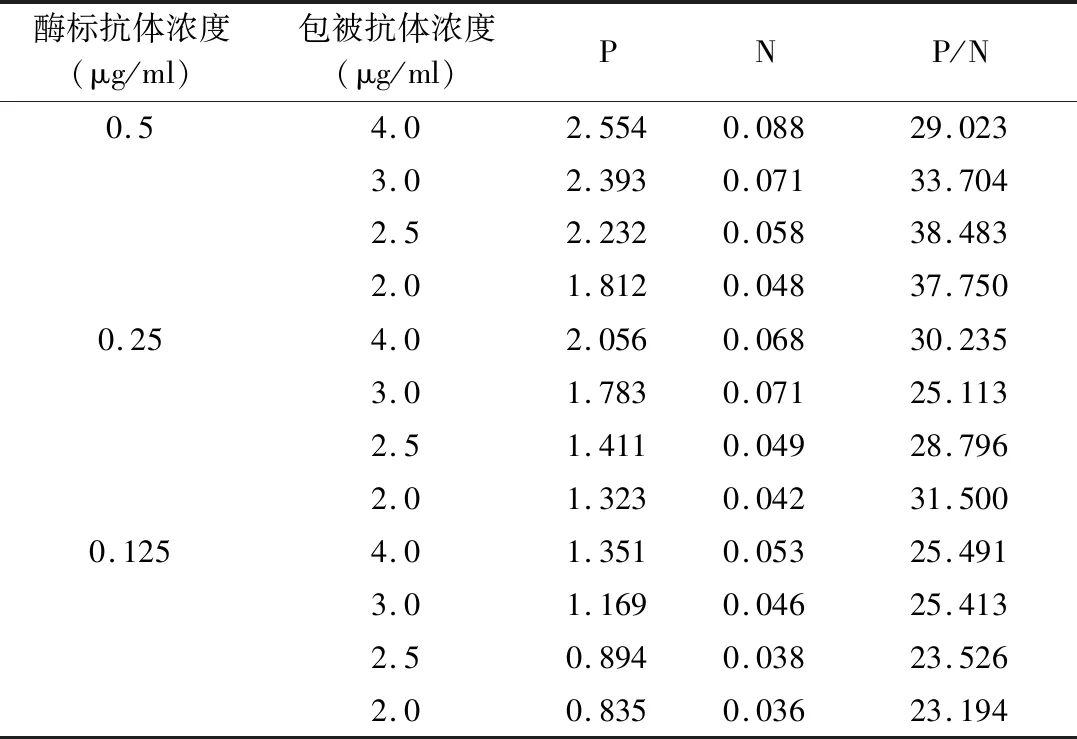
表1 捕获抗体和酶标抗体工作浓度优化结果
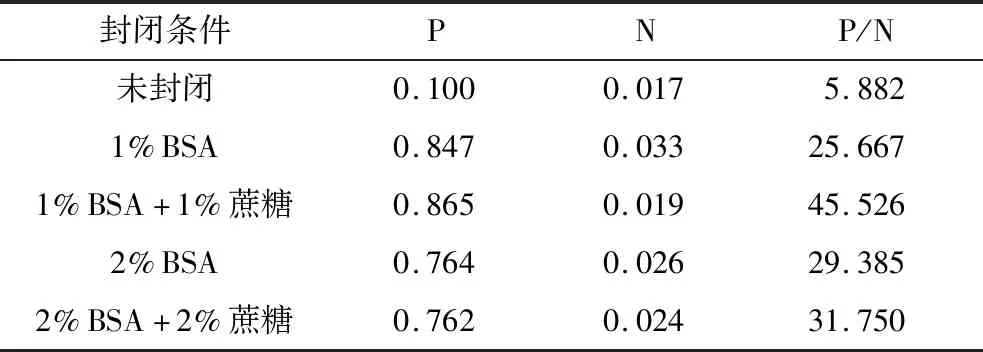
表2 封闭液优化结果
3.方法验证的结果:(1)线性范围及敏感度验证结果:5次实验绘制标准曲线均表明,当卵清蛋白浓度为20.000ng/ml到0.313ng/ml,A450值与样品浓度呈良好的线性关系,且回归系数r2均大于0.97,且重复性好(图3)。并根据cut-off值确定该检测方法的检测下限为0.078ng/ml。(2)重复性验证结果:板内最大CV值为25.953%,最小为3.428%;板间最大CV值为27.614%,最小为5.375%,表明该方法具有较高的重复性(表3)。(3)特异性验证结果:对已知背景的16份样本进行检测,检出阳性样本8份,阴性样本8份,与已知背景相符,表明该方法具有较高的特异性。(4)准确度验证结果:采用本方法与购自德国赛乐美的卵清蛋白试剂盒对4份H1N1流感疫苗半成品进行检测,结果表明,该方法检测结果与试剂盒检测结果符合率为91.43%~102.96%,二者比较差异无统计学意义,说明建立的检测方法具有较高的准确度(表4)。稳定性验证结果:用冻存不同时间的预包被酶标板对上述样本进行检测,变异系数为1.976%~ 14.409%,表明该方法具有较高的稳定性(表5)。
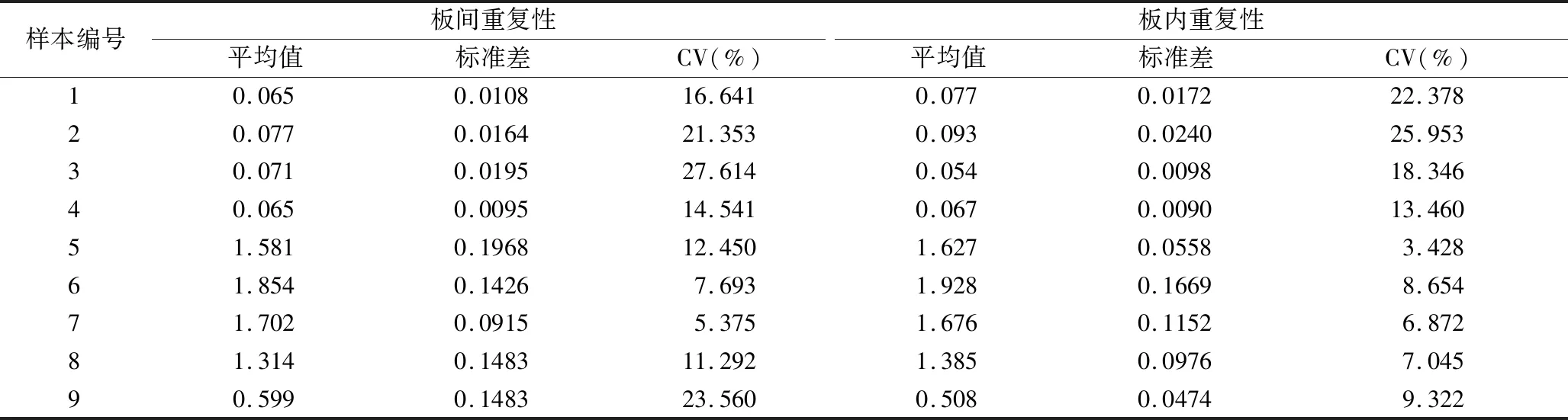
表3 板内及板间重复性验证

表4 准确度验证

表5 稳定性验证

图3 双抗体夹心ELISA定量OVA的标准曲线
讨 论
疫苗是控制流感病毒感染传播最经济有效的手段,季节性流感疫苗主要采用鸡胚生产。研究表明,OVA可导致炎性细胞侵入呼吸道,引起雌性BALB/c小鼠脂质过氧化从而引起DNA损伤,以及诱导细胞完整性损伤导致细胞功能障碍[16,17]。故降低疫苗中OVA含量对于提高疫苗的安全性和免疫原性至关重要。以往对卵清蛋白定量的方法具有操作繁琐、成本高昂、敏感度低等问题,与传统方法比较,利用双抗体夹心ELISA方法进行检测具有以下明显优势:(1)检测敏感度高,检测可达到纳克级别。(2)操作简便,预包被酶标板可在-20℃长期保存,单次检测操作可在3h内完成。(3)价格低廉,可大大节约检测成本。故双抗体夹心ELISA检测方法可对鸡胚流感病毒疫苗及工艺阶段样品中OVA进行定量检测。
本研究通过制备兔抗OVA多克隆抗体,建立了一种快速、简便、低成本的双抗体夹心ELISA检测方法,并进行了验证。采用纯化后的多克隆抗体作为捕获抗体,避免了血清中杂蛋白造成的交叉反应,有助于提高检测的敏感度和准确度。另外,直接采用带有辣根过氧化物酶标记的兔抗OVA多克隆抗体作为检测抗体,与采用酶标二抗比较,节约了操作时间,且避免了酶标二抗导致的交叉反应。对该方法的准确性、敏感度、重复性和特异性进行了验证,敏感度高,重复性好,特异性强,检测准确度不低于德国赛乐美卵清蛋白定量检测试剂盒,可用于鸡胚流感疫苗中卵清蛋白定量检测。但ELISA方法采用酶联免疫进行反应,特异性和敏感度有一定局限,而随着纳米材料在医学研究中的进一步应用,金纳米颗粒在提高ELISA分析的敏感度和特异性方面也展现出重要作用,笔者也希望通过引入金纳米颗粒或可开发出更高敏感度和特异性的卵清蛋白定量检测方法[18]。
