ZEB1在卵巢子宫内膜异位症中的表达及功能研究
2021-12-28汪雯雯
袁 明 汪雯雯 宋 佳
子宫内膜异位症(简称内异症)是妇科常见的雌激素依赖性疾病,主要导致慢性盆腔痛、痛经及不孕等[1]。虽然内异症为妇科良性疾病,但具有肿瘤的恶性生物学行为,如具有侵袭性、转移潜能及术后易复发等,给患者造成严重的经济及心理负担[2]。因此,探究内异症的恶性生物学行为的机制对寻找新的分子治疗靶点具有重要临床意义。转录因子ZEB1属于锌指同源家族成员,通过锌指结构与下游靶基因启动子区的E-box序列结合发挥作用。ZEB1在人类多种癌症中异常表达,主要参与调控上皮-间充质转化(epithelial-mesenchymal transition, EMT) 促进肿瘤细胞迁移、侵袭和转移,以及调控肿瘤细胞化疗敏感度[3,4]。EMT是重要的细胞重塑过程,其特征是上皮表型逐渐丧失,间充质表型逐渐增加。近年来,越来越多的证据表明EMT参与内异症的发病机制[5~7]。作为EMT调控的重要转录因子,笔者推测ZEB1在子宫内膜异位症的发病过程中亦可能发挥重要作用。本研究通过检测ZEB1在卵巢子宫内膜异位症中的表达情况,初步探讨ZEB1在内异症中的功能,为内异症的诊疗提供新的思路。
资料与方法
1.临床资料及标本采集:选取2010年1月1日~2011年12月31日在华中科技大学同济医学院附属同济医院因卵巢子宫内膜囊肿行手术治疗的患者30例为研究组,留取卵巢囊壁组织。选取同期因妇科良性疾病(子宫平滑肌瘤17例,不孕症13例)住院行手术治疗的患者30例为对照组,留取正常内膜组织。组织标本部分行石蜡包埋,剩余组织液氮速冻后超低温冰箱保存。临床资料及临床标本的采集工作经华中科技大学医学伦理学委员会讨论并通过。
2.主要试剂:DF12培养基购自美国Gibco公司,胎牛血清购自浙江天杭生物技术有限公司,Ⅰ型胶原酶购自美国Sigma-Aldrich公司,DNaseⅠ酶购自中国碧云天生物技术研究所,Rever Tra Ace qPCR RT Kit购自日本TaKaRa公司,SYBR Green Real-time PCR Master Mix购自美国ABI公司,所有引物由上海Invitrogen公司合成,普通PCR试剂购自美国Fermentas公司,ZEB1多克隆抗体购自美国Santa公司。CCK8 试剂盒购自日本Dojind公司。Matrigel胶购自美国BD公司, Transwell小室购自美国Milipore公司。
3.石蜡切片免疫组织化学:组织标本经10%甲醛溶液固定后,石蜡包埋,切片3μm厚。组织切片脱蜡再水化。3%H2O2抑制内源性过氧化物酶活性,柠檬酸缓冲液于微波炉行抗原恢复。3%牛血清白蛋白阻断后一抗孵育切片,抗ZEB1(兔抗1∶200),DAB显色。
4.原代子宫内膜间质细胞的培养及转染:正常子宫内膜组织充分剪碎,经胶原酶B(10μg/ml)消化后收集细胞。培养基DF12重悬细胞,经400目滤网得到子宫内膜间质细胞,接种于细胞培养瓶。24h后胰酶消化细胞,接种6孔板,待细胞贴壁生长、细胞融合度达到70%左右时,根据Invitrogen的转染试剂Lipo 2000的步骤行转染实验,观察组每孔用200μl DF12稀释4μg pCI-neo-ZEB1,加入6μl脂质体Lipo 2000;对照组转染空质粒pCI-neo。于转染后72h收集细胞渣行Western blot法检测。
5.RNA提取及qRT-PCR:按Trizol说明书提取卵巢囊壁组织、正常内膜组织及转染后的细胞渣的总RNA,Nano drop 2000检测RNA纯度,取2μg总RNA反转录成cDNA进行qRT-PCR反应。反应条件:95℃ 1min变性; 95℃ 15s;60℃ 45s;72℃ 30s共40个循环;95℃ 15s; 60℃ 15s; 95℃ 15s收集荧光。以GAPDH作为内参,采用2-ΔΔct计算各组ZEB1的相对表达差异。
6. Western blot法检测:转染后分别收集两组细胞提取总蛋白,按照试剂盒的操作步骤进行蛋白定量。取60μg 蛋白进行10%SDS-聚丙烯酰胺凝胶电泳,根据 marker蛋白分离条带,切下电泳后目的蛋白凝胶。电转至PVDF膜上,5%脱脂牛奶室温封闭2 h后,一 抗(稀释浓度为ZEB1 1∶1000和GAPDH 1∶8000)4℃孵育过夜。室温洗膜,于HRP标记的二抗溶液中37℃孵育1h,ECL显色,采用Chemi-genius凝胶成像系统分析蛋白条带相对表达量。
7.CCK-8检测细胞增殖情况:培养瓶中原代培养的内膜间质细胞胰酶消化后,调整细胞浓度以1×104个/孔均匀接种于96孔板, 待孔板中细胞融合度达到85%时, 转染pCI-neo-ZEB1及空质粒pCI-neo,每组各5个复孔。于转染后24、48、72h加入CCK8, 37℃孵育2h,全能酶标仪(UQUA38 型)检测570nm吸光度(A)值。
8. Transwell侵袭小室法检测细胞的侵袭、转移能力:收集转染后的内膜间质细胞,用无血清DF12调整细胞浓度为2×104个/毫升,在Transwell孔板上室加入200μl细胞悬液,下室加入600μl DF12完全培养液。4%多聚甲醛固定滤膜,结晶紫染色10min,高倍显微镜计数穿透到滤膜下层的细胞数,每孔随机选择5个视野,结果求平均值。侵袭实验在Transwell小室半透膜表面包被按1∶8比例稀释的50mg/L matrigel(每孔100μl)置37℃培养箱中,30min成凝胶,再向上室加入细胞悬液,余同前述,各项实验重复3次。
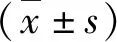
结 果
1.ZEB1在正常子宫内膜及异位子宫内膜组织中的表达情况:qRT-PCR检测ZEB1 mRNA在正常子宫内膜及异位子宫内膜组织中的表达情况。发现ZEB1 mRNA在异位子宫内膜组织中异常高表达,且分泌期的表达高于增生期,差异有统计学意义(图1A)。免疫组化法检测ZEB1在增生期及分泌期正常子宫内膜组织、异位子宫内膜组织中蛋白水平的表达差异。结果发现,在正常子宫内膜组织中,ZEB1蛋白主要定位于子宫内膜的间质细胞的胞核,分泌期表达高于增生期;而在异位内膜中组织中,ZEB1蛋白除在子宫内膜的间质细胞的胞核中表达,还见于异位内膜的腺上皮细胞中(图1B)。
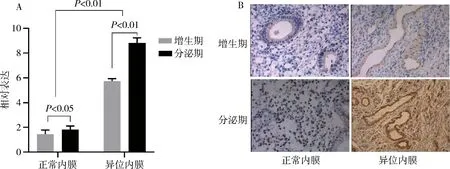
图1 ZEB1在正常子宫内膜及异位子宫内膜组织中的表达情况A.ZEB1 mRNA在正常子宫内膜及异位子宫内膜组织中的表达情况;B.ZEB1在正常子宫内膜及异位子宫内膜组织中免疫组化染色(×400)
2.鉴定质粒转染效率:分别收集转染后48h及72h的细胞渣,qRT-PCR及Western blot法分别检测ZEB1 mRNA及蛋白表达变化,可见转染pCI-neo-ZEB1后子宫内膜间质细胞中ZEB1的mRNA及蛋白表达均明显升高(图2)。
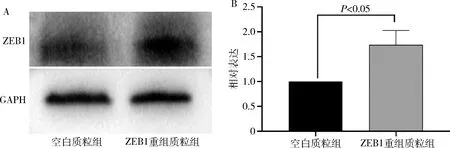
图2 转染重组质粒后ZEB1的表达A.转染后,间质细胞ZEB1蛋白的表达;B.转染后,间质细胞ZEB1mRNA的表达
3.ZEB1对子宫内膜间质细胞增殖的影响:CCK-8法检测两组细胞增殖能力,结果显示ZEB1重组质粒组间质细胞在 24、48和72h时的增殖率均明显高于空白质粒组(P<0.05),上调正常子宫内膜间质细胞中的ZEB1后,间质细胞的增殖率明显提高(图3)。
图3 ZEB1对子宫内膜间质细胞增殖的影响与空白质粒组比较,*P<0.05
4.ZEB1对子宫内膜间质细胞迁移、侵袭的影响:内膜间质细胞转染后,空质粒组每高倍视野透膜细胞数为 191±22,ZEB1组每高倍镜视野下的细胞数为634±91;小室半透膜表面铺Matrigel胶后,空质粒组间质细胞透膜细胞数为187±21,ZEB1组细胞透膜细胞数为460±38,两组比较,差异有统计学意义(P<0.05,图4)。
讨 论
转录因子ZEB1属于锌指同源家族成员,通过其特殊的锌指结构与下游靶基因启动子区的E-box序列结合,从而参与一系列重要的生理过程,包括中胚层的发生、神经嵴细胞的发展等[8]。近年来,越来越多的研究发现ZEB1在多种肿瘤中异常表达,并参与肿瘤进展[9]。ZEB1可参与调控细胞极性,抑制基膜的合成,激活基质金属蛋白酶MMP-1、MMP-9、MMP-14的表达,从而促进基膜的重塑,促进对周围组织的侵袭[10]。内异症是妇科良性疾病,但是具有肿瘤侵袭、转移的恶性生物学行为。有研究发现,在内异症的发病过程中,上皮细胞间质转化(EMT)及间质细胞上皮转化(MET)可能参与的疾病的进展[11]。作为EMT的调控因子,ZEB1在内异症的发生、发展过程中可能发挥重要作用。
在正常的子宫内膜中,ZEB1的表达仅在内膜肌层以及内膜的间质细胞,且定位于细胞胞核中。在正常子宫内膜的腺上皮细胞中没有ZEB1的表达。随着月经周期的变化,分泌期间质细胞中ZEB1的表达显著高于增生期。此外,在体及体外实验发现,雌激素及孕激素均可调控间质细胞中ZEB1的表达[12,13]。本研究发现ZEB1在异位内膜间质细胞及腺上皮细胞中显著高表达,且表达量随月经周期发生波动,分泌期高于增生期。ZEB1仅在子宫内膜异位病变的上皮细胞中表达,而在正常子宫内膜中不表达,提示ZEB1在内异症发病机制中可能发挥重要作用。异位内膜上皮具有更高水平的间充质特征,从而导致其侵袭性增强。此外,异位腺上皮细胞间质标记表达增加,且这一变化出现在内膜异位种植以后发生。由此,笔者推测病变不同的微环境,如炎症、基因异位损伤或其他因素的差异,导致异位种植内膜发生表型的改变[14]。
向原代培养的子宫内膜间质细胞中转染ZEB1真核表达载体,Western blot法检测转染后子宫内膜间质细胞中ZEB1的蛋白表达明显升高。运用CCK8及Transwell检测增殖及侵袭情况,结果提示ZEB1的高表达可增强间质细胞的增殖能力、促进细胞的侵袭、迁移能力。正常人子宫内膜随性激素的改变而发生周期性的脱落,这种周期性的脱落伴随内膜细胞的凋亡及增殖。内膜细胞凋亡与增殖的平衡有利于维持子宫内膜的正常形态及功能,而细胞凋亡和(或)增殖异常会导致内膜的病理生理过程。Braun等[15]在mRNA水平检测内异症患者与正常对照内膜凋亡调节基因的表达,发现内异症患者的在位内膜DAD-1表达显著升高,内膜腺上皮细胞及间质细胞Bcl-xl/Bcl-x的比例增加,而caspase-1、p53转录丰度的下降,提示内异症患者存在凋亡调控基因表达异常。有研究发现,miR-200b通过靶向调控ZEB1、ZEB2和KLF4,亦可影响内异症细胞的增殖、侵袭性和干性[16]。
大量研究表明ZEB1可通过影响P53和RB依赖的抑癌通路,阻止细胞衰老及凋亡。此外,通过抑制周期蛋白依赖性激酶抑制剂CDKN1A和INK4B,允许G1~S细胞周期进展,进而调控细胞周期[17]。在前列腺癌中,ZEB1亦可通过激活ERK1/2信号通路,调控肿瘤细胞的增殖及侵袭[18]。miR-590-3p通过靶向作用与ZEB1,调控心脏成纤维细胞的增殖、迁移和胶原合成[19]。ZEB1作为细胞内基本生理过程的关键调控因子,参与干细胞分化、细胞增殖与衰老以及存活与凋亡的调控。
综上所述,有活性的异位内膜表现出黏附、侵袭、血管形成、免疫逃逸等生物学行为是内异症发病的关键。本研究发现内异症患者异位病灶中ZEB1显著高表达,且该转录因子的异常促进了异位内膜间质细胞的增殖与侵袭。本研究结果为进一步探索内异症的发病机制提供新的思路,ZEB1可能是内异症侵袭性或严重程度的潜在指标。
