新型冠醚-膦酸锆材料的制备及其对锶吸附性能研究
2021-12-27牟婉君魏洪源陈柏桦李兴亮杨宇川彭述明
牟婉君,魏洪源,陈柏桦,李兴亮,杨宇川,彭述明
(中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900)
89Sr是一种优良的骨肿瘤缓解治疗核素。其β-射线最大能量为1.463 MeV,平均能量0.58 MeV,同时能发射分支比为0.009 5%、能量为0.909 MeV的γ射线[1]。89Sr β-射线在软组织的平均射程约2.4 mm,是目前较为理想的骨肿瘤放射性治疗核素。由于Sr2+和骨胳主要无机成分羟基磷灰石的Ca2+相似,因此Sr2+能高度浓集在人体的骨骼系统,在血液中能以Sr2+形式存在的89Sr化合物即可成为89Sr药物。无载体89Sr主要通过反应堆快中子诱导的89Y(n,p)反应来制备,89Sr和89Y2O3的分离以及89Sr的纯化是关键[1]。
相比于溶剂萃取法,无机离子交换剂由于其高分离效率、良好稳定性等优点,一直备受研究者的关注。有机膦酸锆具有类似于α-ZrP的平面层状结构,且装载不同种有机基团,可呈现多种优异的性能,近些年来由于功能材料需求不断增加,进一步促使了该类材料的合成化学快速发展。有机膦酸锆的合成主要基于α型磷酸锆剂以及衍生物的基础上将有机配体引入来制备新型膦酸锆分离材料[2-6]。为了实现对目标离子高效的分离,选用对目标离子具有络合能力的配体,可有效增强有机膦锆的离子交换属性。18-冠-6由于腔体结构与Sr2+具有非常好的匹配性,对复杂体系中的Sr2+具有很好的选择性[7-11]。清华大学何海龙等用DCH18C6/正辛醇体系对模拟高放废液中的90Sr进行了萃取分离,实验发现该萃取体系对高放废液中的90Sr具有较强的萃取能力及良好的分离选择性[12]。本文将4-氨基苯并-18-冠-6引入α-ZrP的层间,获得新型冠醚@膦酸锆复合材料(D-AM-ZrP),对其物化属性进行分析表征,并进一步考察其对锶的吸附性能。
1 实验部分
1.1 主要仪器与试剂
ASP880原子吸收光谱分析仪:美国PE公司;X Pert pro(3KW)型X射线衍射仪:荷兰Nalytical 公司;场发射扫描电镜:FE-SEM,日本电子;红外光谱仪:Perkin-Elmer1730,美国PE公司。
八水氧氯化锆、甲醛、硝酸锶:分析纯,阿拉丁产品;4-氨基苯并-18-冠-6:分析纯,成都中进试剂有限公司;其余试剂均为市售分析纯。
1.2 材料制备与合成
1.2.1α-ZrP的制备 本实验中采用氟配位法制备α-ZrP。将9.72 g ZrOCl2·8H2O与100 mL 3 mol·L-1磷酸混合后置于250 mL圆底烧瓶,充分搅拌至ZrOCl2·8H2O溶解,随后加入6 mL HF溶液并持续搅拌,得到白色溶液,在100 ℃下回流24 h,将得到溶液冷却静置沉淀,过滤后用水充分洗涤至pH=5,最后在60 ℃下干燥,得到白色粉状固体α-ZrP。
1.2.24-氨基苯并-18-冠-6膦酸合成 采用类Mannich反应合成烷基甲基膦酸[13-14],主要步骤如下:将0.1 mol(8.2 g)亚磷酸溶于20 mL 水中后加入装有温度计、搅拌器和回流冷凝管的250 mL四颈烧瓶中,加入0.05 mol 4-氨基苯并-18-冠-6,将10 mL浓盐酸加入30 mL加液管,逐滴加入反应瓶中酸,保持温度在95 ℃,缓慢搅拌下滴加37%甲醛溶液0.16 mol(11 mL)。加热到110 ℃回流2~3 h。回流完成后,将产物旋蒸瓶旋蒸至糖浆状,冷却结晶后,再加入100 mL无水乙醇在110 ℃回流 2~3 h,再进行旋蒸,旋蒸后再加入无水乙醇回流,整个旋蒸浓缩、回流、冷却、结晶过程反复3次后获得最终产品,低温保存。其反应式如下。
1.2.3冠醚膦锆复合材料制备 控制反应体系F/Zr比在8~10之间,70 ℃反应6 d,控制体系pH在1~2之间,详细制备方法如下:在聚四氟乙烯反应瓶中加入5 mmol(1.61 g)ZrOCL2·8H2O,再加入20 mL二次纯化水搅拌使其溶解,加入2 mL 40%的氢氟酸,搅拌混合均匀,记做溶液A;将5 mmol的4-氨基苯并-18-冠-6膦酸溶于50 mL水中,搅拌溶解后加入一定量85%磷酸,混合均匀,记做溶液B;将溶液B缓慢滴加溶液A中,整个过程搅拌使其混合均匀,将混合溶液置于70 ℃油浴中反应6 d后,固液分离,固体产物用水洗涤三次,烘箱60 ℃恒温烘干,获得冠醚@膦酸锆(D-AM-ZrP)。
1.3 静态吸附实验
分别称取20 mg冠醚@膦酸锆复合材料置于100 mL容量瓶,加入100 mL不同浓度的Sr2+溶液,在一定温度下振荡48 h后,固液分离,取一定量的上清液分析其中的Sr2+浓度,根据公式(1)计算Sr2+的吸附容量。实验中采用1 mol·L-1硝酸酸和1 mol·L-1氢氧化钠溶液对分离体系的pH进行调控,并系统考察酸度、时间等对冠醚@膦酸锆对Sr2+吸附性能的影响。
(1)
式(1)中C0为溶液中吸附前的浓度,mg·L-1;Ce为吸附后的浓度,mg·L-1;V为溶液体积,L;m为吸附剂质量,g。
2 结果与讨论
2.1 材料表征与分析
2.1.1形貌分析 通过控制反应体系的无机磷酸与有机膦酸的比例,制备了系列D-AM-ZrP材料,采用SEM对获得材料的形貌进行分析,结果示于图1。由图1可知,反应体系中无机磷酸与有机膦酸的比例对样品的形貌有较大的影响。图1a为具有典型的片状形貌的α-ZrP,而当体系中磷/膦的比例为1∶1时,样品的形貌发生明显变化,部分片状形貌消失并且团聚,有少量花状形貌的颗粒出现(图1b)。进一步增加反应体中无机磷的含量,获得样品颗粒初步形成了 “flower-sheet”形貌(图1c);当反应体系中磷/膦的比例为4∶1时,完美的花状形貌形成(图1d),整个“flower-sheet”结构高度有序。


a——典型的片状形貌;b——1∶1;c——2∶1;d——4∶1图1 α-ZrP和不同磷/膦比例的D-AM-ZrP材料形貌Fig.1 SEM images of α-ZrP and D-AM-ZrP materials with the ratio of 1∶1 (b),2∶1 (c)and 4∶1 (d)
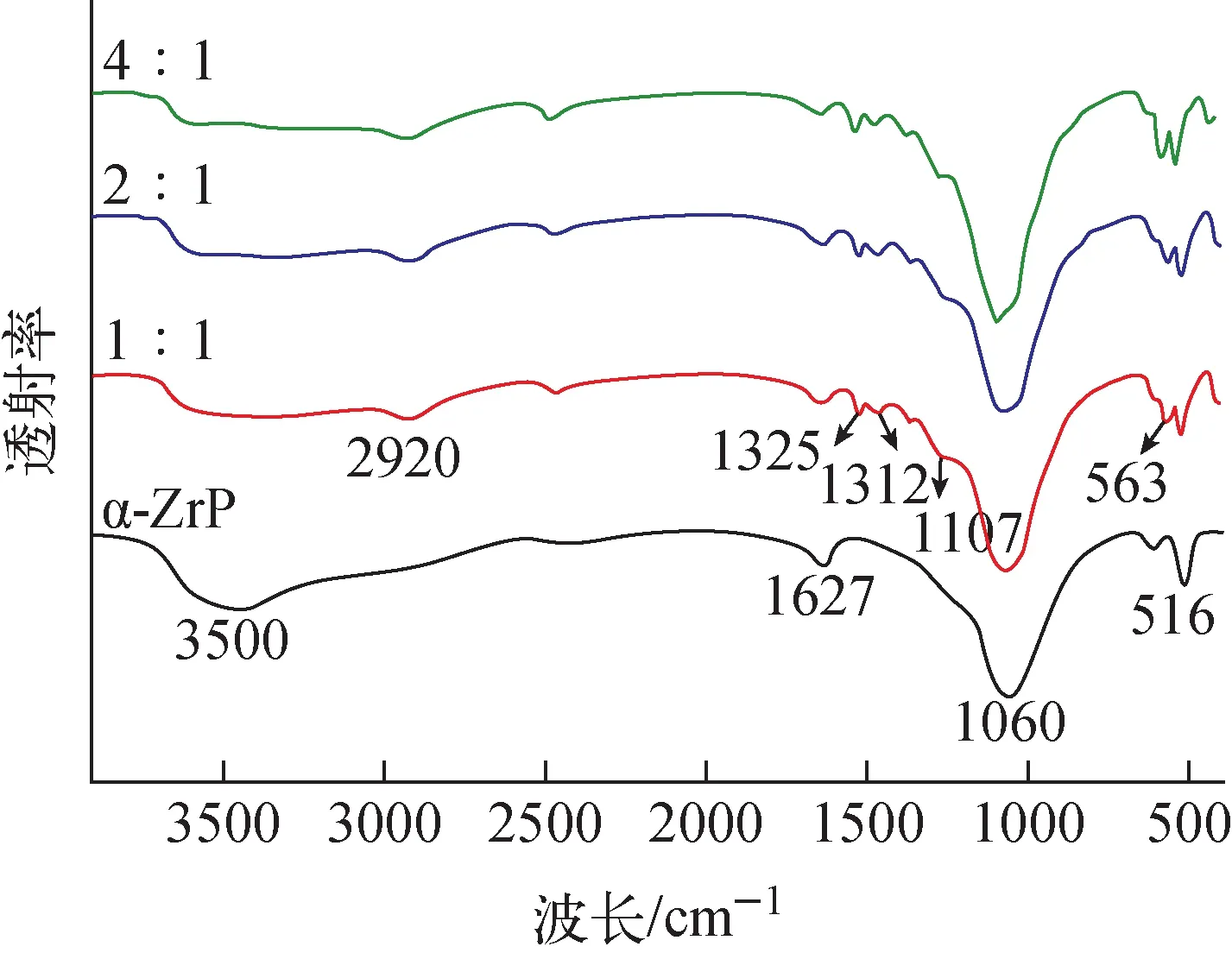
图2 α-ZrP和D-AM-ZrP材料的红外谱图Fig.2 FI-IR spectrum of α-ZrP and D-AM-ZrP material
2.1.3XRD分析 对不同磷/膦比例反应条件下获得的D-AM-ZrP样品的结构分析见图3。由图3可知,当反应体系中磷/膦的比例发生变化时获得样品的主体结构仍为二维层状结构。尽管这样,当磷/膦比例为1∶1时,在10.8°衍射峰的强度明显降低,且在19.5°和25°衍射峰变宽,可能由于随着有机冠醚膦与Zr4+之间的反应进行,除了α-ZrP,还形成一些中间态产物;当反应中磷/膦比例为2∶1,在5°、18°和21°左右有新的衍射峰出现表明有新的物相形成。另外,在低角度5°左右新衍射峰的出现表明冠醚膦酸的嵌入引起了层间距的增大。当磷/膦的比例为4∶1时,衍射峰峰形尖,样品具有良好的晶型。
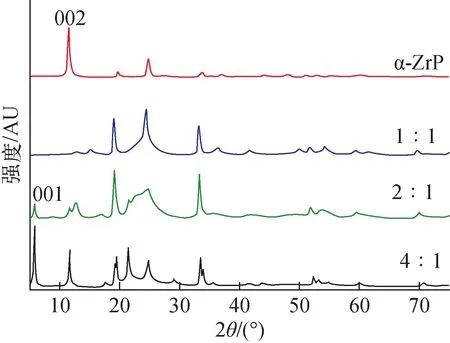
图3 α-ZrP和D-AM-ZrP材料XRD衍射图谱Fig.3 The XRD diffraction map of patterns α-ZrP and D-AM-ZrP material
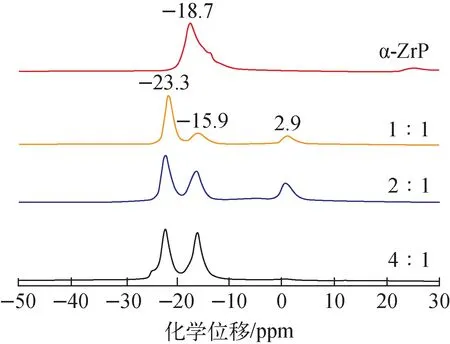
图4 α-ZrP和D-AM-ZrP材料的31P MAS NMR谱Fig.4 Solid-state 31P MAS NMR spectra of α-ZrP and D-AM-ZrP with different molar ratios of phosphoric acid to phosphonic acid
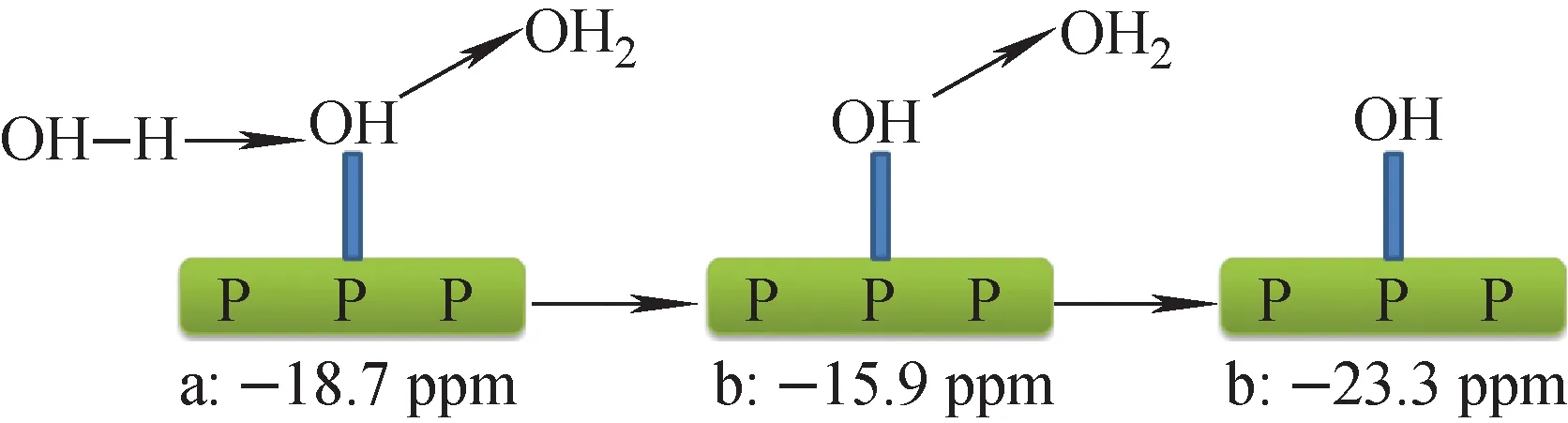
图5 插层过程中P的化学形态变化Fig.5 Change of the chemical states of P element
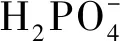
2.2 吸附性能
2.2.1pH的影响 图6为在不同pH体系中D-AM-ZrP和α-ZrP对Sr2+吸附性能。由图6可知,实验pH在1~9范围内D-AM-ZrP样品对Sr2+展现良好的吸附性能,其对Sr的吸附容量远高于α-ZrP,这与其宽的层间距和层间丰富的吸附位点有直接关系。尽管这样,在低pH体系中D-AM-ZrP对Sr2+的吸附容量低于其在中性体系中,一方面由于在强酸体系中高H+浓度可能产生竞争吸附,另一方面在高酸度下部分结构可能会扭曲变形进而会影响其吸附属性。在高pH体系中,OH-更容易络合体系中Sr2+,减少游离态Sr2+数量,影响其吸附容量。实验确定pH=4为最佳条件。
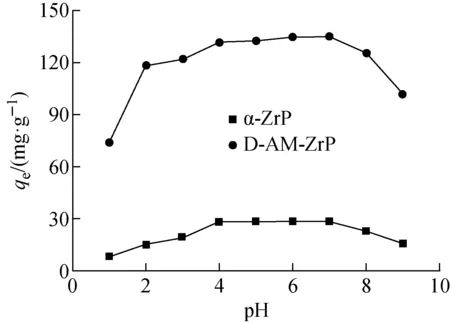
图6 体系pH对Sr2+吸附性能影响(CSr=100 mg·L-1,t=25 ℃)Fig.6 Effect of pH on the Sr2+ adsorption by α-ZrP and D-AM-ZrP
2.2.2初始浓度的影响 初始浓度对Sr2+吸附容量的影响示于图7。由图7可知,当体系中Sr2+初始浓度小于200 mg·L-1,D-AM-ZrP对Sr2+的吸附容量随着Sr2+浓度的增加而增加;而当Sr2+初始浓度大于200 mg·L-1,Sr2+吸附容量缓慢增加,随后达到吸附饱和。值得注意的是,D-AM-ZrP对Sr2+的吸附容量远高于α-ZrP。一方面α-ZrP层间距较窄,导致Sr2+在层间离子扩散吸附过程较慢,影响其对Sr2+吸附容量;另一方面,Sr2+在α-ZrP层间与吸附位点较少,(与两个P—OH发生作用),而当层间存在4-氨基苯并-18-冠-6膦酸时,吸附位点明显增加,Sr2+不仅和冠醚发生络合作用,也可以和层板间P—OH发生作用,因而Sr2+的吸附容量明显增加。
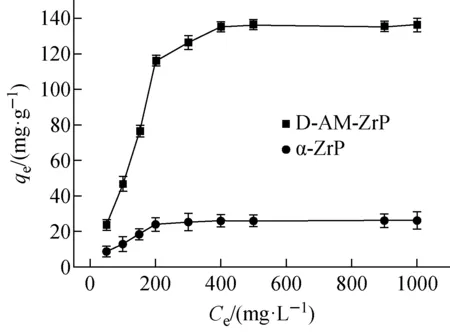
图7 初始浓度对Sr2+吸附容量的影响(t=25 ℃,pH=4)Fig.7 Effect of initial concentration on Sr2+ adsorption by α-ZrP and D-AM-ZrP
为了进一步探讨D-AM-ZrP对Sr2+的吸附过程,分别采用Langmuir和Freundlich等温模型对吸附数据进行拟合(图8)[15-16],获得相关参数(表1)。Langmuir单层吸附模型对等温数据拟合度远高于Freundlich吸附模型拟合结果,表明D-AM-ZrP对Sr2+的吸附过程符合Langmuir吸附等温吸附模型,属于单层化学吸附。基于该吸附模型计算D-AM-ZrP和α-ZrP对Sr2+的最大吸附容量为136.42和28.17 mg·g-1
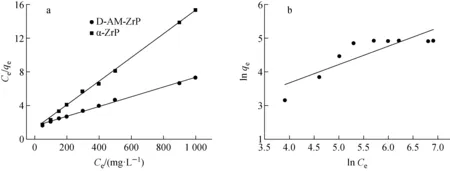
图8 Langmuir(a)和Frenchdlic(b)等温吸附模型拟合结果Fig.8 Langmuir isotherm model (a)and Frenchdlic isotherm model (b)

表1 Langmuir和Frenchdlic吸附模型拟合结果Table 1 Fitting results of Langmuir and Frenchdlic adsorption models
2.2.3吸附时间的影响 吸附时间对D-AM-ZrP吸附Sr2+的影响示于图9。由图9可知,该吸附过程分为二个阶段:第一阶段为快速吸附过程,主要涉及材料表面快速吸附,该阶段Sr2+与表面吸附位点快速结合,吸附容量快速上升;第二阶段为缓慢吸附直至吸附平衡阶段,随着时间的增加,吸附剂表面吸附位点被饱和,大多数Sr2+扩散进入层结构,整个过程离子扩散吸附过程较慢,直至Sr2+的吸附达到吸附平衡状态。D-AM-ZrP对Sr2+吸附平衡需要约4 h。
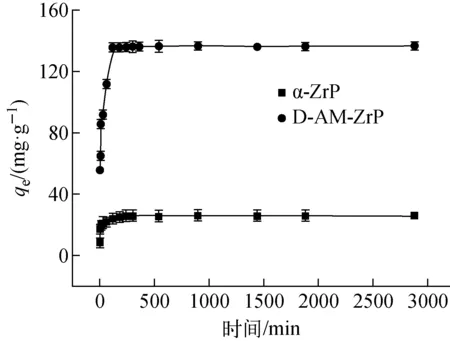
图9 时间对Sr2+吸附容量的影响(CSr=100 mg·L-1,t=25 ℃,pH=4)Fig.9 Effect of contact time on Sr2+ adsorption by α-ZrP and D-AM-ZrP
进一步采用一阶动力学模型和二阶动力学模型分别对吸附数据进行拟合[16],拟合结果见图10,相关拟合参数列于表2。准二级动力学吸附模型拟合度(图10b)优于准一级动力学模型(图10a),D-AM-ZrP对Sr2+吸附过程更符合二级动力学模型,其对Sr2+吸附过程不是简单的物理吸附过程,可能涉及离子交换等化学过程。

表2 准二级模型和准一级模型拟合结果Table 2 Fitting results of quasi-secondary model and quasi-primary model
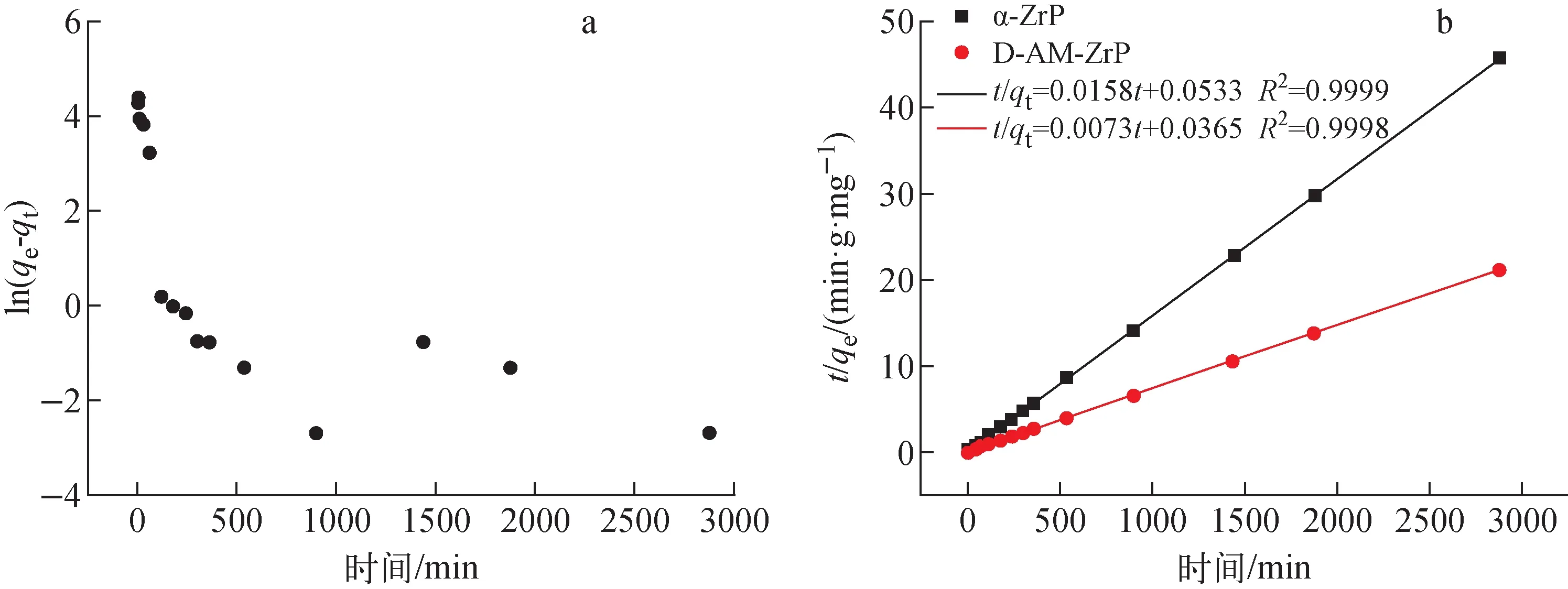
图10 准一级模型(a)和准二级模型(b)拟合结果(CSr=100 mg·L-1,0.2 mol· L-1 HNO3,T=298 K)Fig.10 Linearly fitted curve for Sr2+ adsorption of quasi-primary model (a)and quasi-secondary model (b)
2.2.4共存离子影响 实验中研究K+、Na+、Mg2+、Li+、Cs+、Al3+、Ce3+元素存在对Sr2+吸附容量的影响,结果示于图11。在复杂混合体系中D-AM-ZrP材料对Sr2+呈现良好的选择性,因其层间具有与Sr2+特异络合的18-冠-6。Sr2+离子的水合半径约为1.12 Å(直径为2.26 Å),与18-冠-6中O原子形成腔体的小大匹配,而K+、Na+、Mg2+、Li+、Cs+、Al3+、Ce3+等水合半径较大,无法与层间的18-冠-6进行络合配位,其少量的吸附主要由于材料表面的物理吸附。
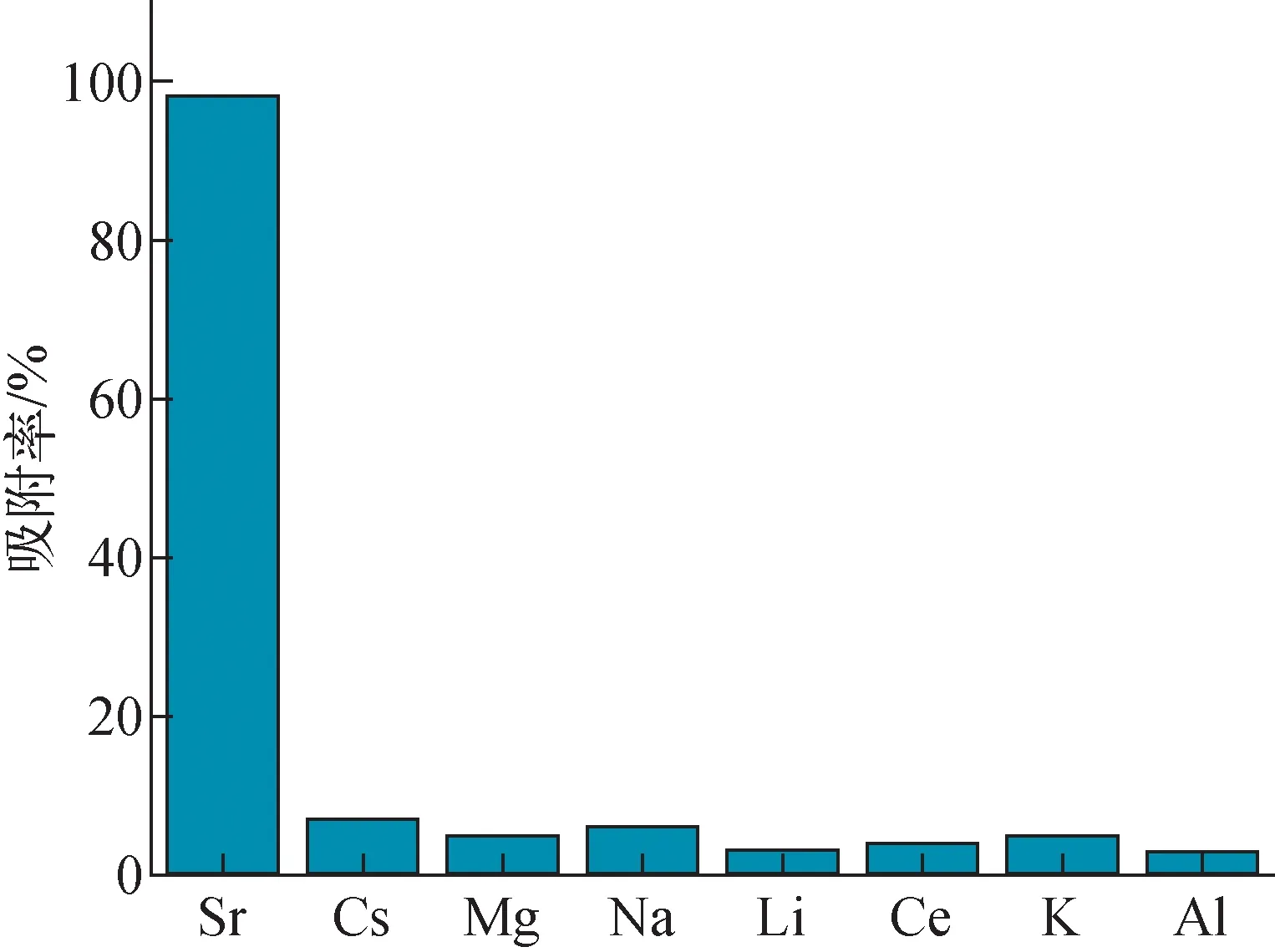
图11 共存离子对吸附Sr2+的影响(CSr=100 mg·L-1,pH=4,t=25 ℃)Fig.11 Effect of co-existing ions on Sr2+ adsorption
3 结论
为了有效改善α-ZrP对Sr2+的吸附性能,实验中采用直接反应插层的方法将4-氨基苯并-18-冠-6引入α-ZrP,制备成新型的冠醚@有机膦锆分离材料。通过调控反应过程中无机磷与有机膦的比例获得不同物化属性D-AM-ZrP样品,当反应过程中无机磷与有机膦比例为4∶1时,获得D-AM-ZrP具有花状形貌、良好晶型。进一步考察该材料对Sr2+的吸附性能,表明由于层间4-氨基苯并-18-冠-6的嵌入,不仅扩大了α-ZrP的层间距,而且显著增加吸附位点,D-AM-ZrP对Sr2+呈现良好的吸附性能。Sr2+吸附过程符合Langmuir等温吸附模型及准二级动力学吸附模型,其在弱酸条件下对Sr2+的最大吸附容量达到136.42 mg·g-1,优于未插层的α-ZrP(28.17 mg·g-1)。本实验为磷酸锆材料吸附属性的改善以及新型吸附材料的设计提供了新的研究思路。
