杂交鲟出血病病原的分离鉴定与组织病理学观察
2021-12-26杨成年朱成科唐征县易子琳韩璐璐阳龙江彭小倩任朝颖吕光俊
杨成年,李 芳,朱成科,唐征县,易子琳,韩璐璐,阳龙江,彭小倩,贺 蝶,李 杨,任朝颖,吕光俊
(西南大学 水产学院/淡水鱼类资源与生殖发育教育部重点实验室,重庆 402460)
鲟隶属于鲟形目(Acipenseriformes)鲟科(Acipenseridae)鲟属(Acipenser),是分布在北美洲、亚洲和欧洲东部地区的一种亚冷水性鱼类[1]。鲟肉厚味美,骨刺少,具有极高的营养价值和经济价值,尤其由鲟卵制作而成的鱼子酱更有“黑色黄金”之称[1-2]。我国于1956年首次攻克鲟人工繁殖技术,随后在全国范围内推广养殖。历经多年发展,我国鲟养殖规模不断扩大,养殖种类包括西伯利亚鲟(Acipenserbaerii)、施氏鲟(Acipenserschrenchii)、俄罗斯鲟(Acipensergueldenstaedtii)、杂交鲟(Acipenserbaerii♀×Acipenserschrenckii♂)等在内的多个品种,年产量超10万t[3]。杂交鲟因具有生长速度快、抗病力强、成活率高的特点,成为我国主要鲟养殖品种,其产量占总产量的80%以上[4]。但近年来,随着杂交鲟产业规模化、设施化的发展,养殖过程中疾病频发,尤其是细菌性疾病最为严重,阻碍鲟产业发展。目前已报道的细菌病病原主要包括海豚链球菌(Streptococcusiniae)、温和气单胞菌(Aeromonassobria)、嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)、类志贺邻单胞菌(Plesimonasshigelloides)等[5-6]。
2020年8月,重庆彭水某养殖场杂交鲟出现死亡现象,发病初期表现为离群独游、行动缓慢、食欲减退,腹部大面积充血、肛门红肿,解剖可见病鱼腹腔充盈血水、肠道充血红肿、体腔内壁出血,发病率高达30%~40%,死亡率达10%~20%。为明确此次杂交鲟患病原因,本研究从患病杂交鲟肝中分离到一株优势病原菌CQST-2,通过形态学观察、人工感染、生理生化特性测定、分子生物学方法对该病原菌进行鉴定,同时进行了毒力基因检测与药敏试验,并对患病组织进行病理观察,以期为该疾病的诊断和治疗提供科学参考依据。
1 材料与方法
1.1 试验材料
患病杂交鲟取自重庆市彭水县某杂交鲟养殖场,养殖水温20.0~21.0 ℃,pH值为7.6~8.2,溶氧5~8 mg·L-1,病鱼体重为1.0~1.4 kg;用于人工感染的健康杂交鲟购买自重庆市丰都县某鲟鱼养殖场,体重80~100 g,暂养在控温循环水养殖池,养殖期间水温20~22 ℃,pH值为7.2~7.8,溶氧8.5~9.1 mg·L-1,暂养期间早晚各投饵1次,每2 d换水1次,每次换水量为总体积的1/3。
1.2 主要试剂与仪器
药敏纸片,杭州微生物试剂有限公司;营养肉汤培养基,杭州微生物试剂有限公司;琼脂糖凝胶电泳回收试剂盒,北京全氏金生物技术有限公司;细菌基因组提取试剂盒,北京索莱宝科技有限公司;PCR反应试剂,日本Takara公司;pMD19-T,日本Takara公司;大肠埃希菌DH5α,日本Takara公司。
电泳仪,北京六一仪器厂;离心机5810R,德国Eppendef公司;PCR仪,美国Bio-Rad公司;微量核酸蛋白测量仪,美国Thermo Scientific公司;凝胶成像系统,美国Bio-Rad公司;组织切片机,美国Thermo Scientific公司;光学显微镜,日本Olymplus公司。
1.3 病原菌的分离与培养
选取濒临死亡、症状明显的病鱼,在无菌条件下用接种环从病鱼肝、脾、肾等组织取样划线接种在固体营养肉汤培养基上,28 ℃培养24 h,观察菌落形态特征,革兰氏染色后在光学显微镜下观察细菌微观形态。观察并选取优势单菌落进行重复划线纯化,4 ℃保存待用。
1.4 人工感染试验与半致死量LD50确定
挑取单个纯化菌株CQST-2接种于营养肉汤培养基,28 ℃培养24 h后,用0.65% NaCl溶液洗脱并离心收集菌液,参照麦氏比浊法将细菌浓度依次稀释为1.3×109、1.3×108、1.3×107、1.3×106CFU·mL-1菌悬液备用。捞取100尾健康鱼后随机分成4个试验组,1个对照组,每组20尾。试验组每条鱼腹腔注射0.2 mL的菌液,对照组注射等量的0.65% NaCl溶液。试验期间,水温维持在(22±1)℃,正常投喂饲料,并定时记录受试鱼的活动与死亡情况。对人工感染后濒临死亡的杂交鲟再次进行病原菌的分离鉴定。
1.5 16S rRNA、gyrB、cpn60和rpoB基因扩增和测序
用细菌基因组提取试剂盒提取细菌总DNA。PCR反应体系设为50 μL,DNA模板1 μL,10×EasyTaqBuffer 5 μL,上下游引物各1 μL(引物见表1)[7-8],dNTPs 4 μL,rTaq0.5 μL,ddH2O补足余量。PCR反应条件:94 ℃预变性4 min;94 ℃变性30 s,退火30 s,72 ℃延伸1 min,32个循环;72 ℃终延伸10 min,16 ℃保存。PCR产物用1%琼脂糖凝胶电泳进行检测。
将目的片段切胶纯化,连入pMD19-T载体,转化到大肠埃希菌DH5α,挑选阳性克隆送华大基因进行测序,测序序列运用Bioedit软件进行比对,用MEGA7软件构建系统进化树。
1.6 细菌的致病因子
毒力基因检测:按照文献[7]和[9]选取并合成维氏气单胞菌ompA、hly、aer、alt、act等5种毒力基因的引物(表1)。以上述提取的细菌DNA为模板进行PCR扩增,扩增产物经电泳检测后送华大基因进行测序,测序结果在GenBank中进行Blast比对。

表1 菌株CQST-2管家基因与部分毒力基因引物
1.7 病理组织
采用常规组织切片技术[7],将患病杂交鲟肝、脾、肾、肠、鳃依次经固定、乙醇梯度脱水、石蜡包埋、切片、染色、封片操作,显微拍照观察。
1.8 药敏试验
运用K-B纸片法检测细菌的耐药性[11]。取纯化单菌落进行扩大培养,离心后用0.65%无菌NaCl溶液调整浓度为1.01×108CFU·mL-1,用无菌棉签蘸取菌液后涂布在平板表面,然后用无菌镊子夹取药敏纸片并均匀贴于培养基表面,28 ℃培养24 h后测量抑菌圈大小,根据药品使用说明进行结果判定。
2 结果与分析
2.1 患病杂交鲟症状
患病杂交鲟表现为离群独游、精神不振、行动缓慢、摄食减少、鳃丝发黑、下颌出血、腹部出血、腹鳍基部出血(图1-A);解剖后见肝出血(图1-B);肠道螺旋瓣出血(图1-C);肠道红肿(图1-D);体腔内壁严重出血。
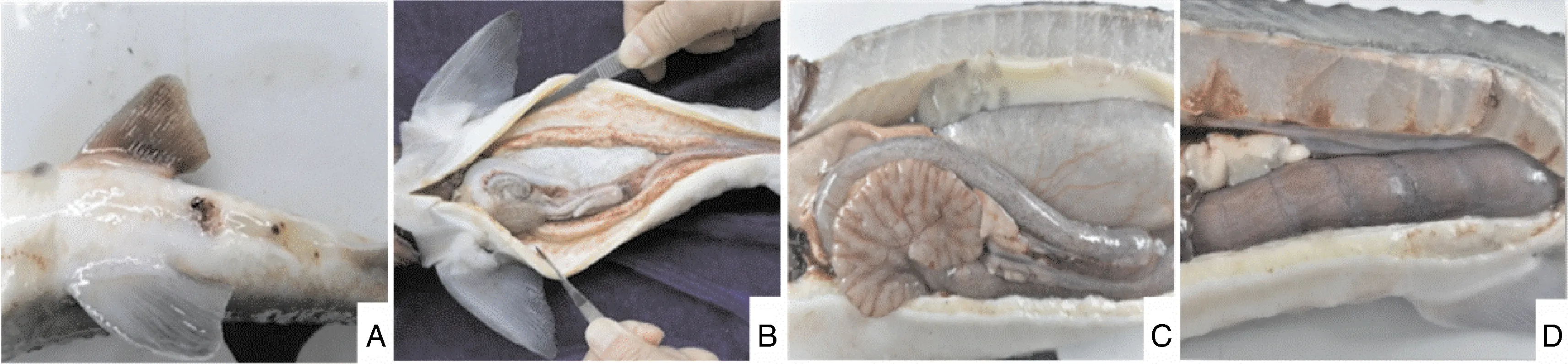
A,腹鳍出血;B,肝出血;C,肠道螺旋瓣出血;D,肠道红肿。
2.2 病原菌形态特征
菌株CQST-2在BHI培养基上28 ℃培养24 h后,形成肉眼可见、边缘整齐、呈隆起状、表面湿润、直径为0.12~0.53 mm的乳白色菌落。在光学显微镜下可见两端钝圆、单个或成对存在、大小约为1.52 μm×0.49 μm的革兰氏阴性杆菌(图2)。
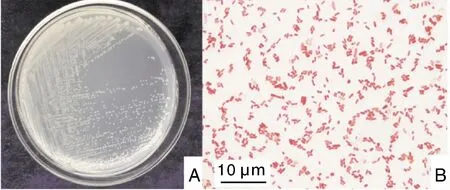
A,菌落形态;B,微观形态。
2.3 人工感染试验与LD50
人工感染试验表明,1.3×109CFU·mL-1菌液注射组试验鱼在2 d内全部死亡,1.3×106CFU·mL-1注射组试验鱼在7 d内的死亡率为10%,对照组试验鱼未出现死亡(表2)。感染死亡的杂交鲟临床症状表现为胸鳍基部出血、腹腔充盈血水、肠道充血发红等,此症状与自然状态下的病症相似;从人工感染濒临死亡的病鱼肝中再次分离到的菌株,经PCR扩增测序后鉴定为维氏气单胞菌(Aeromonasveronii)。根据改良寇氏法计算得到菌株CQST-2对杂交鲟的LD50为2.0×105CFU·g-1。
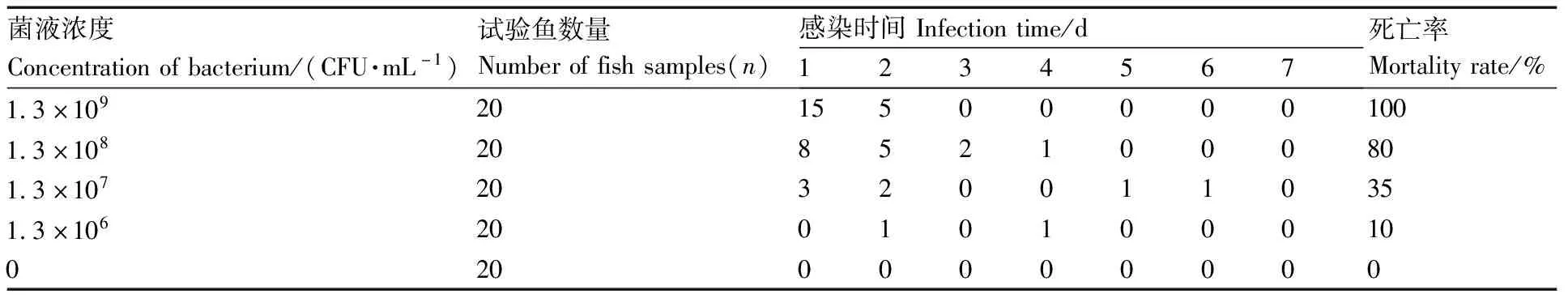
表2 CQST-2人工感染试验
2.4 病原菌CQST-2生理生化特性
从自然患病杂交鲟体内分离到的菌株可利用氧化酶、接触酶、麦芽糖、吲哚、明胶、半乳糖等,对鸟氨酸脱羧酶阴性、赖氨酸脱羧酶阳性、精氨酸双水解酶阴性(表3)。此结果与《伯杰氏细菌鉴定手册》(第8版)中维氏气单胞菌的特性相似,初步鉴定为维氏气单胞菌。从人工感染濒临死亡的杂交鲟体内分离到的菌株具有相似的生理生化反应(表3)。

表3 生理生化鉴定结果
2.5 基因序列分析与系统发育分析
用细菌16S rRNA、gyrB、rpoB、cpn60基因上下游引物扩增得到大小约为1 500、1 200、540、750 bp的片段,与预期结果一致,阴性对照组未扩增出相应的基因(图3)。16SrRNA、gyrB、rpoB和cpn60基因与维氏气单胞菌的同源性最高,构建的系统发育树也与维氏气单胞菌聚为一支(图4,图5)。以上鉴定结果表明,菌株CQST-2为维氏气单胞菌。同时,对人工感染获得的菌株进行16S rRNA、gyrB、rpoB、cpn60基因测序后,用Blast和MEGA7进行序列比对,结果表明,再分离的菌株与CQST-2相似率达100%。

M,DL2000 DNA marker; 1,16S rRNA; 3,gyrB; 5,rpoB; 7,cpn60; 2,4,6 and 8 were control group.
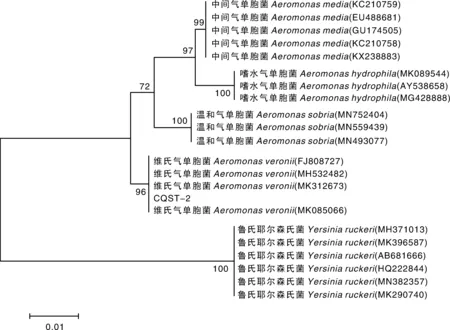
图4 基于菌株CQST-2的16S rRNA基因构建的系统发育树
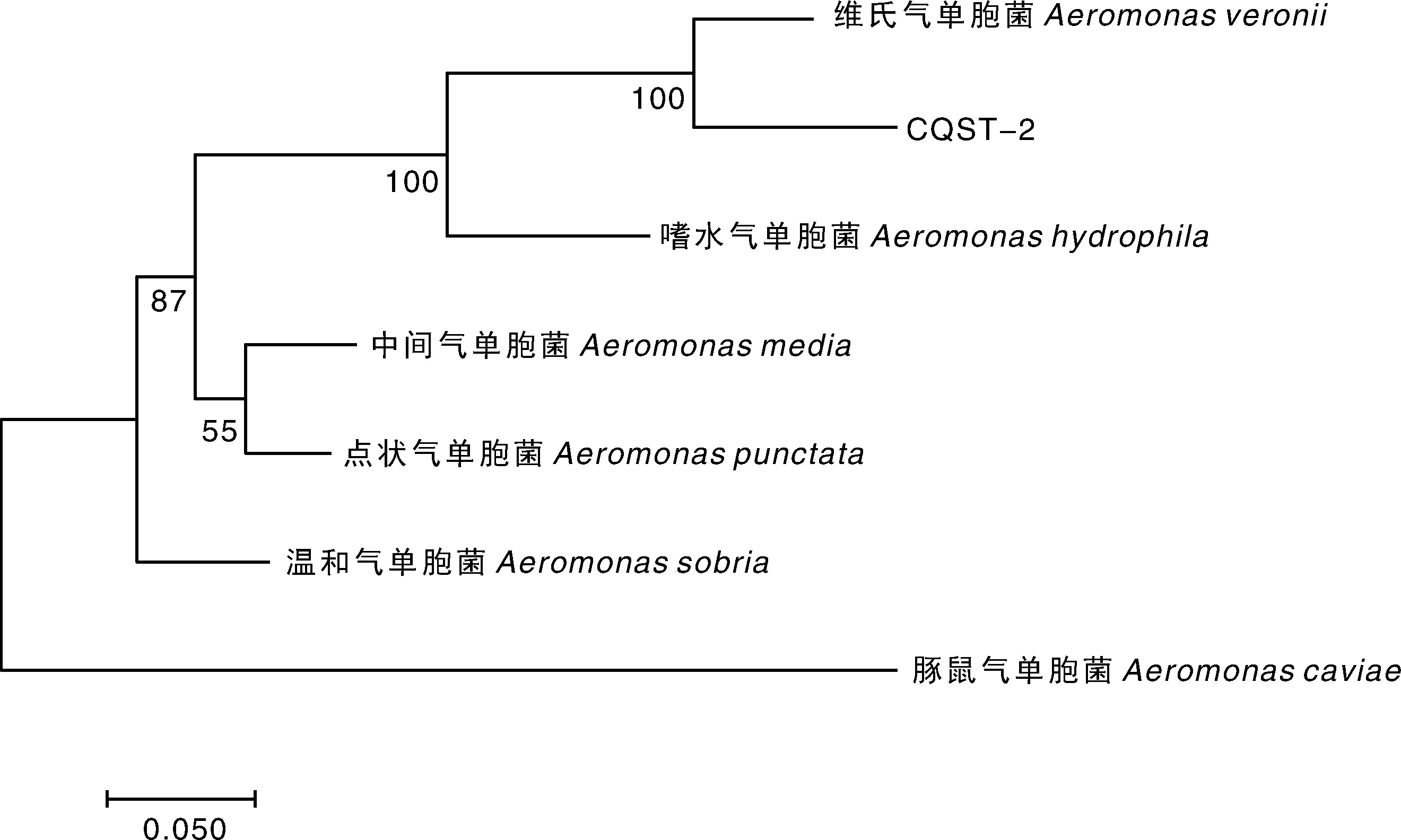
图5 基于菌株CQST-2 gyrB-rpoB-cpn60联合基因构建的系统发育树
2.6 细菌的毒力基因
通过PCR可扩增出大小约为1 000、250、500、300、600 bp的片段,扩增片段经纯化、克隆后进行测序,测序序列经Blast比对,发现与维氏气单胞菌的ompA、act、aer、hlyA、alt基因同源性最高。同时,以去离子水为模板未扩增出相应的基因(图6)。由此表明,该菌株携带有ompA、act、aer、hlyA和alt基因。
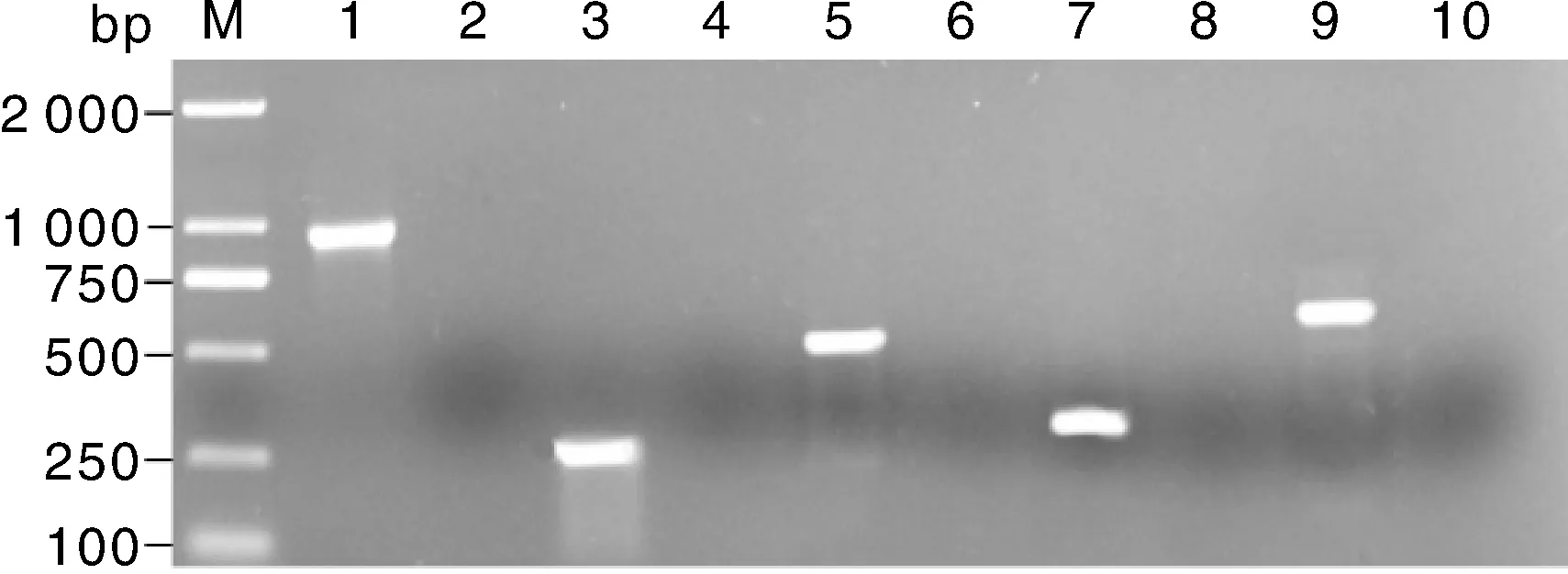
M,DL2000 DNA marker; 1,ompA; 3,act; 5,aer; 7,alt; 9,hlyA. 2,4,6,8 and 10 were control groups.
2.7 病理组织切片
病理组织切片表明:健康杂交鲟肝结构清晰,肝小叶区分明显,呈多角棱柱状(图7-A);患病杂交鲟肝类纤维化变性,毛细血管破裂,肝血窦扩张充血,中央静脉扩张充血,肝细胞轮廓结构模糊、界限不清,部分肝细胞核溶解或碎裂,更严重的则为细胞空泡变性,表现为细胞内含有大小不等的空泡(图7-B);健康杂交鲟脾红髓和白髓分区明显,细胞排列整齐(图7-C);患病杂交鲟脾组织红细胞浸润、胞质部分损伤、淋巴细胞聚集(图7-D);健康杂交鲟肾结构完整,肾小管间隙明显(图7-E),患病杂交鲟肾小管上皮细胞肿胀,炎性细胞浸润,部分肾小球萎缩变小(图7-F);健康杂交鲟肠结构完整,杯状细胞排列清晰,结构完整(图7-G,图7-H),患病杂交鲟肌肉层与浆膜层浸润大量红细胞,肠绒毛坏死、脱落,纹状缘结构破坏(图7-I,图7-J)。健康杂交鲟鳃丝排列整齐有序(图7-K),患病杂交鲟鳃小片弯曲不规则、上皮细胞增生,增生处有淋巴细胞浸润(图7-L)。
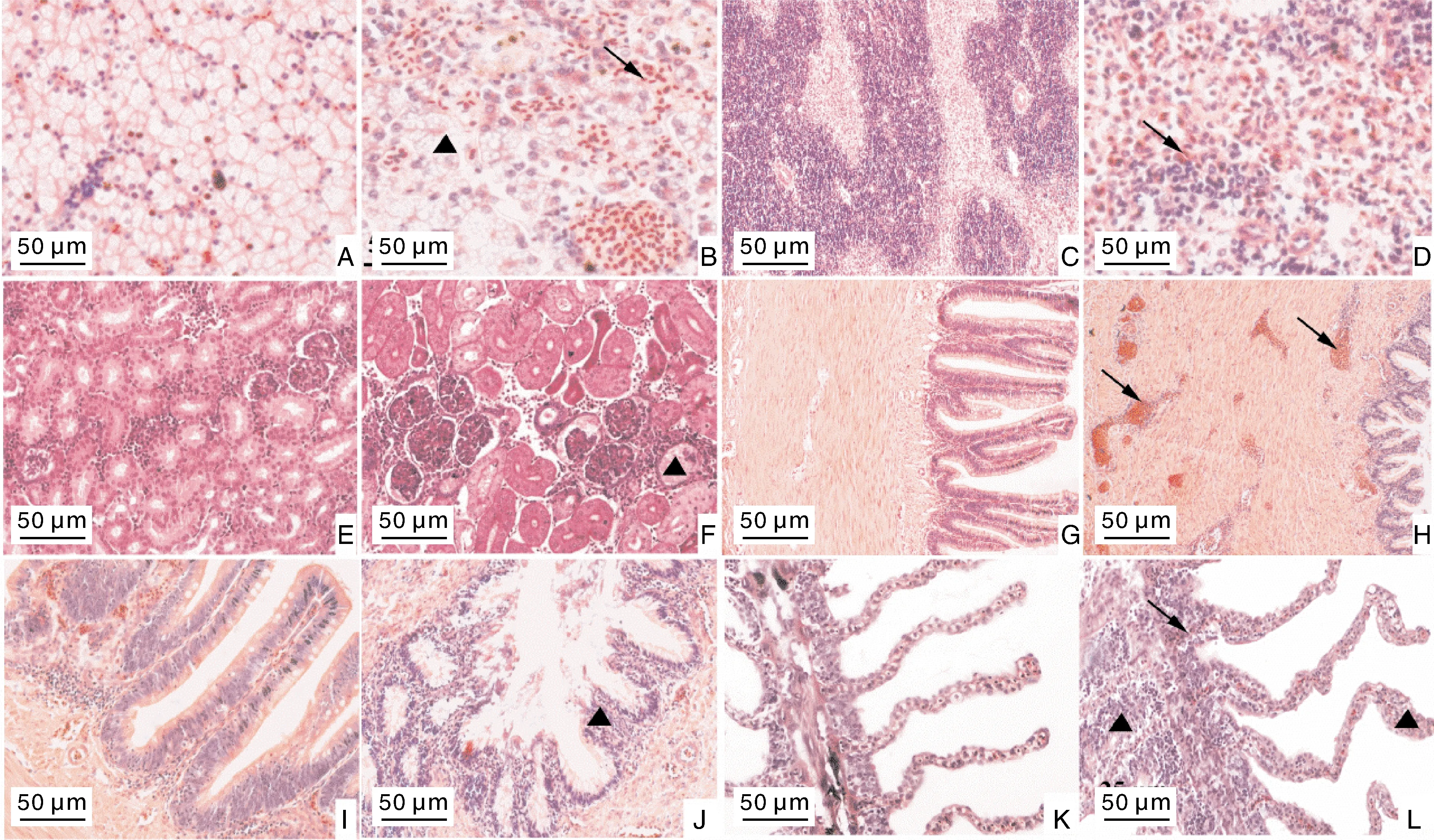
A,为健康杂交鲟肝脏;B,患病杂交鲟肝脏,肝血窦淤血(箭头),肝细胞变性呈空泡化(▲);C,为健康脾脏;D,脾脏充血(箭头);E,为健康杂交鲟肾脏;F,肾小球萎缩(箭头);G、I,为健康杂交鲟肠道;H,肠道充血(箭头);J,肠绒毛坏死脱落(▲);K,为健康杂交鲟鳃;L,鳃小片部分上皮细胞细胞增生(▲),红细胞浸润(箭头)。
2.8 药敏试验
根据NCCLS抗微生物药物敏感性试验执行标准K-B纸片扩散法检测菌株CQST-2对30种抗菌药物的耐药性试验,具体结果见表4。该菌株CQST-2对氧氟沙星、氟苯尼考、多黏霉素B、环丙沙星、恩诺沙星等18种药物高度敏感;对磺胺甲基异恶唑、红霉素和庆大霉素3种药物中度敏感;对麦迪霉素、吉他霉素、青霉素等9种药物耐药。
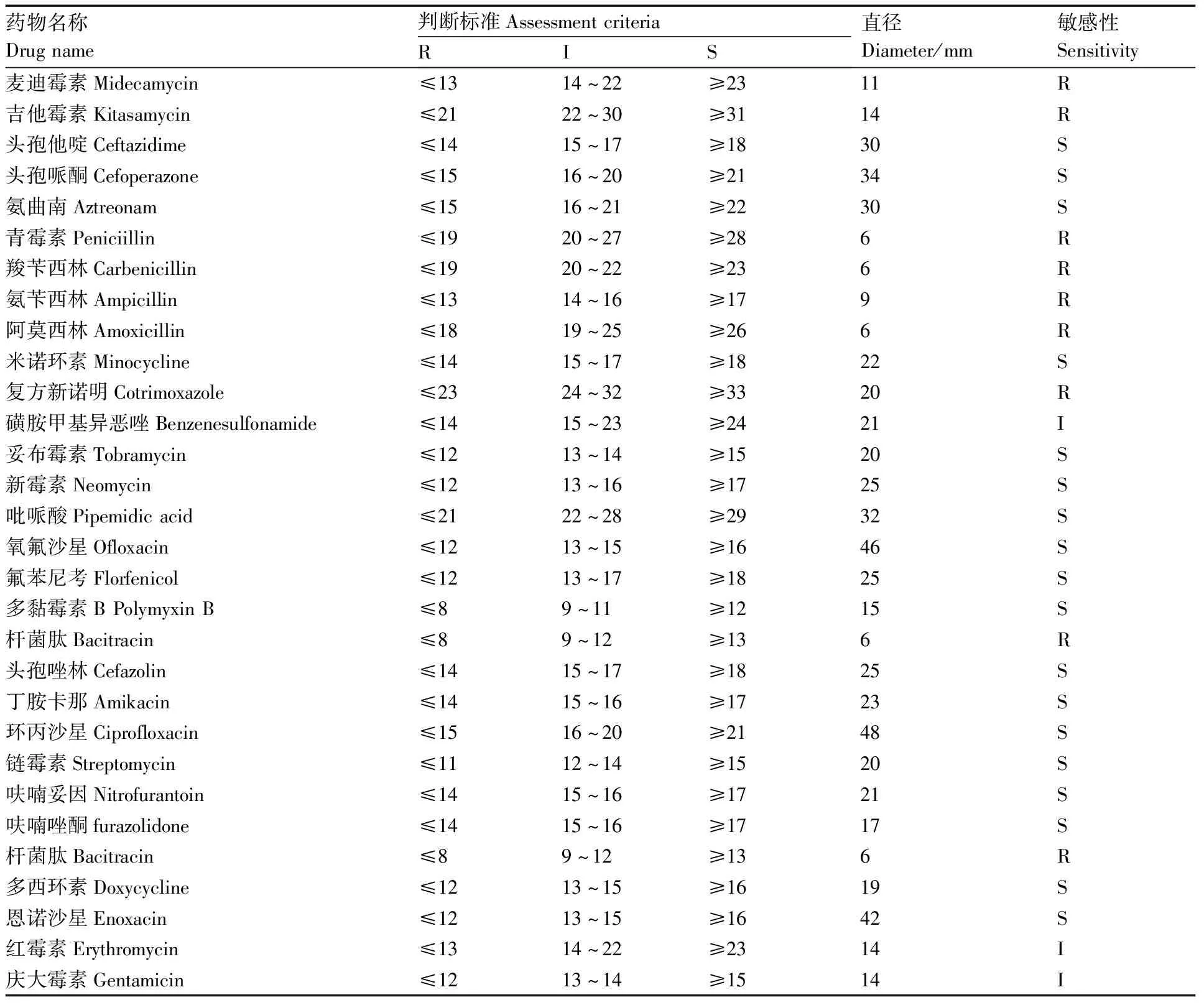
表4 CQST-2菌株的药物敏感性
3 结论与讨论
本研究从患病杂交鲟肝脏分离到菌株CQST-2,革兰氏镜检为阴性,生化反应与维氏气单胞菌较为相似,尤其是赖氨酸脱羧酶阳性、精氨酸双水解酶阴性,这是维氏气单胞菌的重要特征反应;虽然菌株对纤维二糖、山梨醇、肌醇特性与标准菌株具有一定差异性,推测造成这种差异的原因可能是来源不同的菌株由于地区、培养条件与气候等不同引起的菌株适应性变化,并非种间区别,由此将其初步鉴定为维氏气单胞菌[13-14]。为进一步确定其分类地位,本研究选用16S rRNA、gyrB、rpoB和cpn60基因进行鉴定。由于16S rRNA基因在细菌进化过程中具有高度保守性,有“分子化石”之称,是判别细菌的常用指标,但是其对近缘种的分辨率不够[15]。gyrB、rpoB和cpn60管家基因具有更高的替换率,弥补了同属近缘种间分辨不足的缺陷,使得鉴定结果更具有可靠性和准确性[16]。故本研究在利用16S rRNA序列鉴定的基础上,增加gyrB、rpoB和cpn60管家基因对菌株进化地位进行验证。鉴定结果结合形态特征、生化特性,以及16S rRNA、gyrB、rpoB和cpn60基因序列分析,综合判定为维氏气单胞菌。
维氏气单胞菌隶属气单胞菌科(Aeromonadaceae)、气单胞菌属(Aeromonas),是一种广泛存在于自然界的革兰氏阴性杆菌[17]。由于其极强的环境适应性,逐渐成为人类、禽类和鱼类的致病菌。研究发现,当人体感染维氏气单胞菌时,可引起腹泻、脑膜炎和败血症等疾病;当鸭抵抗力降低时,可引起脑血管充血、出血,严重时可导致死亡[18]。
此外,维氏气单胞菌作为一种条件致病菌,可造成多种水生动物患病,如华鲮(Sinilabeodecorustungting)感染维氏气单胞菌可表现为鳍条基部充血、肌肉出血等;当斑点叉尾鮰(Ictalunespunctatus)感染后,可表现为体表出血、脏器出血和腹腔积水等[19-20]。同时,国内外还有草鱼(Ctenopharyngodonidella)[21]、金鱼(Carassiusauratus)[22]、大口黑鲈(Micropterussalmoides)[23]、黄鳝(Monopterusalbus)[24]、泥鳅(Misgurnusanguillicaudatus)[25]等感染维氏气单胞菌的报道。
维氏气单胞菌的致病机制较为复杂,但普遍认为与其分泌的外毒素(exotoxin)、黏附因子(adherent factor)和胞外酶(exoenzyme)等有关。其中,外毒素在维氏气单胞菌的发病机制中起到重要作用,如aer和hlyA是导致宿主组织广泛出血和溶血的关键毒力基因[26],aer、hly、alt、act和ast是导致宿主肠炎的基因等[27]。本研究通过PCR技术扩增出维氏气单胞菌的ompA、hlyA、aer、alt、act基因,结合人工感染试验,显示分离菌株对杂交鲟有较强的致病性,可造成宿主体表充血、出血,内脏组织严重损害,这与文献[25]和[28]报道的维氏气单胞菌感染达氏鲟、西伯利亚鲟的症状相一致。虽目前已有维氏气单胞菌感染杂交鲟的报道,但是缺乏相应病理变化的描述[29]。在本研究中,患病鲟肝、脾、肠出现不同程度的病变,肝细胞肿胀,广泛空泡变性,严重的表现为核皱缩、溶解,这影响到肝物质交换和排出毒素的功能,最终导致肝中脂肪粒积累,可形成脂肪肝[25,30];脾红细胞浸润、胞质部分损伤、淋巴细胞聚集,这与海豚链球菌感染鲟的病症一致[31]。肠道病变最为明显,肠绒毛坏死脱落,部分区域固有膜裸露,肌肉层充血发红,这可能与维氏气单胞菌产生毒素有关,从而损伤肠道结构,影响肠道吸收营养物质的功效。
药敏试验结果表明,从患病杂交鲟体内分离的维氏气单胞菌CQST-2对氧氟沙星、氟苯尼考、多黏霉素B、环丙沙星、恩诺沙星等18种药物高度敏感;对麦迪霉素、吉他霉素、青霉素等9种抗菌药物表现耐药。此试验结果可为养殖场杂交鲟养殖生产过程中疾病的早期预防和治疗提供科学依据。但该试验结果与从草鱼[32]、华鲮[18]、岩原鲤[8]、西伯利亚鲟[28]等体内分离到的维氏气单胞菌的药敏试验结果有差异,可能与菌株来源不同,以及不同养殖场使用抗菌药物情况不同等有关。因此,在进行抗菌药物治疗时,首先应参照致病菌株的药敏试验结果,同时结合无公害食品渔用药物使用准则(NY 5071—2002)和农业农村部渔业渔政管理局印发的《水产养殖用药明白纸2020年1、2号》等相关规定,选用国家允许、效果佳的抗菌药物进行治疗。
