金寨县桑黄的菌种鉴定与生长特性研究
2021-12-26程安东汪本勤
程安东,汪本勤
(六安职业技术学院,安徽 六安 237158)
桑黄别称桑耳、桑臣、桑黄菇、胡孙眼、松根等,在东亚、非洲、中美洲地区均有分布,一般寄生于桑属的植物上,生长后期子实体呈黄褐色,因而得名“桑黄”[1],在两千多年前中国最早的中药学专著《神农本草经》、唐初藤权的《药性论》、唐代苏敬《新秀本草》、明代李时珍的《本草纲目》中均有记载[2]。现代桑黄研究兴起于第二次世界大战之后的日本,由于美国对日本广岛和长崎投放原子弹致使当地居民受核辐射影响,患癌人数增加,而长崎女岛的癌症病例明显低于广岛和长崎的其他区域,日本学者调查发现主要是由于当地居民服用了岛上桑树生长的桑黄,随后日本学者在1968年通过试验发现桑黄具有明显的抗肿瘤功效[3]。
在分类学上桑黄属于真菌界(Fungi)担子菌门(Basidiomycota)蘑菇纲(Agaricomycetes)锈革菌目(Hymenochaetales)锈革菌科(Hymenochaetaceae),Phellinus、Inonotus和Fomitiporia等属的桑黄在文献中均有出现。为了明确桑黄属的划分,戴玉成教授通过大量的研究将20个Phellinus属的小种组成一个亚属Fuhifomes,戴玉成教授还通过对比P.baumii与P.linteus的桑黄标本,认定传统中药“桑黄”的拉丁学名为Phellinusbaumii,并对P.baumii-P.linteus类群中所有种的划分做了一些调整,将有些原来隶属Phellinus属的种划分到了Inonotus属[4-7]。目前在药用桑黄菌种类中认定I.linteus、I.baumii、I.vaninii、I.lonicerinus、I.lonicericola、I.sanghuang、I.tenuicontextus、I.weigelae、I.weirianus这9种桑黄属于药用真菌桑黄类群[8]。
目前,桑黄作为珍贵的传统药用真菌被人们越发受到重视,国内外研究人员对桑黄的药理作用进行了非常多的研究,桑黄是目前国际上公认生物治癌药剂中最为高效的一种药用真菌[9-11],此外桑黄还具有调解免疫功能、抗氧化等作用[12-13]。近年来,桑黄菌在医药制剂与保健品行业的需求量越来越大。在皖西大别山的金寨县永福桑黄菌种植合作社培育了大量的桑黄菌,其种类仍未能得到鉴定,笔者采集了其种植的桑黄子实体带回实验室进行分离纯化培养,通过ITS序列分析将菌种鉴定为瓦宁木层孔菌(Sanghuangporusvaninii)即杨树桑黄。
瓦宁木层孔菌俗称杨黄,因其常见于山杨(Populusdavidiana)树干上,因而得名杨黄。吴声华等[3]在2020年发表文章将瓦宁木层孔菌归类为担子菌门(Basidiomycota)蘑菇纲(Agaricomycetes)锈革菌目(Hymenochaetales)锈革菌科(Hymenochaetaceae)桑黄孔菌属(Sanghuangporus),并对中国桑黄产业的发展指明方向,认为桑树桑黄及杨树桑黄在药用桑黄种类中都应该得到认可与推广。瓦宁木层孔菌主要的药用成分为子实体,是一种桑黄类药用真菌[14-15],该菌最早报道出现在1960年的俄罗斯远东,1993年在我国长白山自然保护区发现该菌,随后又在黑龙江的小兴安岭以及东乌苏里江与兴凯湖之间完达山老爷岭等地区被发现[16],韩国、朝鲜、日本也有分布[17]。虽然杨树桑黄的药理成分及功效比桑树桑黄略差[6],但介于桑树桑黄的难培养及生长条件苛刻且市场价格约是杨树桑黄的10倍等因素,杨树桑黄目前占据中药桑黄的大部分市场。
本研究以六安市金寨县永福桑黄菌种植专业合作社提供的桑黄菌株JS-1菌株为实验材料,对其生长特性进行研究,为进一步探究瓦宁木层孔菌的药用成分、快速繁殖、发酵生产及药用开发等提供帮助。
1 材料与方法
1.1 供试菌株来源
供试桑黄菌株JS-1由金寨县永福桑黄菌种植专业合作社提供,在六安职业技术学院植物病理实验室进行分离、纯化、形态学鉴定以及保藏。
1.2 供试培养基与分离、培养与保藏
首次分离选用马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,无水葡萄糖20 g,琼脂粉15 g,自来水1 000 mL,pH自然。对采集的子实体在无菌操作台上,使用75%乙醇棉球擦拭子实体表面,进行杀菌消毒,无菌的解剖刀由菌伞向基部切开,用无菌的接种钩在切面中线距离菌伞表面1/3处勾取一小块组织,迅速的插入培养基表面,密封后放置于26 ℃恒温培养箱中黑暗培养。组织块菌丝萌发后,挑取菌落边缘的菌丝进行进一步纯化培养。待菌丝长满平面1/3后将培养皿转移至4 ℃冰箱内避光保存。
1.3 菌株及菌丝的形态学观察
将分离纯化的菌株在温度为28 ℃恒温黑暗培养箱内用PDA培养基培养,观察菌落生长过程中形态颜色变化特征;使用插片培养法在显微镜下观察菌丝形态特征并拍照记录。
1.4 桑黄菌rDNA-ITS序列扩增与亲缘关系构建
将分离得到的菌株在PDA培养基上培养7 d,将收集的菌丝置于1.5 mL的离心管,迅速放入液氮速冻,加入石英砂手工研磨。加900 μL的2% CTAB和90 μL的10% SDS。振荡使其充分混匀,60 ℃水浴1 h,期间不时地颠倒EP管,然后12 000×g离心10 min。将上清液移至新的EP管中,加700 μL酚氯仿异戊醇,充分混匀,12 000×g离心10 min。取上清550 μL移至新的EP管加入550 μL氯仿,充分混匀。12 000×g离心10 min。取450 μL上清液,加入900 μL无水乙醇,混匀在-20 ℃沉淀30 min,12 000×g离心10 min。弃上清,加800 mL 75%乙醇洗涤,12 000×g离心5 min。弃上清,控干管内水分。37 ℃放置10 min。加20 μL无菌水,现加入1 μL RNase液,37 ℃酶解1 h。电泳检测质量,保存于-20 ℃冰箱待用。
PCR反应程序采用94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,32个循环;72 ℃延伸5 min。PCR产物用1%的琼脂糖凝胶电泳检测,并用AXYGEN凝胶纯化试剂盒回收DNA片段,连接到T载体上,转至大肠埃希菌JM109中,PCR阳性检测后送南京擎科生物公司测序。测序结果在GenBank 中进行序列比对并下载相关序列,利用DNAMan进行比对分析,用MEGA 6.0软件构建系统进化树。同时将桑黄菌株JS-1的ITS序列与GenBank中已经登录的其他桑黄菌株的ITS序列进行比对,构建系统发育图。
1.5 选择基础培养基
PDA培养基:200 g马铃薯(去皮),20 g葡萄糖,15 g琼脂,3 g KH2PO4,1 000 mL水,pH自然。玉米综合培养基:20 g玉米粉,20 g葡萄糖,1 g KH2PO4,15 g琼脂,1 000 mL水。木生菌标准培养基:20 g葡萄糖,10 g蛋白胨,2 g酵母膏,1 g KH2PO4,15 g琼脂,1 000 mL水。配置好3种基础培养基,用高压灭菌锅灭菌后,在无菌工作台上进行倒板。用直径为5 mm的灭菌打孔器在母种菌落边缘打取菌饼,将菌饼有菌丝的一面朝下放置于3种基础培养基平板上,密封后置于28 ℃恒温黑暗培养箱中培养,每隔24 h观察记录3种培养基中菌落的直径,每种基础培养基设5个重复。菌丝的日平均生长速度=[菌落直径(mm)-菌饼直径(mm)]/生长时间(d),筛选出最适宜菌株生长的基础培养基。
1.6 菌株JS-1生长条件优化的单因素试验
1.6.1 筛选菌丝生长最适温度
以PDA培养基作为基础培养基测定温度对菌丝生长的影响,用直径为5 mm的灭菌打孔器在母种菌落边缘打取菌饼,将菌饼有菌丝的一面朝下接种于培养基平板的中央,密封后分别置于不同温度的恒温黑暗培养箱中培养,温度设置在5~40 ℃,先每隔5 ℃设置一组试验,每隔24 h用十字交叉法测量菌落直径,找出峰值区间后再每隔1 ℃设置一组试验。每个温度处理下设置3组重复。
1.6.2 筛选菌丝生长最适pH
用浓度5 mol·L-1的HCl和NaOH溶液将PDA培养基的pH调成3、4、5、6、7和8、9、10、11、12,用灭菌打孔器打取直径为5 mm的菌饼,菌丝一面朝下接种在不同pH的培养基中央,后放置于28 ℃恒温黑暗培养箱中培养,用十字交叉法每隔24 h测量菌落直径,观察菌落形态。每个pH处理设置3组重复。
1.6.3 筛选最佳碳源与氮源
将PDA培养基中的葡萄糖去除作为基础培养基,用来筛选最适宜菌种生长的碳源。用蔗糖、半乳糖、可溶性淀粉、麦芽糖、甘露糖、纤维乙糖作为碳源对比葡萄糖作为碳源对菌落生长的影响。将PDA培养基中的马铃薯浸汁去除作为基础培养基,用来筛选最适宜菌种生长的氮源。用蛋白胨、牛肉浸膏、玉米粉、硝酸钠、酵母浸膏作为氮源对比马铃薯浸汁作为氮源对菌落生长的影响。用打孔器打取直径为5 mm的菌饼接种于含不同氮源和碳源的基础培养基中央,放置于28 ℃恒温黑暗培养箱中培养,用十字交叉法每隔24 h测量菌落直径,观察菌落形态。每组处理设置3组重复。
1.7 不同培养因子对JS-1菌丝生长影响的正交试验
为了考虑不同生长条件因子间的交互作用,依据上节筛选出单因子结果,以温度、pH和不同质量浓度的碳源、氮源进行L9(34)正交试验,试验的各因子及水平见表1,依据菌丝的生长速度为指标,筛选最优生长条件组合,每组试验设计6组重复。

表1 桑黄菌株JS-1最适生长条件的正交试验因素与水平
1.8 测定菌丝的致死温度
在28 ℃培养7 d的菌落边缘打取直径为5 mm的菌饼,分别放置在含有3 mL无菌水的试管中,摇晃均匀,在恒温水浴锅中静置10 min,放入冰水中快速冷却至常温,接种于PDA培养基上,28 ℃恒温黑暗培养,观察菌丝生长情况。水浴锅的温度设置在40~60 ℃先以5 ℃为间隔,再以1 ℃为间隔进行试验。每组处理设置3组重复。
1.9 统计学分析
试验中所有测得数据采用SPSS 21.0统计软件进行处理和分析。
2 结果与分析
2.1 桑黄菌株JS-1子实体生长环境与形态、菌落与菌丝形态观察
桑黄菌株JS-1子实体生长环境及形态如图1所示,子实体有菌盖无菌柄,外形呈马蹄形,基部较厚外缘薄,生长初期子实体为乳黄色,成熟后颜色变深呈黄褐色,表面粗糙,外缘新生部位呈金黄色,纵切后菌肉木质化,呈暗黄色软木状。
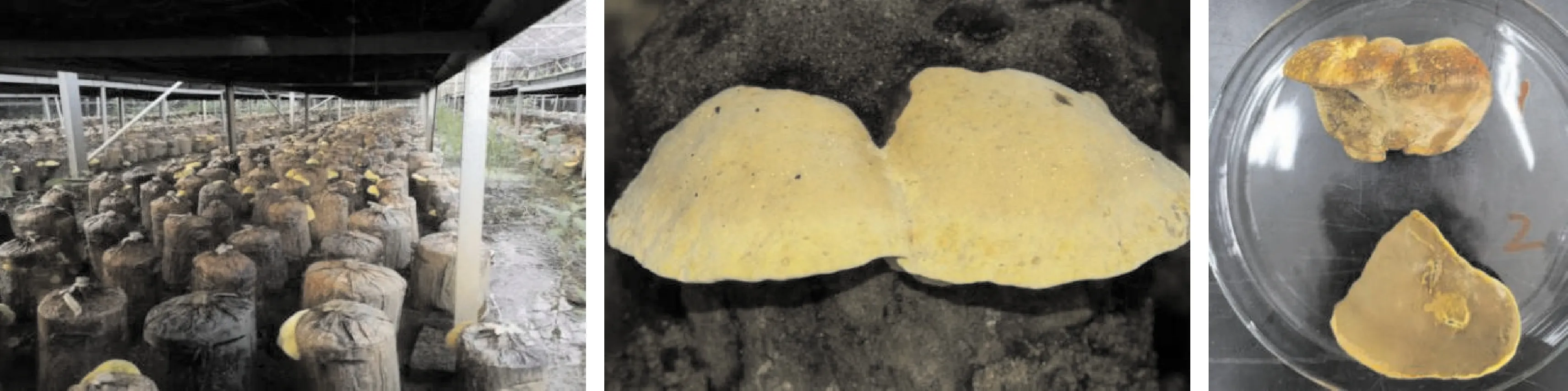
图1 JS-1子实体生长环境与形态特征
如图2所示,JS-1菌落为圆形,生长初期菌丝白色,呈绒毛状沿着接种块向外辐射状生长,可见边缘绒毛状,中心部分出现一个小凸起。显微镜下观察菌丝发达,细长,菌丝表面相对光滑,无色透明,顶端顿圆,有不明显的分隔;生长旺盛期菌落呈乳黄色,边缘新生菌丝为白色,显微镜下菌丝密集,少有分支;生长中后期菌落中心部位开始老化,呈黄褐色软木状,有明显环纹,外圈呈乳黄色,显微镜下观察菌丝膨大呈干瘪状,少量菌丝形成凸起。
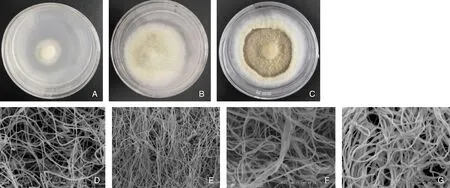
A,生长初期菌落(3 d);B,生长旺盛期菌落(10 d);C,生长中后期菌落(15 d);D,生长初期菌丝;E,生长旺盛期菌丝;F,生长中后期菌丝;G,老熟菌丝.
2.2 桑黄菌株JS-1 rDNA-ITS序列扩增及结果分析构建亲缘关系图
JS-1的rDNA-ITS序列长度为462 bp,参照吴声华等[3]对桑黄孔菌属种类的划分,用BLAST软件在GenBank中与已经登录的其他桑黄孔菌属菌株的rDNA-ITS序列进行比对,结果表明,菌株JS-1的rDNA-ITS序列与GenBank中登录号为HQ845055.1的Sanghuangporusvaninii菌具有100%的相似性。通过系统发育树分析表明,所得桑黄菌与Sanghuangporusvaninii同源性最高,遗传距离最近,位于系统发育树的同一分支,如图3所示。结合JS-1的形态特征,以及rDNA-ITS序列分析结果,判定所得桑黄应为瓦宁木层孔菌Sanghuangporusvaninii,即杨树桑黄。
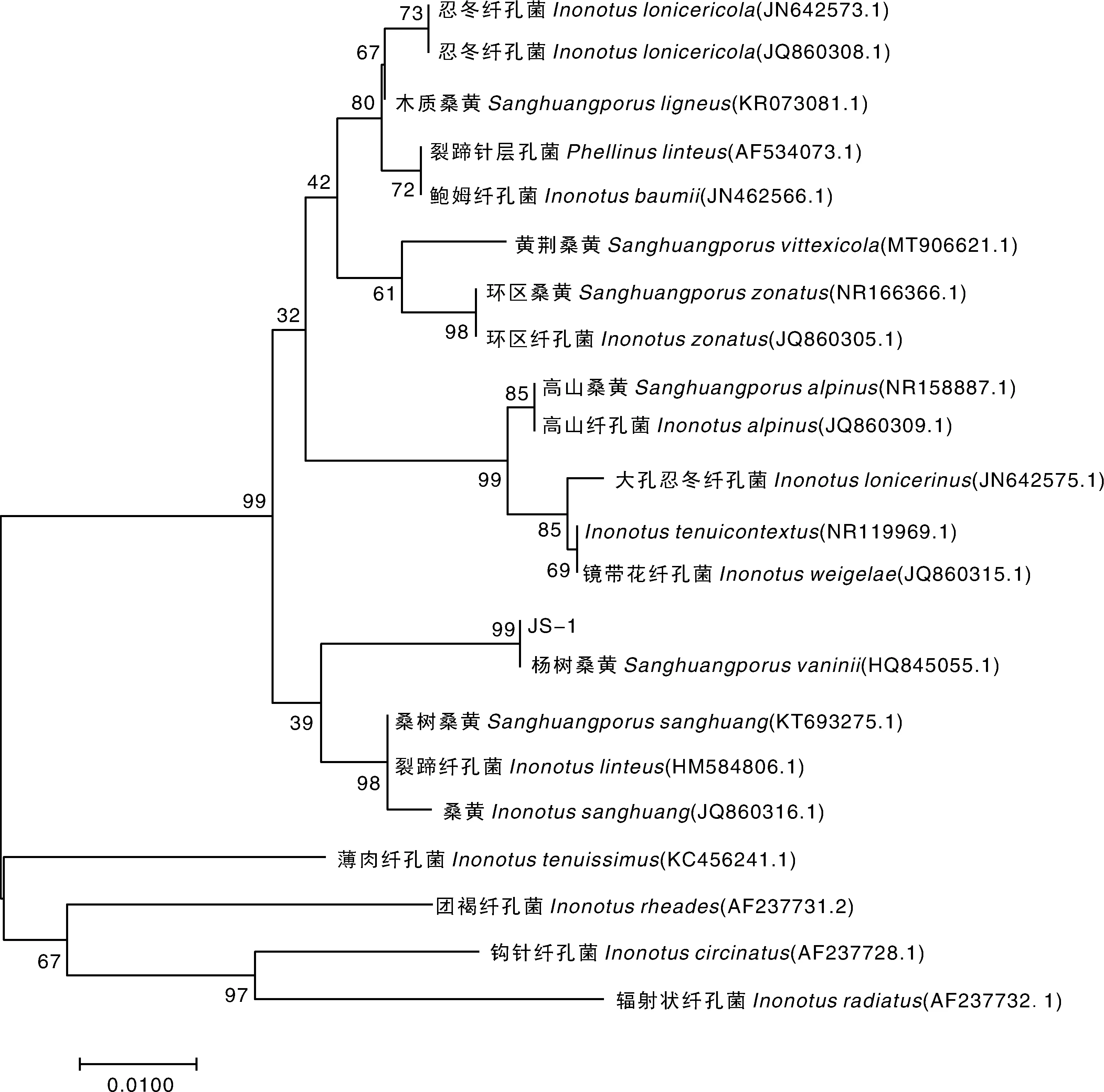
图3 基于rDNA-ITS序列构建菌株JS-1的系统发育树
2.3 桑黄菌株JS-1在3种基础培养基上生长状况
将JS-1在3种基础培养基上28 ℃黑暗培养3、7、10、15、20 d,菌株生长状况及生长速度如图4与表2所示。从图4可以明显看出,JS-1菌株在PDA培养基上的长势最好菌丝浓密且茂盛,木生菌标准培养基上虽然菌丝生长速度最快但菌丝密度小于PDA培养基且菌落呈暗黄色,在玉米粉综合培养基上的长势最差,虽然菌丝生长速度较快,但是菌丝非常稀疏且在培养皿表面匍匐生长,因此,选择PDA培养基作为JS-1基础培养基。
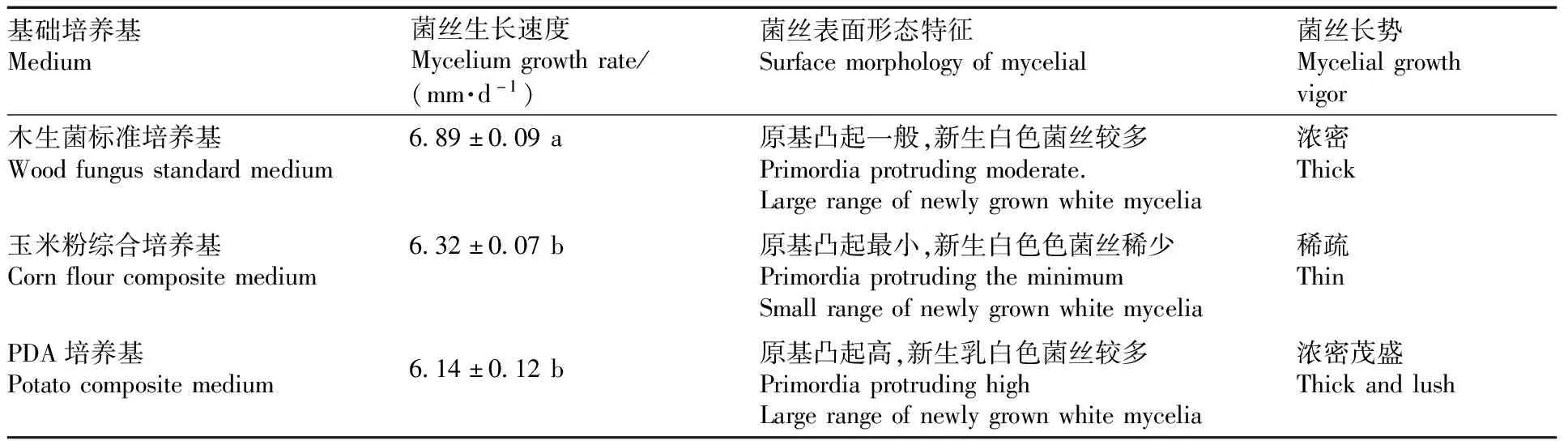
表2 JS-1在3种基础培养基上生长情况
2.4 不同生长条件因子对JS-1生长影响的单因素试验
2.4.1 温度对JS-1菌丝生长的影响
以PDA培养基作为基础培养基培养7 d后发现,菌株在5~35 ℃区间均可生长,40 ℃时菌株停止生长,如表3所示。结果显示,在5~28 ℃,菌落的生长速度随温度的升高而升高,且各组处理之间存在显著差异;温度在28 ℃时,菌落的生长速度最快,温度在35 ℃处理条件下菌丝生长缓慢,且菌落颜色呈纯白色。结果表明,温度为28 ℃时最适合JS-1菌丝的生长。
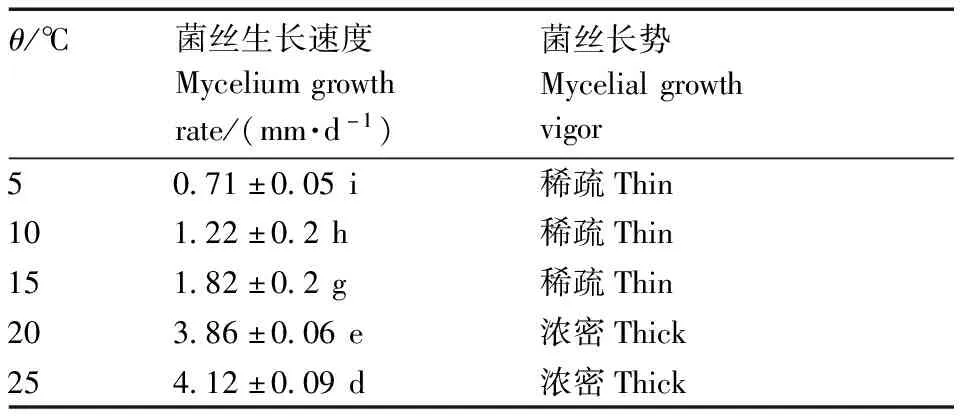
表3 JS-1不同温度条件下生长情况
2.4.2 pH对JS-1菌丝生长的影响
以PDA培养基作为基础培养基培养7 d,结果显示,pH在4~10菌丝均可生长,如表4所示。当pH为3、11、12时菌株停止生长。当pH为7时,菌丝生长速度最快。结果表明,pH为7时最适合JS-1菌丝的生长。
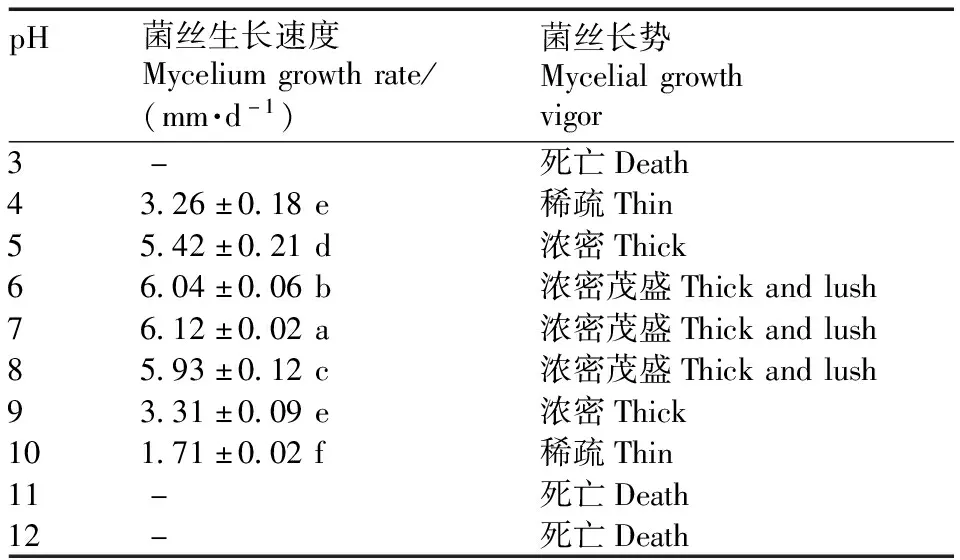
表4 JS-1不同pH值条件下生长情况
2.4.3 不同碳源培养基对JS-1生长的影响
以PDA培养基去除葡萄糖作为基础培养基,将JS-1菌株接种至含不同碳源的培养基上培养7 d,结果如表5所示,在所选择的7种碳源中,最适合瓦宁木层孔菌生长的碳源为葡萄糖,菌丝呈现乳黄色,浓密且茂盛,其次为蔗糖、半乳糖、可溶性淀粉、麦芽糖、甘露糖、纤维乙糖。结果表明,JS-1菌株对葡萄糖的利用率最高。
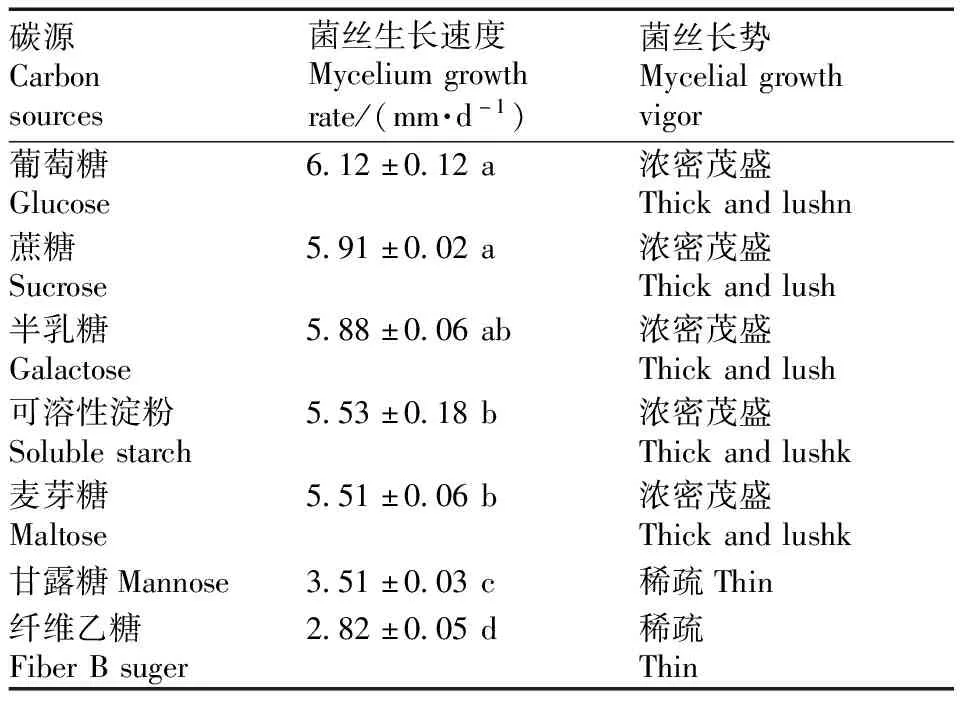
表5 不同碳源对JS-1生长的影响
2.4.4 不同氮源培养基对JS-1生长的影响
以PDA培养基去除马铃薯浸汁作为基础培养基,添加不同的氮源培养7 d,结果如表6所示,在所选择的6种氮源中,以蛋白胨为氮源的培养基上菌落生长速度最快,且生长速度高于其他氮源,菌丝呈淡黄色,生长浓密但不茂盛;以马铃薯浸汁为氮源的培养基上菌落生长速度略慢于蛋白胨和玉米粉浸汁,但其长势最为茂盛,菌丝呈乳黄色,如图5中A、B、C所示。且在培养15 d后,以马铃薯浸汁为氮源的培养皿上最先出现黄褐色软木状环纹,如图5中E、F、G所示,玉米粉浸汁、牛肉浸膏、硝酸钠、酵母浸膏为氮源时,菌丝生长较慢或稀疏,不利于菌株的生长。结合菌丝生长速度及菌落长势,认为马铃薯为JS-1生长最适氮源。
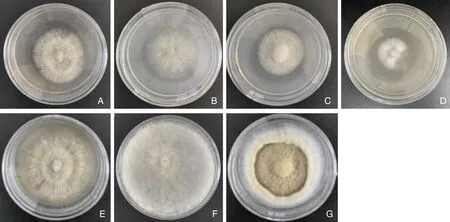
A,蛋白胨(7 d);B,玉米粉浸汁(7 d);C,马铃薯浸汁(7 d);D,牛肉浸膏(7 d);E,蛋白胨(15 d);F,玉米粉浸汁(15 d);G,马铃薯浸汁(15 d)。
表6 不同氮源对JS-1菌丝生长的影响
2.5 不同培养因子对JS-1菌丝生长影响的正交试验
通过对不同培养因子及其水平的正交试验,结果如表7所示。从结果极差可以得到对桑黄菌株JS-1菌丝生长影响程度的条件依次为pH(D)>温度(C)>马铃薯(B)>葡萄糖(A),结合图6得到JS-1菌丝生长速度最快的组合为A2B1C3D3,即培养基中葡萄糖20 g·L-1,马铃薯使用量100 g·L-1,pH为8,培养温度30 ℃。
表7 不同培养因子对JS-1菌丝生长影响的正交试验结果
2.6 JS-1菌丝致死温度测定
结果显示,JS-1菌丝块放入41~44 ℃水浴锅处理后接种于PDA培养基上,均可生长。如图6所示,43 ℃处理培养3 d后菌丝能正常生长呈淡黄色,44 ℃处理后菌丝生长速度较慢呈白色,45 ℃、46 ℃处理后菌丝不能生长,测定45 ℃为JS-1菌丝的致死温度。
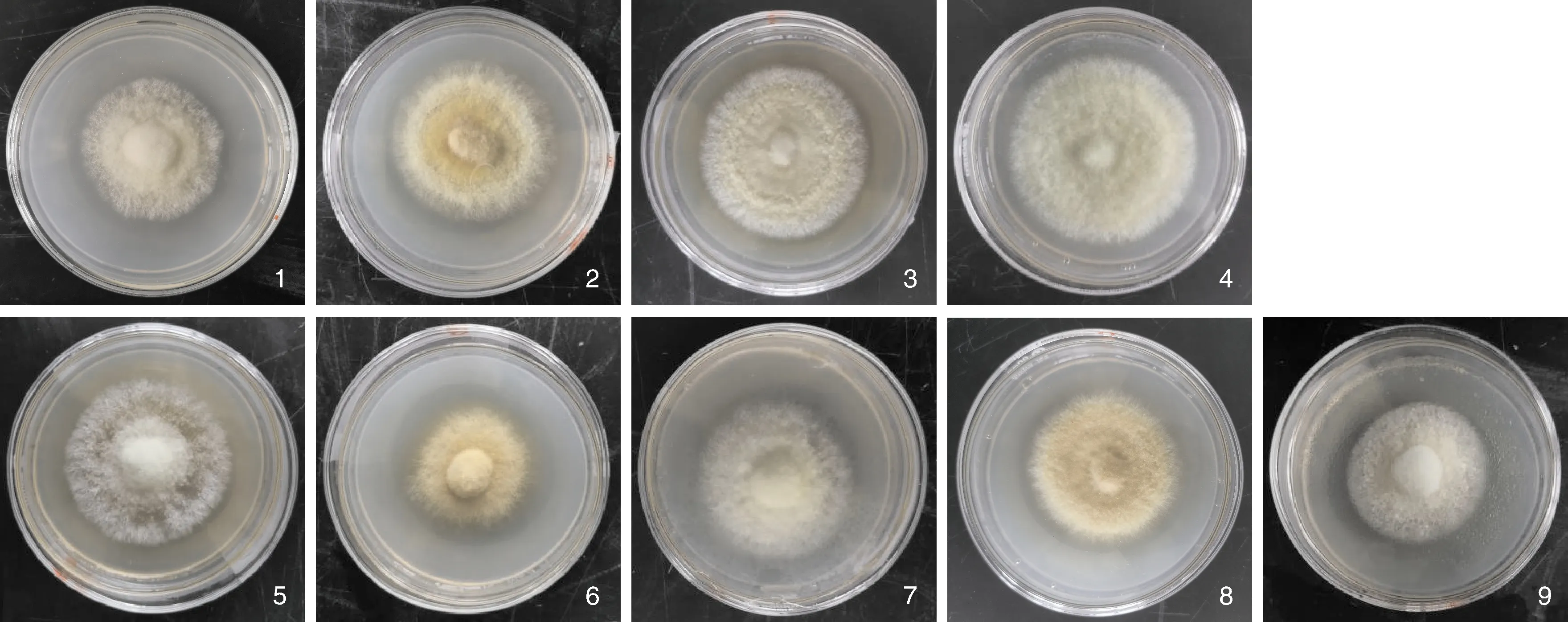
图6 正交试验9组设计菌落长势
3 结论与讨论
桑黄作为一种名贵且有效的药用真菌,以其显著的抗肿瘤功效,近年来越发被人们所重视,目前市场上的大部分桑黄分成两类,即桑树桑黄(Sanghuangporussanghuang)和杨树桑黄(Sanghuangporusvaninii),桑树桑黄目前还很难栽培,且只生长于活桑树上,由段木或袋料培养桑树桑黄子实体比较困难,目前市面上所谓的栽培桑黄子实体,大都是杨树桑黄[3]。目前,杨树桑黄药理成分及抗肿瘤功效已得到验证[18-19],其提取物的抗氧化能力也相对其他桑黄菌株较强[20],考虑其栽培容易,生产成本较低等特点,我们应认同且接受杨树桑黄在桑黄类药用真菌中的价值,并对其药用价值予以肯定。本研究对金寨县永福桑黄菌种植专业合作社栽培的桑黄鉴定为瓦宁木层孔菌(Sanghuangporusvaninii)即杨树桑黄,并以菌丝的生长速度和长势为指标,进行了单因素试验和正交试验,明确菌株JS-1最适的生长温度为28 ℃,最适pH为7,葡萄糖为碳源时菌丝生长速度以及菌落长势最好,在氮源的选择上观察了接种后培养20 d内菌丝长速及菌落长势情况,对比发现马铃薯浸汁为其生长的最适氮源。通过正交试验,以菌丝的长速为指标,得到最优的培养条件为葡萄糖20 g·L-1,马铃薯100 g·L-1,pH为8,培养温度为30 ℃,但是在实际培养当中发现当温度条件达到30 ℃的组合菌落的茂盛程度均较低,与单因素试验相一致,考虑该菌种对于温度较为敏感,在正交试验结果的基础上以28 ℃培养最为合适。本研究结果与其他已有报道的桑黄菌种培养条件存在一定的差异,可能是培养的菌株种类不同,且试验过程中不能单一的以菌丝的生长速度为指标,应结合菌落长势进行分析,吕英华等[21]针对裂蹄木层孔菌(Phellinuslinteus)的培养基配方进行了正交试验优化,认为玉米粉为其生长最适氮源,且生长浓密茂盛;曹春蕾等[22]对桑木层孔菌(Phellinusmori)进行研究发现,最适氮源为酵母浸膏,用淀粉为碳源时菌丝长速最快但菌落稀疏,以葡萄糖为碳源时长势最好;宋吉玲等[23]对桑树桑黄(Sanghuangporuesanghuang)通过正交试验研究发现可溶性淀粉为碳源蛋白胨为氮源在30 ℃条件下培养最适合,且没有提到30 ℃培养时菌落长势是否茂盛;可见,菌种不同其生物学特性也是各不相同的,且正交试验筛选出来的最优组合是在以菌丝生长速度为基础上筛选出来的,其菌落长势没有考虑进去,因此并不能确定为最优组合,在实际生产中要同时考虑菌丝长速以及菌落长势。

图7 不同温度处理后生长情况
综上所述,通过本研究优化了杨树桑黄的人工培养方法,为栽培杨树桑黄和提高其产量提供帮助,希望在将来能够将桑黄这一珍贵的药用真菌推广种植,为人类的大健康事业造福。
