氮沉降背景下土壤微生物对入侵植物乌桕叶绿素荧光特征的影响
2021-12-25方海富冯为迅罗来聪王佰慧ShadNasir魏启轩苏思思
方海富,冯为迅,罗来聪,高 宇,王佰慧,Shad Nasir,魏启轩,邹 瑜,苏思思,张 令
江西农业大学林学院,江西省森林培育重点实验室,江西特色林木资源培育与利用2011协同创新中心, 南昌 330045
生物入侵是一个全球性的问题,不仅对入侵地农林牧副渔生产造成经济损失和人类的健康造成伤害,而且也对生态系统的过程也造成一定的影响[1- 4]。在全球变化的背景下,当外来植物入侵到新的环境,可能会因为一些环境因子的改变,导致外来植物对环境的响应及适应机制发生变化,具有较强的入侵潜力。因而,生物入侵已经成为许多专家和学者关注的热点问题[5- 6]。
光合作用对植物的生长和繁殖至关重要,直接影响入侵植物的建群、扩散和成功入侵等过程[7]。叶绿素荧光特性与植物的光合作用密切相关,能够准确迅速地反映光合作用的能量转化过程。植物的叶绿素荧光参数可通过分析技术测得,能反映环境变化对光合作用的影响规律[8- 9],是决定产量和质量的重要因素,因而被视为揭示植物光合作用与环境关系的内在探针,成为研究作物光合生理的有力工具。几乎所有光合作用过程的变化都可通过叶绿素荧光反映出来,因此在国际上得到了广泛的应用。土壤微生物是影响植物入侵潜力和植物性能的重要因素[10- 11]。土壤共生菌(如根瘤菌,丛枝菌根真菌等)和拮抗菌(如病原菌)对植物的入侵性能有不同程度的影响[12]。入侵植物相比于本地植物具有较高的菌根结合力,这可能会影响土壤的理化性质[13]。入侵植物可能会逃脱土壤束缚的物种特有的敌人,在其自然范围内产生负面影响。因此,土壤杀菌处理可能会对入侵植物在其自然生长范围内的表现产生积极的影响[6]。近几年,有关植物荧光特性与其抗性生理[14- 15]及不同品种间和施肥调控对叶绿素荧光特征[16]比较的研究较多,但对入侵植物叶绿素荧光特征与土壤微生物调控的关系等方面的研究鲜有报道。
氮素是最为重要的环境养分之一,其含量的高低对植物的生长发育和新陈代谢具有重要作用;由于动植物繁衍和人类活动都会导致大气氮沉降加剧[17],对土壤氮素的水平显著提高。有相关研究表明部分入侵植物相比本地植物具有较强的氮吸收速率[18],因此氮沉降加剧可能会促进外来植物的入侵[19]。氮沉降对植物光合生理作用有很大的变化。孙群等[20]研究发现在水分胁迫下随着施氮的增加叶绿素含量增加。氮沉降加剧能够促进入侵植物薇甘菊的光合效率[21]。净光合速率随施氮量的增加而增大[22]。氮沉降会显著增大入侵植物叶绿素含量,对植物光合作用[23]和叶绿素参数[9]具有显著变化。因此开展氮沉降加剧和土壤微生物变化对入侵植物叶绿素荧光的影响的研究,对揭示全球气候变化背景下入侵植物响应和适应机制具有重要意义。
乌桕(Triadicasebifera)是大戟科乌桕属落叶乔木,原产于中国,是一种重要的工业油料树种,已有1400多年的栽培历史。18世纪末,为了发展蜡烛和肥皂产业及作为观赏树种,首次将乌桕引入美国,如今在美国东南部迅速蔓延并呈现出严重地生物入侵现象[24- 27]。乌桕入侵种群会使得更多的资源分配到地上部分,入侵乌桕相对于原产地乌桕种群在株高、叶面积、叶生物量和氮吸收能力及实际光能转化速率具有较强的优势[9,13,18,26,28- 30]。从而乌桕能入侵成功可能与生物和非生物因素有关,一些国内外学者通过原产地和入侵乌桕对氮沉降与微生物交互作用[26],UV辐射增强[31],氮沉降与UV辐射和土壤灭菌交互作用[28],施肥,盐度与土壤微生物交互作用[13],入侵植物防御策略演化对生物防治效果[27,32- 33]等相关研究。通过了解入侵种群和原产地种群乌桕在生物和非生物条件下形态学特征和生理学特征的变化,逐步探索出乌桕能成功入侵的主要原因,而生物抑制剂是否会影响植物胁迫生理叶绿素荧光参数的比较有待研究。
本研究采用盆栽模拟实验,通过模拟全球变化因子氮沉降加剧和土壤微生物(细菌和真菌抑制剂),观察原产地(中国)和入侵地(美国)乌桕种群叶绿素荧光参数的差异,拟解决以下3个科学问题:(1)探讨细菌和真菌抑制剂对乌桕叶绿素荧光变化的相对影响;(2)是否氮沉降加剧和土壤微生物相互作用于乌桕的叶绿素荧光变化; (3)不同处理组合对原产地和入侵地乌桕种群叶绿素荧光影响有何差异。
1 材料与方法
1.1 盆栽土壤采集

1.2 乌桕种子采集和育苗
2018年,在中国(原产地)和美国(入侵地)分别采集4个种群的乌桕种子,共8个种群(表1),每个种群的种子分别采集于5—6棵树。2019年4月份进行乌桕种源分类,育苗期间通过喷施蒸馏水使土壤保持湿润,等到六月底对乌桕幼苗进行移栽(40 d左右)。选择株高相近的乌桕幼苗,将乌桕幼苗移栽与对应的花盆(体积2 L,装填土壤质量:1.5 kg)中。
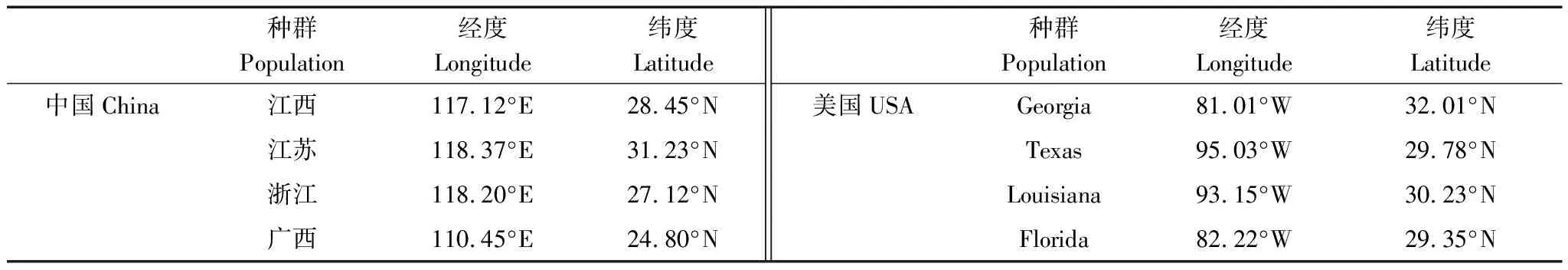
表1 不同乌桕种源地理分布信息
1.3 实验设计
实验采用嵌套设计,包含氮沉降(对照VS.硝态氮),细菌处理(对照VS.细菌抑制剂),真菌处理(对照VS.真菌抑制剂),种源(原产地VS.入侵地),种群为种源嵌套因子,重复4次,共2×2×2×6×4=192盆幼苗,施用KNO3溶液模拟8 g N/m2氮沉降,分两次施入,每次加入5 mL (相当于0.03 g N/kg土壤);细菌抑制剂使用浓度为3 g/kg链霉素处理[34],分两次施入,每次施入5 mL液体;真菌抑制剂使用浓度为1g/kg扑海因处理[34],分两次施入,每次施入5 mL液体。
1.4 实验方法

采用SPAD- 502 Plus叶绿素测定仪(KONICA MINOLTA,Japan)进行相对叶绿素含量(SPAD)测定,测定时选择每株植物中部完全展开的5—6个叶片,然后取平均值。采用PM2500调制叶绿素荧光仪(WALZ,Germany)测定叶绿素荧光参数。测定时,选择每株植物顶端第3—5片完全展开的叶片中的其中2片[35],具体指标测定操作如下:① 光系统II(PSII)的最大量子产率Fv/Fm=(Fm-Fo)/Fm:通过暗适应叶夹使样品经过充分的暗适应(至少30 min)后,累计在质体醌(PQ)处的所有电子都被传走,PSII的所有反应中心都处于开放状态,然后打开测量光(Measuring Light,ML),记录暗适应后的最小荧光Fo。测量光一般很弱(小于1 μmol m-2s-1),只激发色素的本底荧光但不足以引起任何的光合作用;紧接着打开一个持续时间仅为0.2—1.5秒的饱和脉冲(Saturation Pulse,SP),此时PSII处释放的电子迅速将PQ全部还原(电子门全部关闭),光化学反应被打断,全部转化为叶绿素荧光和热量,荧光迅速达到最大值Fm,记录暗适应后的最大荧光Fm;② PSII实际光合量子产率Y(II)=ΦPSII=ΔF/Fm′=(Fm′-F)/Fm′:在光照条件下进行光合诱导,在PQ处会累积电子,只有部分电子门处于开放态。此时给出一个饱和脉冲,本来处于开放态的电子门将本该用于光合作用的能量转化为了叶绿素荧光和热,此时得到的叶绿素荧光峰值为Fm′,而打开饱和脉冲之前记录的荧光值为F。在光化光照射下,只有部分电子门处于关闭态,因此实时荧光F比Fm要低,就会发生了荧光淬灭(quenching)。叶绿素荧光产量的下降(淬灭)可以由光合作用的增加引起,也可以由热耗散的增加引起。由光合作用的引起的荧光淬灭称之为光化学淬灭(photochemical quenching,qP或qL),由热耗散引起的荧光淬灭称之为非光化学淬灭(non-photochemical quenching,qN或NPQ)。③ 快速光响应曲线的测定:样品经过充分的暗适应后,依次开启光强度分别为1、7、41、141、277、510、873、1377、1963 μmol m-2s-1的光化光,每个强度的光化光照射时间为10s,使用PamWin- 3软件,采用Eilers和Peeters (1988)的公式进行快速光响应曲线的拟合,拟合公式如下:
相对电子传递速率(ETR)单位:μmol m-2s-1;光合有效辐射(PAR),单位:μmol m-2s-1;快速光曲线的初始斜率(α)潜在最大相对电子传递速率(ETRmax),单位:μmol m-2s-1;半饱和光强(Ik),单位:μmol m-2s-1。
1.5 数据处理
使用JMP 9.0(SAS Institute,Cary,NC,USA)软件进行四因子嵌套方差分析,将氮沉降、细菌和真菌抑制剂、种源作为固定因素,种群作为种源嵌套因子。多重比较采用Tukey法进行,采用Origin 2018绘图。
2 结果
2.1 相对叶绿素含量SPAD
与对照相比,氮沉降对SPAD具有极显著正效应(+7.04%)。在氮沉降条件下,与对照相比,细菌、真菌抑制剂以及它们之间的交互作用对SPAD均具有显著负效应(-10.78%, -7.35%, -1.69%);细菌和真菌抑制剂的交互作用与真菌抑制剂相比有显著正效应(+6.10%),与细菌抑制剂相比有正效应(+10.19%)。在细菌抑制剂条件下,氮沉降和真菌抑制剂的交互作用下与氮沉降相比具有著负效应(-10.19%),与真菌抑制剂相比具有显著正效应(+6.10%)。在真菌抑制剂条件下,氮沉降对SPAD具有显著正效应(+1.73%),氮沉降和细菌抑制剂的交互作用下与氮沉降相比具有显著负效应(-6.10%),与细菌抑制剂相比具有显著正效应(+10.19%)。原产地乌桕相比入侵乌桕具有较高的SPAD(+15.88%)(图1,表2)。
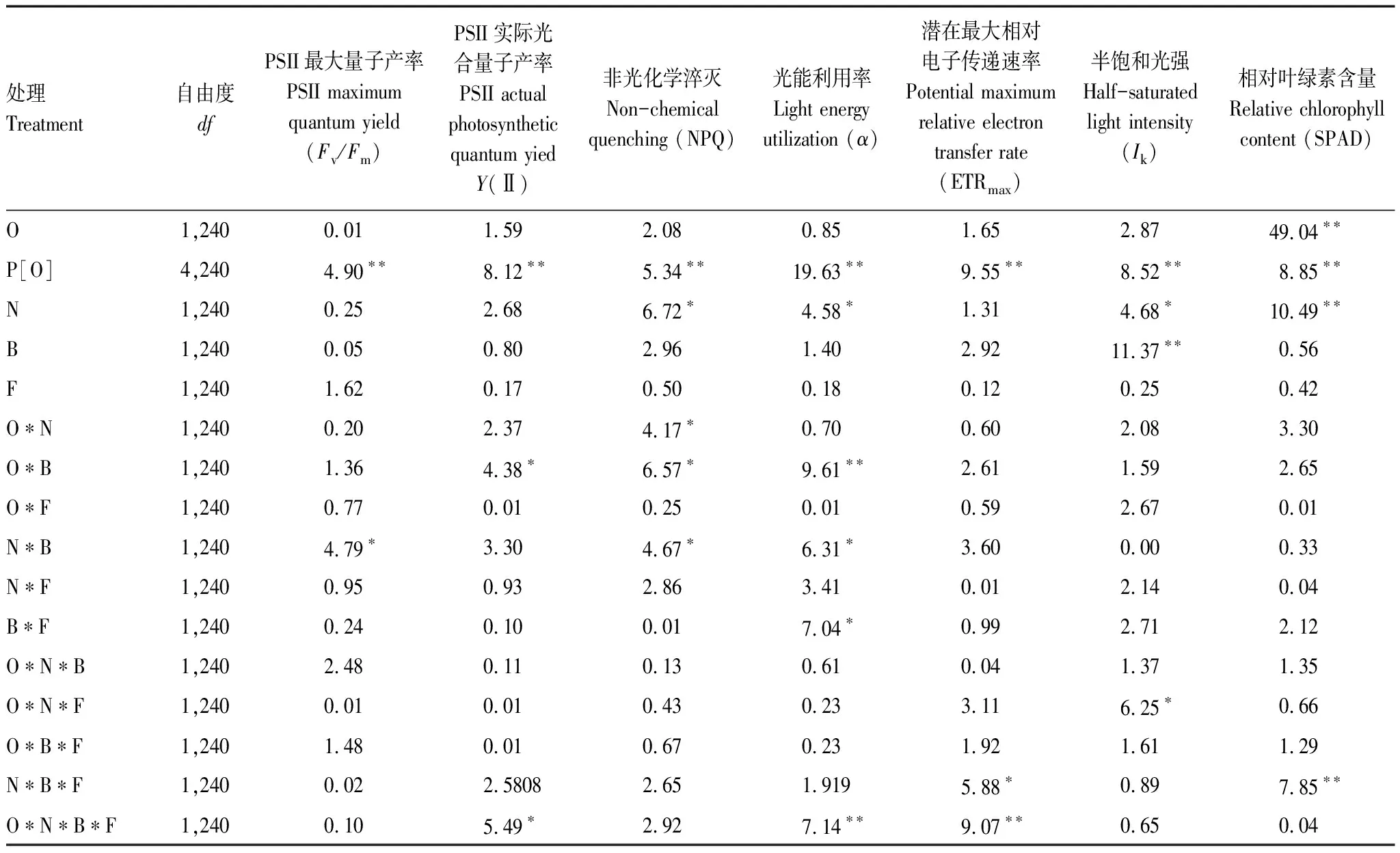
表2 氮沉降、细菌和真菌抑制剂对不同种群(种源)乌桕叶绿素荧光参数(Fv/Fm、Y(II)、NPQ、α、Ik、ETRmax)和相对叶绿素含量(SPAD)的影响方差分析

图1 氮沉降,氮沉降、细菌和真菌抑制剂,种源对乌桕相对叶绿素含量(SPAD)的影响(平均值±标准误) Fig.1 The dependence of relative chlorophyll content (SPAD) (mean±se) on nitrogen deposition, nitrogen, bacteria and fungus, Triadica sebifera origin(mean±se)Con:对照 Control;N:氮沉降 Nitrogen deposition;B:细菌抑制剂 Bacteria inhibitors;F:真菌抑制剂 Fungus inhibitors;Native, 原产地; Invasive, 入侵地;相同小写字母表示没有显著差异(P>0.05)
2.2 Fv/Fm、Y(Ⅱ)和NPQ
在Fv/Fm方面,与对照相比,氮沉降、细菌抑制剂以及它们之间的交互作用都具有显著正效应(+1.67%,1.41%,0.76%)。在NPQ方面,无论氮沉降还是细菌抑制剂对NPQ差异都不显著,但是氮沉降与细菌抑制剂的交互作用与对照、细菌抑制剂和氮沉降相比,都具有显著的正效应(+74.55%, +85.84%, +60.91%)。氮沉降对入侵乌桕NPQ差异不显著,而对本地乌桕NPQ存在显著正效应(+83.49%)。与对照相比,入侵乌桕与本地乌桕差异不显著,但是在氮沉降条件下,原产地乌桕与入侵乌桕相比存在显著正效应(+51.37%)(图2,表2)。
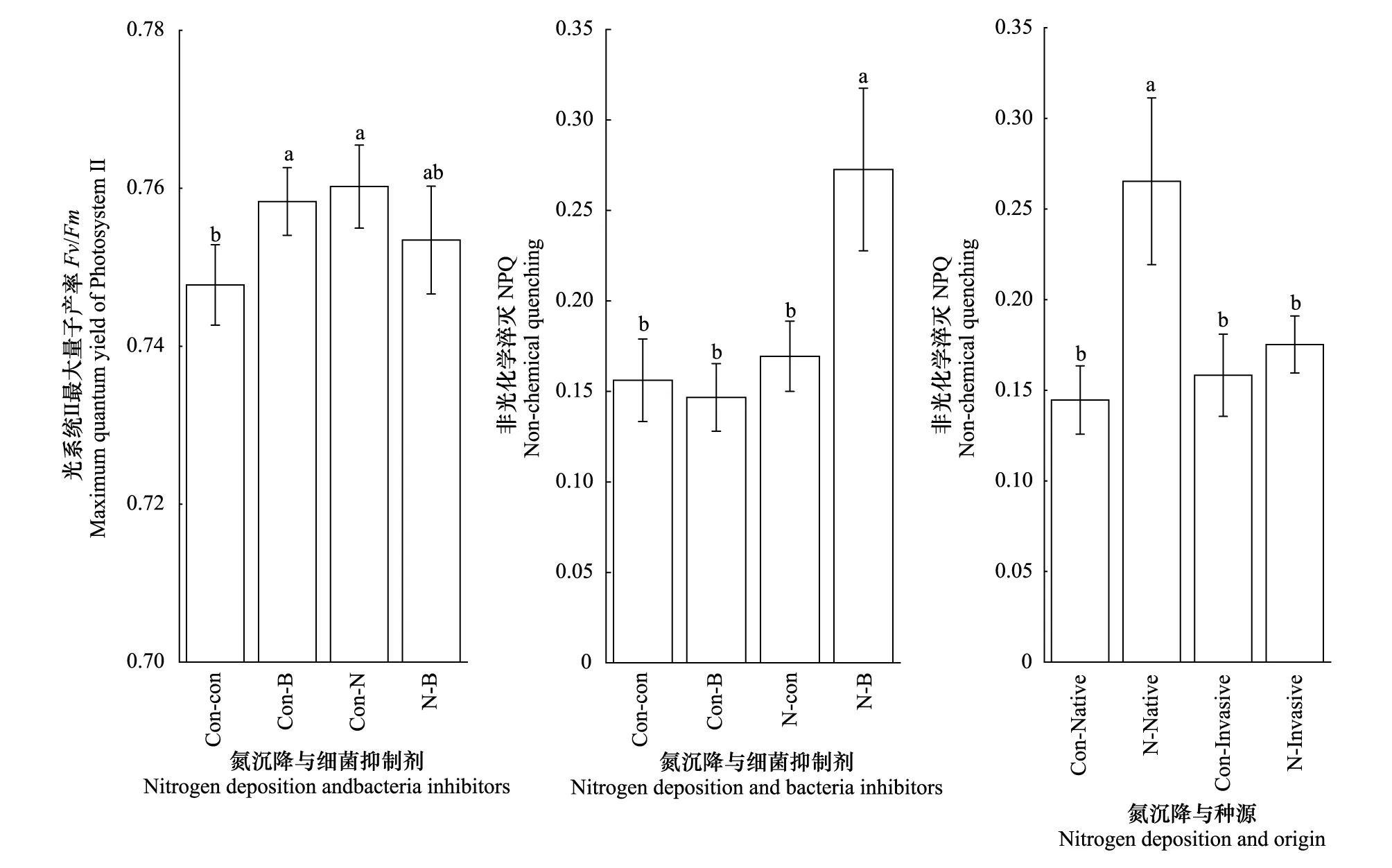
图2 不同处理对乌桕光系统Ⅱ最大量子产率(Fv/Fm),和非光化学淬灭NPQ的影响(平均值±标准误)Fig.2 Effect of different treatments on Fv/Fm and NPQ of Triadica sebifera (mean±se)
在Y(II)方面,主要受不同乌桕种群,细菌抑制剂和种源的交互作用,氮沉降、细菌和真菌抑制剂和种源的交互作用的影响(图3,表2)。细菌和真菌抑制剂对原产地乌桕具有显著正效应,细菌抑制剂和氮沉降的交互作用对原产地乌桕具有显著负效应。
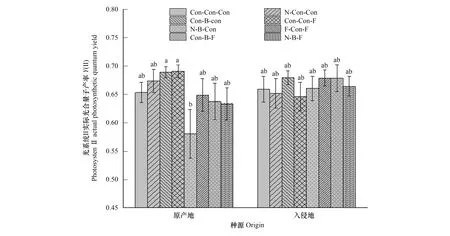
图3 不同处理对乌桕光系统Ⅱ实际光合量子产率Y(II)的影响(平均值±标准误)Fig.3 Effect of different treatments on Y(II) of Triadica sebifera (mean±se)
2.3 快速光响应曲线(α、Ik和ETRmax)
与对照相比,氮沉降、细菌抑制剂及它们交互作用对Ik均具有显著正效应(+9.85%,+15.52%,+25.95%)。在氮沉降条件下,细菌抑制剂对Ik具有显著正效应(+14.65%);在细菌抑制剂条件下,氮沉降处理对Ik具有显著正效应(+6.02%)(图4,表2)。与对照相比,入侵乌桕相比本地乌桕对Ik具有显著正效应(+4.06%);原产地和入侵乌桕在氮沉降作用下对Ik均具有显著正效应(+21.92%, +11.85%);原产地乌桕在真菌抑制剂作用下对Ik具有显著正效应(+27.81%),但入侵乌桕在真菌抑制剂作用下对Ik具有显著负效应(-9.28%);原产地和入侵乌桕在氮沉降与真菌抑制剂的交互作用下对Ik均具有显著正效应(+12.79%, +11.21%)。在氮沉降条件下,原产地与入侵乌桕相比对Ik具有显著正效应(+4.75%)。在真菌抑制剂条件下,入侵乌桕相比原产地乌桕对Ik具有显著负效应(-26.14%);在氮沉降与真菌抑制剂的交互作用下,原产地与入侵乌桕相比Ik没有显著差异(图4,表2)。
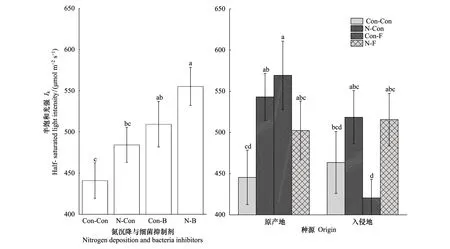
图4 不同处理对乌桕强光耐受力(Ik) 的影响(平均值±标准误)Fig.4 Effect of different treatments on IK of Triadica sebifera (mean±se)
在α方面,主要受不同乌桕种群,氮沉降,细菌抑制剂和种源的交互作用,氮沉降与细菌抑制剂的交互作用,细菌和真菌抑制剂的交互作用,氮沉降、细菌和真菌抑制剂和种源交互作用的影响(图5,表2)。细菌和真菌抑制剂的交互作用对原产地乌桕具有显著负效应。氮沉降与细菌抑制剂的交互作用对原产地乌桕具有显著负效应。细菌抑制剂对入侵乌桕具有显著正效应。

图5 不同处理对乌桕光能利用率(α)的影响(平均值±标准误)Fig.5 Effect of different treatments on (α) of Triadica sebifera (mean±se)
在ETRmax方面,主要受不同乌桕种群,氮沉降、细菌和真菌抑制剂的交互作用,种源、氮沉降和细菌与真菌抑制剂交互作用的影响(图6,表2)。氮沉降对原产地乌桕具有显著正效应。真菌抑制剂对入侵地乌桕具有显著负效应。

图6 不同处理对乌桕潜在最大相对电子传递速率ETRmax的影响(平均值±标准误)Fig.6 Effect of different treatments on ETRmax of Triadica sebifera (mean±se)
3 讨论与结论
3.1 氮沉降对乌桕叶绿素荧光特征的影响
氮沉降对乌桕叶片NPQ、Ik、α、ETRmax和SPAD都具有显著正效应(表2)。赵犇等[36]通过人为施氮可增加小麦叶片SPAD,张盼盼等[37]通过施氮可增加糜子叶片SPAD,郑翔等[9]通过施氮也增加乌桕叶片SPAD,均与本实验结果一致,这说明随着氮源的不断输入,促进叶片叶绿素含量上升,使得乌桕叶片SPAD值不断升高。氮沉降可以显著增加乌桕叶片NPQ、Ik、α和ETRmax,这可能是氮源的输入,为植物叶器官合成抗胁迫物质提供了大量的氮元素有关,增强对光的保护力,强光的耐受力,促进光能转化率和潜在最大相对电子传递速率。氮沉降对乌桕Y(II)没有显著差异,鲍海泳等[21]对入侵植物薇甘菊的研究表明,氮沉降对Y(II)无显著差异,与本实验结果相吻合。但是张绪成等[38]通过开顶式气室盆栽培养小麦实验发现施加氮肥能显著增加小麦叶片Y(II)。因此,氮沉降对植物Y(II)的影响可能与供试植物的归化程度和土壤氮水平的共同作用有关。
3.2 氮沉降与细菌抑制剂之间具有显著交互作用
与氮沉降相比,氮沉降与细菌抑制共同条件下,对NPQ和Ik都具有正效应,对α、SPAD具有负效应。Yang等[13]通过盆栽乌桕实验研究表明,施肥处理和土壤灭菌处理在总生物量、生长速率和根茎比方面存在显著的交互作用,说明氮沉降和土壤灭菌处理之间存在一定的显著交互作用,这可能是随着氮源的输入,土壤中氨氧化细菌和氨氧化古菌的丰度发生了改变,引起土壤微生物群落结构发生改变[39- 42]。在本实验中,细菌抑制剂链霉素具有内部保护、外部治疗和快速补充营养的功效,可抑制病菌细胞膜的形成,减缓氮源在植株中的活动,快速杀菌、快速补充营养、可在植株表面形成均匀细致的保护膜、治疗膜和营养膜,故对植株起一定的保护作用。因此在NPQ和Ik方面,氮沉降与细菌抑制剂会产生协同效应,促进对光的保护力和对强光的耐受能力。在α和SPAD方面,细菌抑制剂缓解氮沉降对光能的利用率和乌桕叶片相对叶绿素含量的影响。
3.3 不同乌桕种源与细菌抑制剂之间的具有显著交互作用
细菌抑制剂与不同乌桕种源在Y(II)方面具有显著交互作用。郑翔等[9]和Deng等[24]研究入侵乌桕相比于原产地具有较高的Y(II)。细菌抑制剂对入侵乌桕光能利用率(α)具有显著正效应。有相关研究结果表明入侵乌桕种群具有“地上优先”的分配策略和高耐性、低抗性的进化选择[28,31,43],与原产地乌桕种群相比具有较高的比叶面积、氮吸收速率和相对生长速率等特征[18,26]。邓邦良等[28]通过盆栽乌桕实验表明原产地乌桕相比于入侵乌桕更加依赖于原产地土壤有益微生物,入侵乌桕在一定程度上却摆脱了对原产地土壤有益微生物的依赖。因而,这可能是入侵地乌桕和细菌抑制剂具有协同作用,弱化了入侵地乌桕在Y(II)和α方面对原产地土壤微生物的依赖性。这表明在细菌抑制剂作用下,由于入侵乌桕相比原产地乌桕具有较好的生长优势,植株叶片能接收更多的光能、热能和具有更好的选择土壤有益微生物的协同互惠能力,增强入侵潜力,增强入侵乌桕叶片实际光能转化率和光能利用率。细菌抑制剂对原产地的功效弱于对入侵乌桕叶片的功效。研究结果与生物抗性假说一致,细菌抑制剂能缓解原产地乌桕光能利用率和光能转化率,这可能与相关基因诱导有关[44]。
3.4 氮沉降和真菌抑制剂与种源之间的交互作用
郑翔等[9]通过盆栽乌桕实验研究入侵乌桕相比与原产地乌桕具有较低的SPAD,与本实验结果相吻合,这可能与乌桕不同种源自身基因诱导有关。氮沉降与原产地乌桕种源和入侵地乌桕种源相比,在NPQ方面具有显著正效应,这可能与不同乌桕种源抵御氮元素的能力有关,从而氮沉降能增强原产地乌桕对光的保护能力。真菌抑制剂对原产地乌桕强光的耐受力具有显著正效应,对入侵乌桕强光耐受力具有显著负效应。真菌抑制剂对原产地乌桕Ik具有促进作用,入侵乌桕相比原产地更加会依赖于土壤有益微生物。增强了入侵乌桕在Ik方面对原产地土壤微生物的依赖性。入侵乌桕在入侵地会有选择性的增强和弱化与某些有益微生物的协同互惠能力,因此具有较强的入侵能力[28]。真菌抑制剂使原产地乌桕具有较强的耐受能力,可能与不同乌桕种源对真菌抑制剂的抵御和修复能力各异有关,也可能与乌桕不同种源自身基因诱导有关,真菌抑制剂能缓解入侵乌桕对强光的耐受力[44- 45]。
致谢:美国莱斯大学Evan Siemann教授河南大学丁建清教授、田宝良博士提供不同种群乌桕种子,特此致谢。
