环境低温对H9N2亚型禽流感病毒感染小鼠致病性的影响
2021-12-24张子卉连朋敬李静云李鸿儒
张子卉 贾 琪 连朋敬 李静云 徐 彤 白 玉 李鸿儒 乔 健*
(1.中国农业大学 动物医学院,北京 100193; 2.河北北方学院 动物科技学院,河北 张家口 075000)
H9N2亚型流感病毒作为传播最广的甲型流感病毒,其流行蔓延明显降低了家禽的生产效率,甚至跨宿主屏障感染人类。截止2019年6月,全球报道50例人类感染H9N2甲型流感病毒的病例,其中1999—2012年17例,2013年至今28例,呈近年上升趋势[1]。由于H9N2病毒感染人类的大部分病例症状较轻,可能尚存大量没有发现和报道的H9N2病毒感染病例。一项血清型调查发现,在某些禽类工作者群体中,H9抗体的阳性率高达15.5%[2]。在世界卫生组织(WHO)划定的流感预警分级标准中,H9N2病毒被认定为2~3级,其具有成为大流行毒株的潜力,因此,需要持续监测和研究[3]。
温带地区流行病学调查表明,甲型流感病毒的爆发具有季节性波动,在冬季发病率达到高峰[4]。有调查表明,在冬季,温带地区甲型流感导致的住院率和死亡率均大幅增长,冬季最高峰月份发病率甚至是夏季月份的2倍[5]。因此,一般认为甲型流感感染与冷暴露有关。一项观察足部急性降温效果的研究显示,在4~5 d中,有10%的人出现普通感冒症状,这表明寒冷与普通感冒有关[6]。Eccles[7]认为低温环境可使鼻子和喉咙的黏膜血管收缩,从而损害局部免疫反应,并使亚临床病毒感染发展为临床感染。但是低温环境促进病毒感染的假设是有争议的。因为某些研究表明,急性受冷后机体对呼吸道病毒感染的敏感性并未增加[6,8]。
有研究者认为,环境低温有助于流感病毒的存活、结构稳定以及传播[9-10]。也有学者认为环境低温会损害宿主抗病毒防御,促进病毒感染。小鼠在寒冷环境中经历一段时间后,病理检查可观察到气管上皮细胞的病理改变,如上皮增生和白细胞浸润等[11]。傅钰等[12]研究表明寒冷环境会通过损伤正常肺组织、改变肺部正常免疫功能以及造成肺部应激多个方面对肺部正常免疫功能造成损害。还有研究发现,低温使宿主对病毒的防御减弱,如降低呼吸道粘膜纤毛的摆动频率及通过抑制干扰素诱导的抗病毒反应降低宿主抗病毒天然免疫[4,13]。以小型哺乳动物为试验对象的研究表明,寒冷可能抑制免疫系统的一些细胞和体液成分[14]。然而,有关冷暴露对人体免疫功能影响的研究表明,寒冷并未降低免疫功能[15]。
综上所述,环境低温对病毒感染的影响存在争议,其潜在机制也未能完全阐明,需要进一步深入研究。环境低温对甲型流感的影响及其机制鲜有报道。因此,本研究通过H9N2病毒感染建立小鼠肺损伤模型,应用环境低温处理感染小鼠,观察感染小鼠发病14 天内的临床症状、存活率,肺脏病变程度、肺部细胞因子含量的动态变化以及肺脏病毒载量来探讨环境低温对H9N2病毒感染的影响,将有助于进一步了解甲型流感病毒的致病机理,进而采取有效的手段预防和治疗流感感染。
1 材料与方法
1.1 病毒
禽流感A/Chicken/Hebei/4/2008(H9N2)病毒,是本实验室2008年从河北地区某一养鸡厂—患病鸡群中分离所得。本实验室通过分离鉴定确定该毒株为低致病性的H9N2甲型流感病毒,命名为A/Chicken/Hebei/4/2008(H9N2)(登录号为FJ499463-FJ499470)。
1.2 试验动物
6~8周龄,18~22 g雄性SPF BALB/c小鼠,购自北京维通利华实验动物技术有限公司。
1.3 试验试剂
4%多聚甲醛购自北京化学试剂公司。无水乙醇、二甲苯以及中性树胶购自国药集团化学试剂有限公司。苏木精、伊红染液购自上海碧云天生物技术有限公司。小鼠TNF-α和IL-1β ELISA检测试剂盒,购自北京索莱宝科技有限公司。
1.4 试验设计及样本采集
BALB/c成年雄性小鼠随机分为4组:无感染常温组、无感染低温组、H9N2病毒感染常温组和H9N2病毒感染低温组,每组30只。本试验主要是通过在冬季开窗、关闭暖气、在鼠笼的周围放置冰袋来达到低温处理的要求,试验全程由温度计检测环境温度来保证低温处理的小鼠在温度(10±2) ℃的环境下饲养。将H9N2鸡胚尿囊液用无菌PBS稀释到106EID50。无感染常温组小鼠滴鼻接种100 μL 无菌PBS,置于(20±2) ℃的环境下饲养。无感染低温组小鼠滴鼻接种100 μL的无菌PBS,置于(10±2) ℃的环境下饲养。H9N2病毒感染常温组小鼠滴鼻接种100 μL的H9N2病毒稀释液,置于(20±2) ℃的环境下饲养。H9N2病毒感染低温组小鼠滴鼻接种100 μL的H9N2病毒稀释液,置于(10±2) ℃的环境下饲养(表1)。
每天在固定时间观察小鼠临床症状,监测小鼠体重和采食量的变化,观察并记录小鼠精神状态和死亡情况。在病毒感染后第2、5、7和14 天每组随机取5只小鼠,称重,麻醉后脱颈处死,采集肺脏并称重,计算肺系数(肺系数=肺湿重/体重×100%),观察记录肺脏大体病理变化。
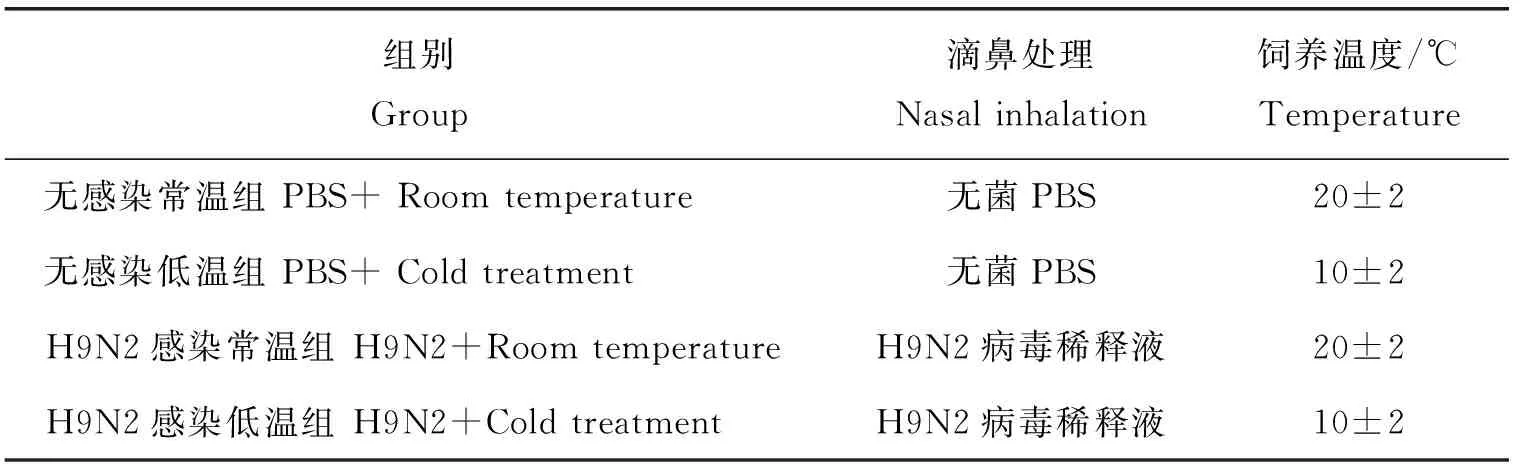
表1 试验分组设计Table 1 Experiment grouping design
1.5 肺组织病理切片的制作及HE染色
在病毒感染后第2和5天,采取各组肺组织,将肺组织在4%多聚甲醛溶液中固定一周后,经冲洗、脱水、透明、浸蜡、包埋、切片、展片、苏木素-伊红染色、封片步骤,制作组织切片并观察。
1.6 ELISA法测定肺组织匀浆中TNF-α和IL-1β的含量
在病毒感染后2和5天,采取各组肺组织,将肺组织在0.6 mL PBS中研磨,获得肺组织匀浆。并以5 000 r/min离心10 min,取上清进行检测。按照小鼠TNF-α和IL-1β ELISA检测试剂盒说明书操作,根据标准品数据在GraphPad Prism8上拟合曲线并计算待测样品含量。
1.7 肺组织病毒载量的测定
使用病毒噬斑测定法测定肺组织病毒载量。在病毒感染后2和5天,采取各组肺组织,将肺在1.1 mL PBS中研磨,并以10 000 r/min离心10 min以收集上清液。使用0.22 μm滤膜过滤上清液以去除细菌。使用重悬于含10%FBS的DMEM中的MDCK细胞,通过病毒噬斑测定法测定病毒滴度。将稀释的上清液添加到MDCK单细胞层中1 h。移除接种物,并将含有TPCK-胰蛋白酶(1 μg/mL)的低熔点1%琼脂糖的混合物添加至MDCK单细胞层上。72 h后,将板用4%甲醛处理20 min,然后移除琼脂糖。用2%结晶紫干燥噬斑15 min,然后计数病毒噬斑。PFU/mL=病毒噬斑数×稀释比。
1.8 统计学分析
所有试验数据均用平均值±标准差表示,采用GraphPad Prism8进行数据分析,并使用t检验分析两组间差异性,AVONA分析多组间差异性,P>0.05为显著不差异,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 不同温度处理的小鼠存活率及临床症状
无感染常温和低温组小鼠存活率均为100%,H9N2感染常温组小鼠在感染后第1天死亡1只小鼠,最终死亡率为95%。H9N2感染低温组在感染后第3和5天各死亡3只和2只小鼠,最终死亡率为67%(图1)。
与无感染常温组和低温组相比,H9N2病毒感染后,H9N2感染常温组和低温组体重均显著降低。感染后2~10 d中,H9N2感染低温组小鼠体重明显低于H9N2感染常温组。与无感染常温组小鼠相比,无感染低温组小鼠精神状态在低温处理后的前2天明显下降,但体重无显著变化(图2)。
感染后第2天后,2个病毒感染组小鼠均表现出明显的精神沉郁,被毛失去光泽,其中H9N2病毒感染低温组临床表现更为严重,多见小鼠消瘦、发抖、蜷缩和扎堆。感染后第7天,H9N2感染常温组小鼠体重及精神状态开始逐渐恢复,而H9N2感染低温组小鼠临床症状仍严重,直到感染后第10天,H9N2感染低温组小鼠体重及精神状态开始恢复。感染后第14天,各组小鼠体重及精神状态基本恢复正常。

图1 H9N2病毒感染后不同温度处理的小鼠生存曲线Fig.1 Survival curve of mice in different temperature after H9N2 virus infection
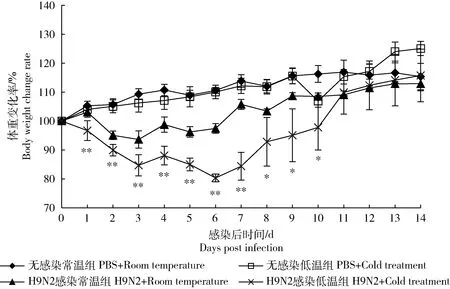
*表示H9N2感染低温组与H9N2感染常温组差异显著(P<0.05),**表示H9N2感染低温组与H9N2感染常温组差异极显著(P<0.01)。 * indicates the significant difference between H9N2+Cold treatment group and H9N2+Room temperature group. * indicates significant difference(P<0.05), ** indicates extremely significant difference between them (P<0.01).图2 H9N2病毒感染不同温度处理的小鼠体重变化Fig.2 Changes of mice body weight in different temperature after H9N2 virus infection
2.2 不同温度处理的小鼠肺脏病变及肺水肿程度
无感染低温组与常温组相比,小鼠肺脏无明显眼观病理变化。H9N2感染低温组与H9N2感染常温组相比,肺大体病变更为严重。尤其D7(感染后第7天)时,H9N2感染常温组小鼠肺脏表面仅有极少数淤血点和非常小面积的实变区域;而H9N2感染低温组的小鼠肺脏边缘钝圆、充血淤血严重,肺脏出现大面积的实变区域(图3)。
肺系数是反映肺水肿程度的重要指标。如图4所示,感染第5天后,H9N2感染常温组和H9N2感染低温组小鼠肺系数远高于无感染的常温及低温组。而且H9N2感染低温组的肺系数较H9N2感染常温组显著升高(P<0.05),在第7天极显著升高(P<0.01)。第14天时,H9N2感染常温组与H9N2感染低温组小鼠肺系数都降低,但仍高于无感染常温组,且H9N2感染低温组小鼠肺系数仍显著高于H9N2感染常温组(P<0.05)。
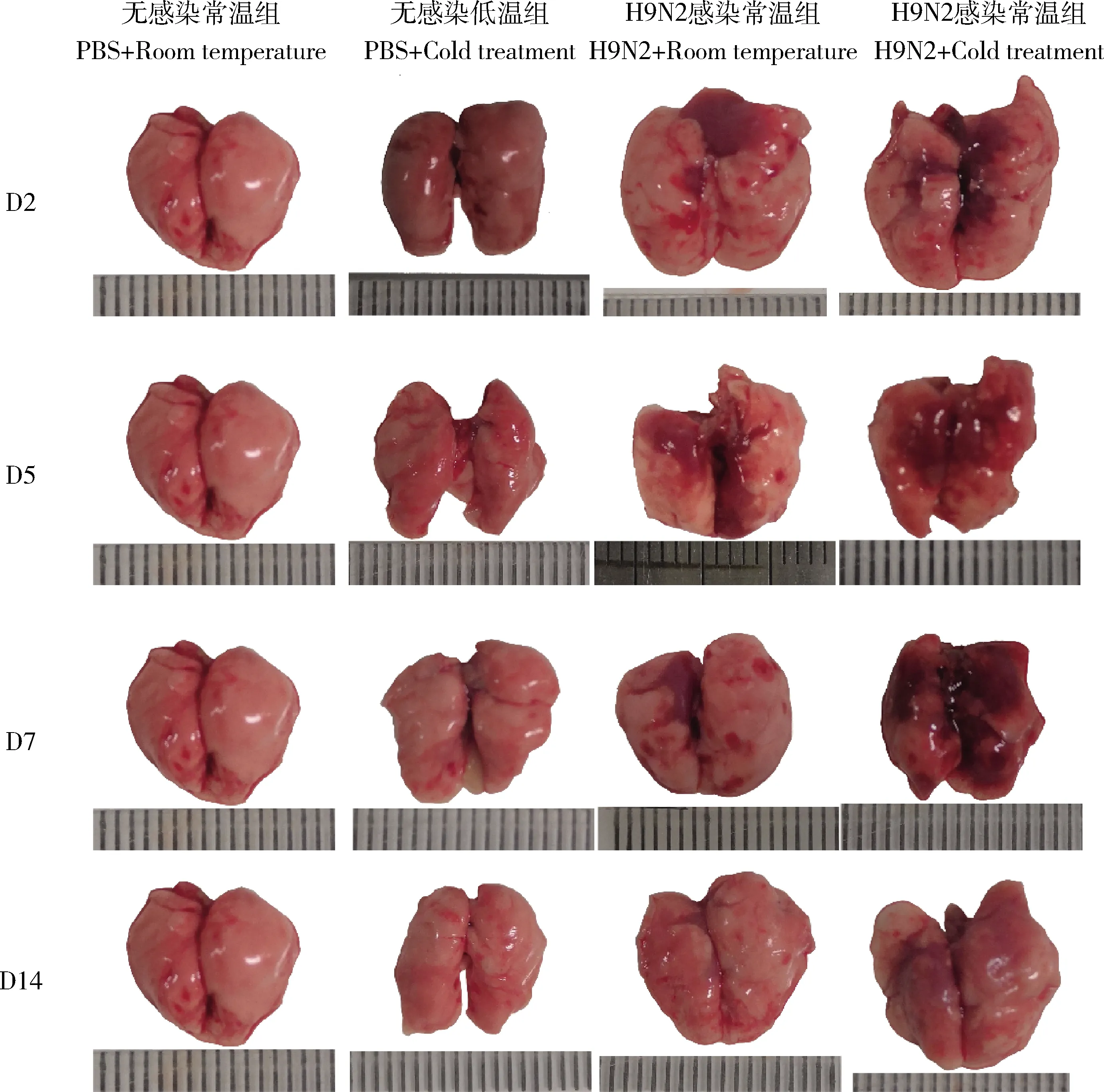
图3 H9N2病毒感染后不同温度处理的小鼠肺脏眼观大体病变Fig.3 Gross pulmonary lesions of mice in different temperature after H9N2 virus infection
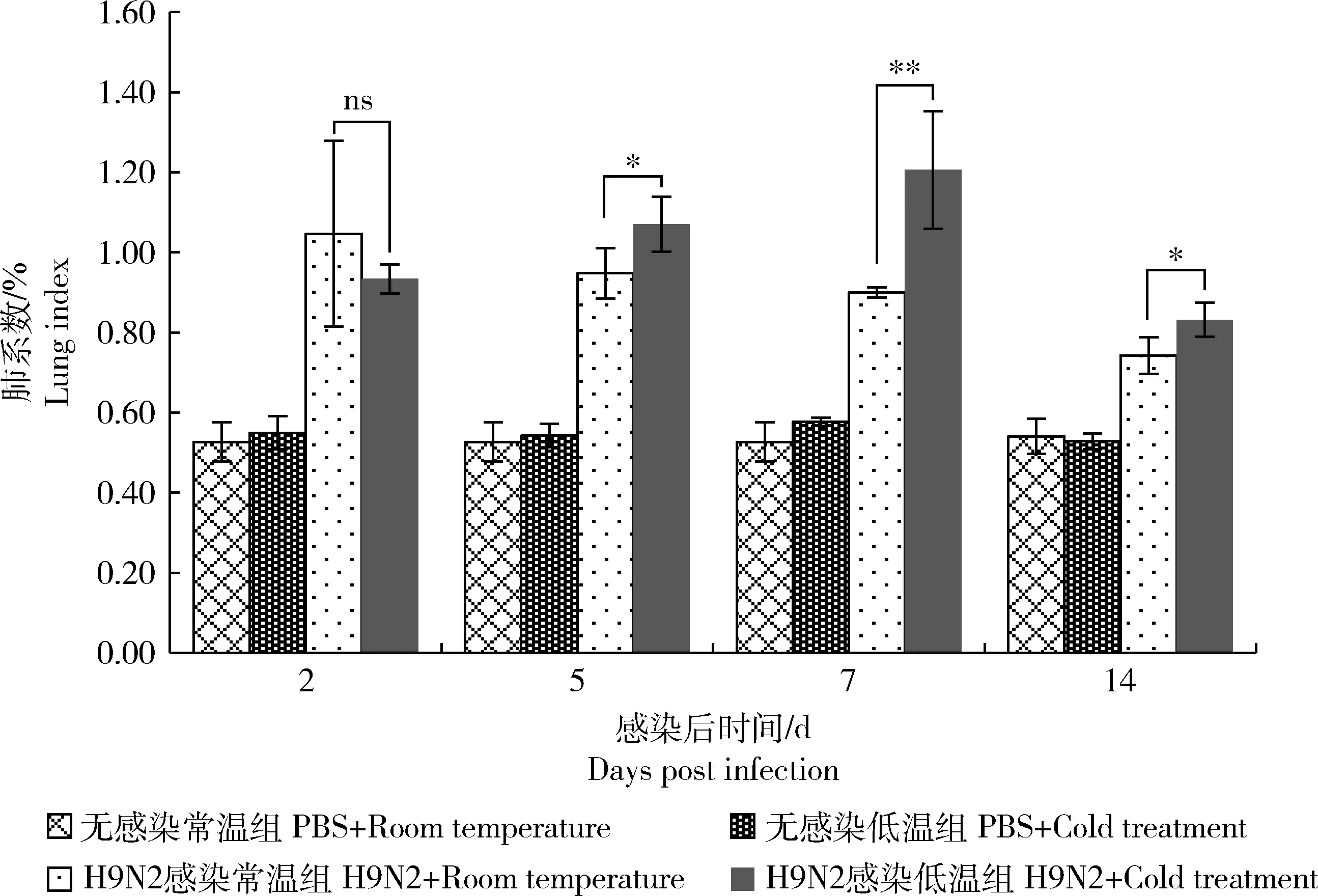
*表示差异显著(P<0.05),**表示差异极显著(P<0.01),ns表示无显著性差异。 * indicates significant difference (P<0.05), ** indicates extremely significant difference (P<0.01), “ns” indicates no significant difference.图4 H9N2感染后不同温度处理的小鼠肺系数Fig.4 Lung index of mice in different temperature after H9N2 virus infection
2.3 不同温度处理的小鼠肺组织病理学变化
在感染后第5天,无感染低温组小鼠肺泡壁轻微增宽,肺泡结构清晰(图5(b))。H9N2感染常温组小鼠肺泡正常结构丧失,毛细血管淤血,肺泡中大量中性粒细胞、淋巴细胞、巨噬细胞浸润,残留少量扩张的肺泡(图5(c));H9N2感染低温组小鼠肺泡正常结构完全丧失,肺部肺间质严重增宽,整个视野中充满渗出液,增宽的间质中大量的炎性细胞浸润,少量扩张的肺泡有残余(图5(d))。感染后第2 天的组织学结果与第5 天的结果趋势一致。

(a)无感染常温组;(b)无感染低温组;(c)H9N2感染常温组;(d)H9N2感染低温组 (a) PBS+Room temperature; (b) PBS+Cold treatment; (c) H9N2+Room temperature; (d) H9N2+Cold treatment图5 H9N2感染后第5天不同温度处理的小鼠肺脏病理切片(200×)Fig.5 Pathological changes of lungs from mice in different temperature on the fifth day after H9N2 virus infection
2.4 ELISA法测定不同温度处理的小鼠肺脏组织匀浆中TNF-α和IL-1β的含量
肺部细胞因子的水平一定程度上代表先天性免疫反应的水平。在感染后第2天和第5天,与无感染常温组相比,无感染低温组小鼠肺部 TNF-α 水平显著升高(P<0.05),H9N2感染常温组与H9N2感染低温组TNF-α浓度极显著升高(P<0.01)。而H9N2病毒感染的小鼠中,低温组与常温组小鼠肺部TNF-α水平无显著差异(P>0.05)(图6)。
与无感染常温组相比,无感染低温组小鼠在感染后第5天,肺部IL-1β水平显著增高(P<0.05),而感染后第2天未表现出显著差异。H9N2感染低温组与常温组小鼠肺部IL-1β水平均极显著高于无感染常温组(P<0.01),极显著高于无感染低温组(P<0.01)。而接受H9N2感染的小鼠中,低温组与常温组在所检测的两个时间点(感染后第2天和第5天),肺组织中IL-1β水平均无显著差异(P>0.05)(图6)。
2.5 不同温度处理的小鼠肺组织病毒载量的动态变化
病毒噬斑测定结果显示在H9N2病毒感染后第2天H9N2感染常温组和H9N2感染低温组小鼠肺组织病毒载量无显著差异,在感染后第5天H9N2感染低温组小鼠肺组织病毒载量显著高于H9N2感染常温组(P<0.01)。
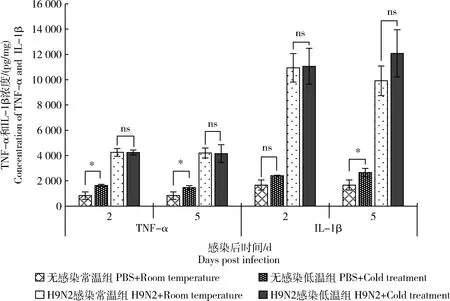
图6 H9N2感染后不同温度处理的小鼠肺部细胞因子的变化Fig.6 Changes of cytokines in the lungs of mice in different temperature after H9N2 virus infection
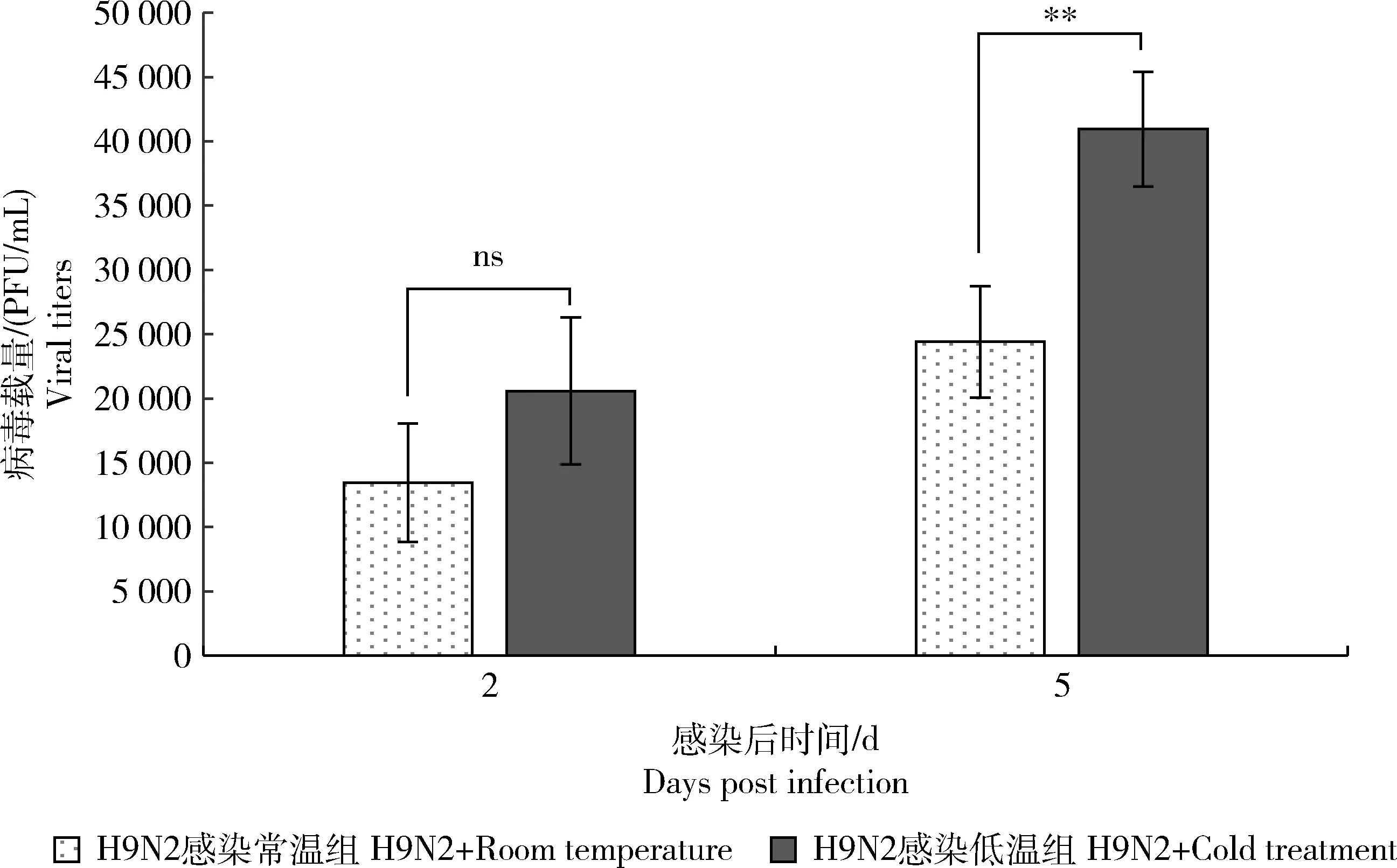
图7 H9N2感染后不同温度处理的小鼠肺部病毒载量Fig.7 Viral titers in the lungs of mice in different temperature after H9N2 virus infection
3 讨 论
研究表明,某些H9N2亚型流感病毒毒株可以诱导小鼠感染发病及呼吸窘迫综合征(ARDS)的发生[16-17]。在本试验中,通过鼻腔接种106EID50剂量的禽流感A/Chicken/Hebei/4/ 2008(H9N2)病毒,成功诱导BALB/c系小鼠呼吸窘迫综合征的发生,小鼠表现出体重下降、精神沉郁、被毛杂乱、呼吸困难等呼吸窘迫综合征的典型临床症状。病毒感染后5~7 d,小鼠临床症状明显,肺组织病变严重。病毒感染后第14 天,小鼠临床症状恢复,肺组织无明显病变。因此使用该毒株可以有效建立小鼠感染H9N2亚型流感病毒模型并模拟小鼠感染H9N2亚型流感病毒后从出现临床症状到恢复痊愈的过程。
关于低温和呼吸道病毒感染之间的关系,国际社会百年来一直争议不断。许多研究已经表明低温会加重呼吸道感染。Danielides等[18]对医疗记录进行了回顾性研究,结果表明,低温与急性喉炎的发生率增加有关。也有研究表明,低温会增加小鼠流感病毒感染的死亡率[19]。但一些观点认为,寒冷并不会增加病毒感染的几率[20]。有研究表明,使受试者在-12~15 ℃寒冷房间中暴露2~4 h[21]或者在32 ℃ 水浴中浸泡数小时[8],并未使人体对呼吸道病毒的易感性增加。本研究发现,与H9N2感染常温组小鼠相比,环境低温处理的H9N2病毒感染小鼠临床症状更为严重,病毒感染后5~7 d,H9N2感染常温组小鼠体重下降约5%,而H9N2感染低温组小鼠体重下降约20%。环境低温处理还致使H9N2病毒感染的小鼠存活率由95%降为67%,存活率大幅降低。肺脏组织学结果显示,环境低温处理的H9N2病毒感染小鼠肺脏病变程度更严重。这些结果均表明低温会加重H9N2病毒对小鼠的致病性。
本研究发现,与无感染常温组相比,无感染低温组小鼠肺泡壁增厚,肺组织中TNF-α和IL-1β显著增加。这可能是由于低温处理引起小鼠机体发生氧化应激,损害了健康组织[22]。同时,应激反应会增加促炎性细胞因子分泌,进一步损伤健康组织[23]。接受H9N2病毒感染的常温小鼠与低温小鼠肺组织中细胞因子TNF-α和IL-1β无显著差异,提示可能是这两种细胞因子并没有在低温加重的炎症反应中发挥较大的作用,可能存在其他细胞因子导致低温组小鼠炎症反应加重。细胞因子网络错综复杂,需要更广泛地鉴定可能在其中起作用的细胞因子。
感染后第5天,H9N2病毒感染低温组相比于H9N2病毒感染常温组病毒载量显著增加,提示低温条件下病毒在宿主体内复制能力增强。低温可能通过影响病毒和宿主,共同促进病毒复制能力的增强,进而加重流感发病程度。低温条件可促进脂质在病毒膜上的排列,有助于流感病毒颗粒的稳定性[10];还可增加流感病毒在流感传播模型豚鼠中的传播性[9]。黏膜纤毛清除机制是消除呼吸道上皮表面吸入的病原体和刺激物的关键机制。面对气道的黏膜层会捕获微粒和微生物,将含微生物体和颗粒的粘液向小鼠的鼻子外侧移动和移向人类的喉部,吞咽或吐出粘液捕获的微粒和微生物。低温使宿主呼吸道中粘蛋白分泌增多、黏膜纤毛摆动频率增加,使黏膜纤毛清除机制受损[4];低温还使宿主的抗病毒先天免疫减弱,Foxman等[13]发现支持鼻病毒复制的小鼠气道上皮细胞在鼻腔较冷温度下,RIG-I受体依赖性的干扰素分泌较少,抗病毒防御应答降低,使病毒在鼻腔更有效的复制。同时,低温导致的机体应激反应损伤健康的肺组织,进而使病毒在肺部更有效的复制。具体到该试验当中,环境低温加重H9N2病毒感染对小鼠致病性的原理还有待进一步的研究。
在甲型流感导致的急性肺损伤模型中,很少有关于低温作为刺激因素的研究。本研究发现低温会加重H9N2亚型流感病毒感染小鼠的严重程度,对进一步揭示流感与环境的关系具有参考价值,将有助于采取科学有效的措施预防和治疗甲型流感感染,进而大大改善健康状况和生活质量。
