基于HPLC-RID的花生籽仁可溶性糖含量检测方法的建立
2021-12-24李威涛郭建斌喻博伦徐思亮陈海文龚廷锋罗怀勇陈玉宁周小静陈伟刚姜慧芳
李威涛 郭建斌 喻博伦 徐思亮 陈海文 吴 贝 龚廷锋 黄 莉 罗怀勇 陈玉宁 周小静 刘 念 陈伟刚 姜慧芳
中国农业科学院油料作物研究所 / 农业农村部油料作物生物学与遗传育种重点实验室, 湖北武汉 430062
花生(Arachis hypogaeaL.)是我国重要的油料作物和经济作物。花生籽仁富含蛋白质、脂肪、碳水化合物、维生素、白藜芦醇、矿物质、植物营养素等[1], 深受人们喜爱。随着生活水平的提高和营养科学的发展, 其较高的营养价值将会不断的通过科学试验被确认[2]。目前, 我国花生产量的 50%~60%用来榨油, 约 30%是食品工业的重要原材料[3]。国外对花生的利用与我国有很大的差别, 特别是美国和欧盟各国, 其花生总产的 70%~90%以上用于食用及食品加工[4]。近年来, 我国花生食品加工业发展迅速,食用花生的需求也呈逐年上升趋势[5]。食用花生品质评价重要因素之一是口味, 包括甜度、香味、脆度、柔嫩度、细腻度、异味6个指标, 它直接影响花生的食用体验及经济价值[3]。其中甜度与籽仁中的可溶性糖含量紧密相关,可溶性糖主要有果糖、葡萄糖和蔗糖。研究表明, 甜度与花生籽仁的口味品质相关系数达 0.88, 花生籽仁中蔗糖含量达到 5%以上时, 口感较好[6]。目前, 我国关于食用型花生品种的培育及与之相关的品质性状研究进展缓慢,尚未形成食用花生品种专用化[3]。对花生资源及育种后代材料进行可溶性糖含量快速准确测定, 一方面可以选育可溶性糖含量高的后代, 培育口感好的新品种, 提高育种的效率; 另一方面还可以将鉴定到的可溶性糖含量高和低的材料构建群体, 对花生籽仁中可溶性糖含量的积累机制进行深入的研究, 定位相关主效 QTL, 进而克隆基因并开发分子标记, 为甜花生高效的分子育种奠定基础。
目前花生籽仁中的果糖、葡萄糖和蔗糖含量多采用比色法测定, 如3,5-二硝基水杨酸比色法、菲林试剂比色法等[6]。比色法检测效率较低, 难以大规模应用, 而且比色法检测糖含量的准确性低, 重复性差[7-8]。近年来也出现了应用红外光谱法测定花生籽仁中的蔗糖含量, 虽可快速检测蔗糖含量, 但需要复杂的前期工作, 需要先测出大量样品的蔗糖含量来建立模型[9-11]。对蜂蜜[7-8]、洋葱[12]、甘蔗[13]等的研究结果表明, 高效液相-示差折光法(HPLC-RID)可以同时分析样品中果糖、葡萄糖和蔗糖的含量, 且检测的准确性高, 前期样品处理也简单, 可大规模高效测定样品中的可溶性糖含量。有关利用HPLC-RID快速测定花生可溶性含量的应用尚未见系统报道。本研究以花生为材料, 建立了利用 HPLC-RID快速测定花生籽仁中可溶性糖含量的方法, 旨在为花生资源可溶性糖含量的快速检测及食用型花生高效育种奠定基础。
1 材料与方法
1.1 试验材料
本试验选用20份花生品种, 其基本信息见表1。花生荚果收获晒干后剥壳, 选取成熟饱满、无发芽、无破损、无病斑的籽仁为试验材料。

表1 试验所用花生样品Table 1 Peanut samples used in the study
1.2 样品处理条件探索
将30粒花生籽仁样品用粉碎机碎成粉末, 过20目筛,称量1 g样品至50 mL离心管中, 加一定量(10、15和20 mL)80%乙醇(乙醇∶水 = 80∶20)[14], 混匀后置于80℃水浴锅中水浴, 期间每隔10 min混匀1次, 结束后冷却至室温,取上清液1.5 mL至2.0 mL离心管中, 12,000×g离心5 min, 然后用0.45 μm滤膜将样液过滤入样品瓶中供液相色谱测定。
1.3 色谱条件
本研究在杨成聪等[15]方法的基础上, 略有调整, 选择流动相中乙腈和水的体积比为75∶25, 流速0.8 mL min-1,进样量10 μL, 检测器和色谱柱温度均为40℃, 进行色谱分析。
1.4 蔗糖含量的计算
蔗糖含量(mg g-1) = 测定的糖浓度(mg mL-1)×提取液体积(mL)。根据测定峰面积和标准曲线计算获得测定的糖浓度。
1.5 重复性、精密度和加标回收率试验
多次重复取样, 按照1.2 (20 mL 80%乙醇)和1.3所述方法测定含糖量, 根据测定结果计算相对标准偏差(relative standard deviation, RSD)考察样品重复性。对色谱分析样品连续进样多次, 测定可溶性糖含量, 通过计算测定结果的RSD考察试验的精密度。按照1.2 (20 mL 80%乙醇)方法制备样品, 依次加入不同体积的80%乙醇和糖储备液, 按照1.3方法测定可溶性糖含量, 通过计算加标回收率考察试验的准确性。加标回收率的计算公式如下:P=(c2-c1)/c3×100%, 其中P为加标回收率,c2为加标后测定可溶性糖浓度(mg g-1),c1为不加标测定的浓度(mg g-1),c3为加标量(mg)。
1.6 国标法测定花生籽仁中的可溶性糖含量
参照国标法(GB 5009.8-2016)中脂肪大于10%的食品的处理方法制备样品, 利用高效液相色谱法测定可溶性糖含量。
2 结果与分析
2.1 标准曲线的绘制
通过材料与方法1.3确定的色谱条件检测蔗糖标品发现, 基线平稳, 果糖和葡萄糖可以很好的分离(图1-A)。分别取葡萄糖、果糖和蔗糖分析纯2.5 g, 在80℃烘箱中烘干至恒重, 分别准确称取烘干后葡萄糖、果糖和蔗糖2.0 g至100 mL容量瓶中, 加80%乙醇90 mL, 超声助溶, 然后定容至100 mL, 配制成20 mg mL-1的糖储备液, 4℃保存,按照表2配制标准液。以标准液浓度为横坐标, 样品峰面积为纵坐标绘制标准曲线, 得回归方程, 葡萄糖y1=92225x–13864,R² = 0.9991; 果糖y2= 81506x+10534,R² =0.999; 蔗糖y3= 91367x+2270.2,R2= 0.9991。说明葡萄糖、果糖和蔗糖浓度在0.5~6.5 mg mL-1之间线性关系良好。

表2 蔗糖标准液的配制Table 2 Preparation of sucrose standard solution
2.2 样品处理时间和提取液体积对测定结果的影响
将花生籽仁磨成粉末后, 分别加入10、15、20 mL的80%乙醇提取液, 分别在80℃水浴锅中水浴30、35和40 min, 测定不同条件下的果糖、葡萄糖和蔗糖含量。在花生籽仁(中花12)中只检测到蔗糖的存在, 果糖和葡萄糖没有检测到(图1-B)。进一步对其他花生品种(徐花13、中花6号、中花21、中花9号等)的籽仁进行检测, 仍然是只有蔗糖, 没有检测到果糖和葡萄糖。对不同处理中花12籽仁蔗糖的测定结果(表3)进行方差分析表明, 提取液的体积和水浴时间对蔗糖测定的结果影响不显著(表4)。由于10 mL 80%乙醇, 水浴30 min比较经济, 而且快速, 因此, 本试验选择10 mL 80%乙醇, 水浴30 min作为后续试验条件。
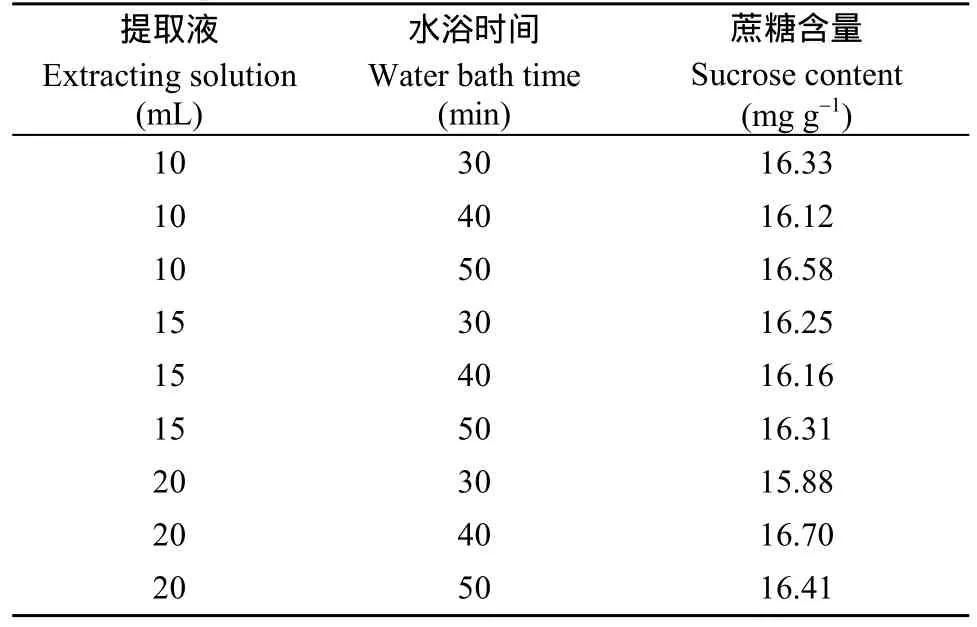
表3 不同处理时间和提取液体积下的蔗糖含量Table 3 Sucrose content under different treatment time and extraction liquid
2.3 方法的准确性验证
2.3.1 方法的精密度试验 将中花12籽仁研磨成细粉后, 按照1.2和2.2确定的样品处理方法处理样品, 然后对待测的同一样品连续进样10次, 测定峰面积, 并通过标准曲线计算蔗糖浓度, 通过1.4所示公式计算蔗糖含量, 进而计算相对标准偏差(RSD)考察测定的精密度, 得出蔗糖的RSD为0.59%, 精密度良好(表5)。
2.3.2 方法的重复性试验 对中花12花生籽仁重复取样6次, 按照1.2和2.2确定的样品处理方法处理样品, 然后测定峰面积, 通过标准曲线计算蔗糖浓度, 通过1.4所示公式计算蔗糖含量, 进而计算相对标准偏差(RSD)考察测定的精密度, 得出蔗糖的RSD为0.73%, 该方法的稳定性良好(表6)。
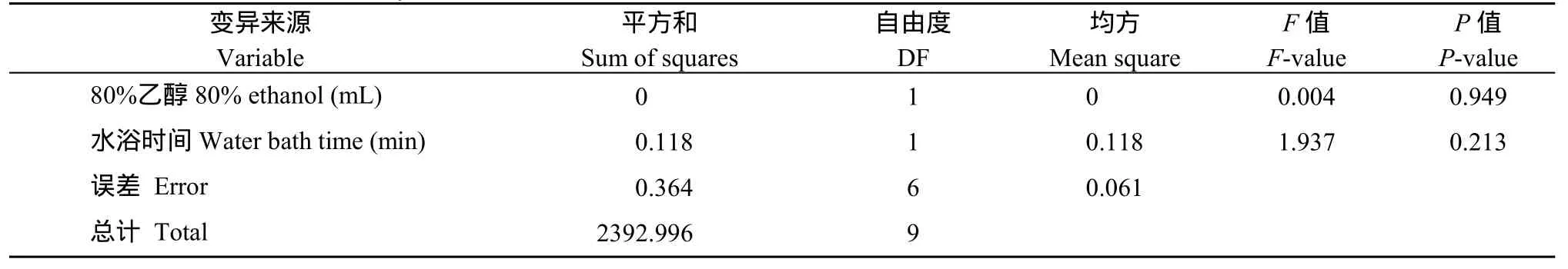
表4 方差分析结果Table 4 Results of ANOVA analysis
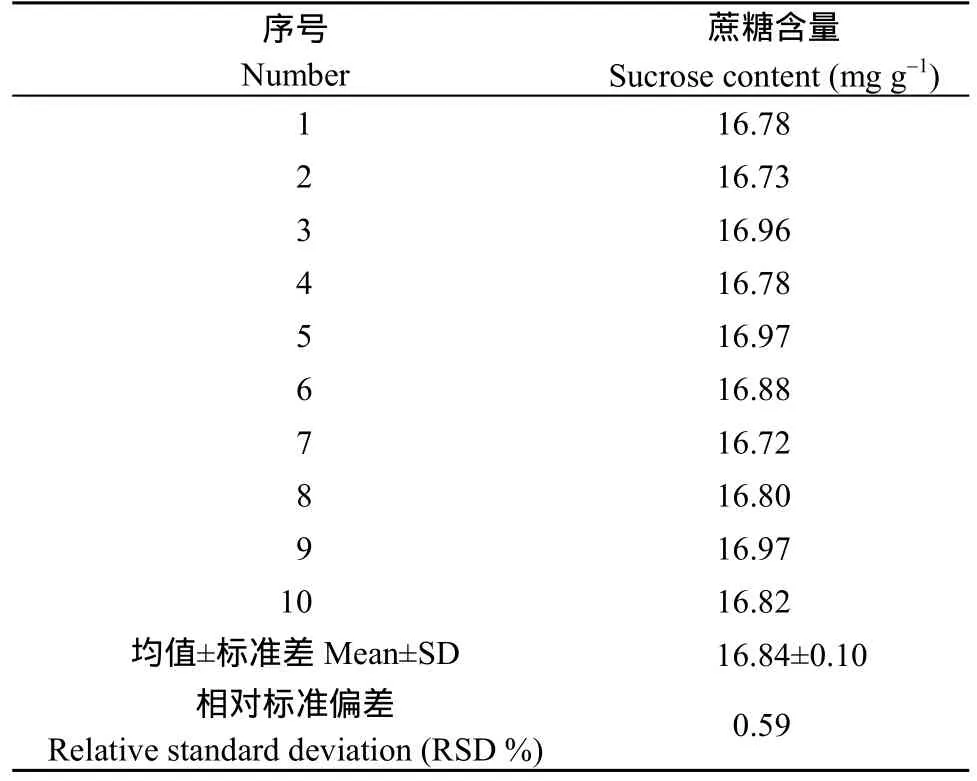
表5 精密度试验结果Table 5 Results of precision test

表6 重复性试验结果Table 6 Result of repetitive test
2.3.3 加标回收率试验 将中花12籽仁研磨成细粉,过20目筛, 称取1 g至编号为1~4的50 mL离心管中, 依次加入80%乙醇20、19.5、19和18.5 mL, 然后在2~4号管中分别加0.5、1.0和1.5 mL糖储备液, 然后按照1.2的方法提取可溶性糖并制备供色谱分析的样品, 并按照1.3的色谱条件测可溶性糖含量, 通过计算加标回收率考察试验的准确性。结果显示加标后的平均回收率为97.6% (表7), 表明该方法准确可靠。
2.4 HPLC-RID和国标法测定蔗糖含量的结果比较
以本实验室20份花生品种为材料, 用HPLC-RID法测定的蔗糖含量最高的品种为冀花甜1号 [(83.81±0.59) mg mL-1], 其次为冀9402 [(60.26±0.90) mg mL-1], 最低的为中花12 [(16.19±0.20) mg mL-1], 其次为豫花9805[(16.58±0.44) mg mL-1](表8)。通过国标法测定的蔗糖含量最高的品种为冀花甜1号 [(81.38±3.67) mg mL-1], 其次为冀9402 [(59.52±1.73) mg mL-1], 最低的为豫花9805[(15.60±0.75) mg mL-1], 其次为中花12 [(17.39±0.73) mg mL-1](表8)。由此可见, 2种方法鉴定出的蔗糖含量高和低的材料一致。将2种方法的测定结果进行相关性分析, 其相关系数为r= 0.99, 表明2种方法测定结果的相关性很高。另外, 经过配对样本T检验分析可知,t= 0.774,P=0.448 > 0.05, 表明2种方法所测结果差异不显著。综上所述,HPLC-RID可以作为花生种子中蔗糖含量测定的有效方法。
3 讨论
花生是我国传统的油料作物, 近年来品质相关性状研究工作主要集中在含油量[16-21]、脂肪酸[22-26]和蛋白质[27-31]上, 而有关花生籽仁中含糖量的研究鲜有报道。对花生品质的研究结果显示, 甜度与花生的口味紧密相关[6],而甜味来源于花生籽仁中的可溶性糖(果糖、葡萄糖和蔗糖)。先前的研究结果显示, 花生籽仁中存在果糖、葡萄糖和蔗糖, 且蔗糖是最主要的糖[32-37]。也有研究结果显示,花生籽仁中主要含蔗糖, 而果糖和葡萄糖是在样品处理过程当中产生的[14]。其测定结果的差异主要是由于样品的不同处理方式造成的, 本方法采用80%乙醇(乙醇∶水= 80∶20) 80℃水浴30 min抽提花生籽仁中可溶性糖, 不会改变真实的糖成分及含量, 其结果显示中花12成熟的花生籽仁中主要含蔗糖, 而果糖和葡萄糖并未检测到。利用本研究摸索得到的条件对本实验室其他花生品种徐花13、中花6号、中花21、中花9号等进行糖含量的测定, 结果也显示籽仁中只检测到蔗糖。其原因可能是成熟花生籽仁中果糖和葡萄糖的含量极小, 不能有效的被检测。将未成熟的花生籽仁研磨成粉后, 利用该方法可同时检测到果糖、葡萄糖和蔗糖的存在, 因此该方法可以有效地测定花生籽仁中3种可溶性糖的含量。综合前人研究结果和本研究的结果, 蔗糖是花生籽仁中最主要也是含量最高的可溶性糖。其含量是影响花生口味的重要因素, 含量越高,口感越好。
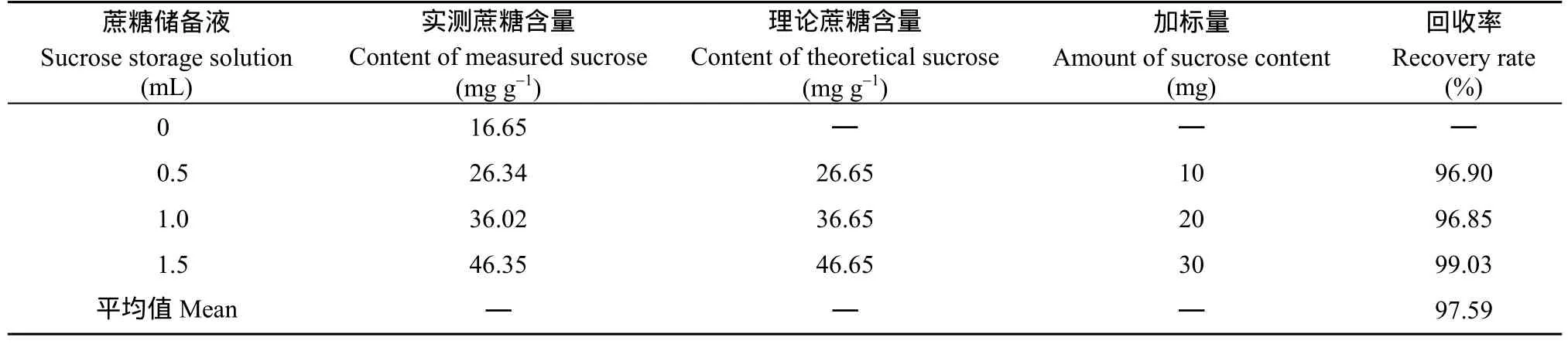
表7 加标回收率试验结果Table 7 Results of spike recovery test
检测花生籽仁中可溶性糖含量的方法有很多种, 如比色法、气相色谱法、高效液相法。其中比色法步骤繁琐且准确性较差[7-8]。气相色谱虽然也可以测定不同糖的含量, 但是测定过程含将样品置于三氟乙酸中加热到70℃的转化步骤, 这会导致部分低聚糖的降解, 导致检测的结果与实际籽仁中糖的含量有明显差别, 得出不符实际的结论[14]。近年来红外光谱技术也在花生籽仁中含油量[38]、脂肪酸[39-41]、蛋白质[42]和糖含量[6]的测定得到了应用, 但测定之前需要根据参试样品建立模型, 一旦建模完成, 也可以对大量育种材料进行可溶性糖含量的测定, 测定精度能满足育种工作需要。利用国标法测定可溶性糖的样品需要经过石油醚(沸程30~60℃)除去其中的油脂、蒸干、加水溶解以及乙酸锌和亚铁氰化钾溶液沉淀蛋白质等复杂的处理步骤, 导致样品测定效率较低。
本研究利用HPLC-RID建立了花生籽仁中果糖、葡萄糖和蔗糖的快速测定的方法。选择提取温度80℃, 以水浴时间和80%乙醇的体积为变量, 以测定的可溶性糖含量为指标, 探索出最佳的水浴时间为30 min, 提取液体积为10 mL, 在该条件下, 花生籽仁中的可溶性糖能完全溶解在80%乙醇中。HPLC-RID检测可溶性糖一般用乙腈和水的混合溶剂作为流动相, 乙腈和水的比例变化会影响出峰时间和峰信号。乙腈在流动相中的比例增大可有效改善色谱峰形, 有利于果糖、葡萄糖和蔗糖的基线分离, 但糖在乙腈中的溶解度很小, 乙腈比例增大不利于糖的溶解,各组分出峰时间也显著延长, 且峰信号较弱; 当增加流动相中水的比例时, 各组分出峰时间缩短, 峰信号增强, 但水的比例过大会造成果糖和葡萄糖基线不能分离, 影响结果[43]。流动相流速, 检测器温度和柱温也会显著影响各组分出峰时间和峰信号。该方法采用流动相乙腈和水的体积比为75∶25, 流速0.80 mL min-1, 进样量10 μL, 检测器和色谱柱温度均为40℃时, 果糖、葡萄糖和蔗糖的基线在13 min内达到分离, 可以有效的进行可溶性糖含量的准确测定。
利用该方法在花生样品中只检测到蔗糖的存在, 精密性试验相对标准偏差值为0.59%, 重复性试验相对标准偏差值为0.73%, 平均回收率为97.59%, 说明测定结果稳定且准确。以该方法和国标法检测本实验室20份花生材料籽仁中的蔗糖含量表明, 成熟的花生籽仁中的蔗糖含量存在丰富的变异, 蔗糖含量最高的约是蔗糖含量最低的5倍。2种方法的测定结果相关性很高(r= 0.99), 样本配对T检验的结果表明, 两者的测定结果差异不显著。由此可见, 本研究建立的方法结果准确可靠, 适用于花生籽仁中蔗糖含量的定量分析。有研究报道, 花生籽仁的甜味是可遗传的性状, 而蔗糖又是花生籽仁中最主要的可溶性糖[44], 因该方法可大规模快速准确测定蔗糖含量, 可以为甜花生资源筛选、花生籽仁中控制蔗糖含量关键基因的定位、分子标记的开发以及我国未来花生品质育种提供技术支持。
