木薯种茎离体脱水胁迫下生理生化响应研究
2021-12-23董世满李智博郭鑫李淑霞于晓玲彭明
董世满 李智博 郭鑫 李淑霞 于晓玲 彭明


摘 要:木薯是热带和亚热带地区重要的粮食和经济作物。木薯种茎是目前唯一的繁殖方式,然而采收后木薯种茎如何应对脱水胁迫及糖代谢基因的表达尚不清楚。本研究通过检测对照组和保水处理组的木薯种茎在采后不同时间点水分和糖分的含量变化来探究离体条件下木薯种茎内糖类发挥的作用。通过检测糖类代谢相关基因的表达来解析不同糖分间的代谢关系及离体种茎的活性状态。结果表明,在保水处理组中随着采后时间的延长,种茎中的果糖、葡萄糖和蔗糖的含量先降低后升高,而海藻糖含量变化正好相反。同时,保水处理组的果糖、葡萄糖和蔗糖的含量显著高于对照组,而海藻糖含量显著低于对照组。qPCR分析发现,严重的脱水胁迫显著地提高了糖酵解基因的表达。这些结论表明,脱水胁迫显著影响木薯茎中糖类的相互转化。推测脱水胁迫前20 d通过合成海藻糖来响应脱水胁迫,在20~30 d则通过分解海藻糖为木薯种茎提供必要的能量物质。同时本研究通过甘油处理提高了木薯种茎的贮藏时间,为木薯种茎的贮藏提供新的方法。
关键词:木薯种茎;脱水胁迫;甘油处理;糖酵解;海藻糖;种茎保藏
中图分类号:S533 文献标识码:A
Abstract: Cassava is an important food and economic crop in tropical and subtropical areas. The cassava stems are currently the only way to reproduce. However, it is not clear how cassava stems respond to dehydration stress and the expression of glucose metabolism genes in cassava after harvest. In this study, the variation of water and sugar content in cassava stems of control and treatment at different time after harvest was investigated respectively to explore the role of sugars in cassava stems in vitro conditions. The metabolic relationship among different sugars and the activity of cassava stem in vitro were analyzed through the expression of genes related to carbohydrate metabolism. The results showed that the contents of fructose, glucose and sucrose in cassava stem decreased firstly and then increased with the prolongation of postharvest time in the treatment, and the contents were significantly higher than those in the control, while the change and content of trehalose was just the opposite. qPCR analysis demonstrated that the expression of glycolytic genes in cassava stem was improved when exposed to severe dehydration stress. The conclusions suggested that the interconversion of sugars in cassava stems was affected significantly exposed to dehydration stress. Thus, it was speculated that trehalose was synthesized in the first 20 days of dehydration stress in response to dehydration stress, and then was decomposed in the second 20-30 days to provide necessary energy sub-stances for cassava stem. In addition, the storage period of cassava stem increased by glycerol treatment, providing a new method for cassava stem storage.
Keywords: cassava stem; dehydration stress; glycerine treatment; glycolysis; trehalose; stem preservation
DOI: 10.3969/j.issn.1000-2561.2021.11.021
木薯(Manihot esculenta Crantz)是大戟科木薯屬植物[1],是世界三大薯类作物之一。木薯是一种耐贫瘠、抗逆性强的作物[2]。木薯种茎是木薯目前唯一的繁殖方式,人们对采后木薯种茎抗旱的研究主要是通过覆膜、浸水、蜡封等方法对木薯种茎进行处理,研究不同处理对木薯产量的影响[3-4]。然而采后的木薯种茎是如何应对脱水胁迫并没有引起人们的关注。可溶性糖在植物的抗逆胁迫中发挥着重要的作用,木薯种茎的皮层、中柱都存在大量的淀粉和糖类物质,这些物质参与构成木薯种茎的形态,并在木薯种茎的生长和抗逆中起着至关重要的作用。
糖在植物生长发育中提供碳骨架和能量,并增强植物的抗逆性[5-6]。干旱胁迫下植株体内的可溶性糖含量显著提升[7]。体外研究表明,蔗糖、麦芽糖、海藻糖等二糖是植物体抵抗外来胁迫的重要保护剂,它们均能在干燥狀态下保持细胞内酶的活性、且使生物膜的结构免受破坏[8]。在植物生长发育过程中糖主要作为重要的碳源和能量物质参与植物的代谢[9],在高等植物中主要通过糖酵解途径产生ATP、NADH以及丙酮酸来行使功能,维持生物正常的生理代谢。
蔗糖主要在植物体内参与光合固定产物的储存和转运。蔗糖转运从光合作用源组织到非光合作用的库组织[10],包括韧皮部装卸、维管束运输和卸载3个过程。在植物中观察到的许多糖反应是通过转化酶或蔗糖合成酶传导的,近年来的研究表明,内源蔗糖与海藻糖6-磷酸(T6P)水平密切相关,T6P是蔗糖有效性的信号,影响蔗糖和淀粉的相对含量[11]。T6P是合成海藻糖的前提物质之一,而海藻糖是一种非还原性双糖,存在于多种生物中,如细菌、真菌、地衣、藻类和无脊椎动物[12-13],在大多数高等植物中,海藻糖的含量极低,曾被怀疑是微生物污染[13]。
体外研究表明,蔗糖、海藻糖等双糖在干燥状态下具有稳定酶活性和保护膜结构的功能,是植物中重要的脱水保护剂[14]。大量研究结果证明,海藻糖在抵御外界胁迫中发挥着至关重要的作用。植物通过改变渗透调节和次生代谢产物来提高对干旱胁迫的抗性,从而适应干旱胁迫[15]。海藻糖在干燥和冷冻条件下具有很强的水合能力,通过取代生物分子表面的结合水,可以提高蛋白质和生物膜的稳定性[16],因此海藻糖含量的增加可以改善干旱诱导的渗透胁迫的负面效应[17-18],在干旱胁迫下蔗糖、海藻糖含量的提高可以有效抵御外来胁迫对植物的伤害[19-20]。与此同时,海藻糖还参与调节细胞和叶片的生长和发育[19]。
本研究通过测量离体脱水条件下木薯种茎随时间变化的失水率,各糖分变化及淀粉和蔗糖代谢途径相关基因的表达来研究采后的木薯种茎如何应对离体脱水胁迫,探讨木薯种茎离体脱水条件下生理活性的变化。同时通过甘油处理组和对照组进行对比,为木薯的种茎保藏提供参考。
1 材料与方法
1.1 选材和处理
本实验采用中国热带农业科学院热带生物技术研究所澄迈实验种质圃提供的木薯品种(60444)。选取长势一致的木薯品种,处理组两端用甘油均匀涂抹,对照组不做处理。处理组和对照组一起放在室内,室内温度约30 ℃,室内湿度约57%。每10 d测量木薯种茎的含水量。
截取两支长势相同的木薯茎秆约60 cm,处理组用甘油均匀地涂抹木薯种茎两端,对照组不做处理。木薯种茎放在温度约在30 ℃,湿度约57%,正常通风的室内,在采收后的1、10、20、30 d分别从木薯种茎下端取样,尽可能地取有活性的木薯种茎。取样后甘油处理组再次用甘油均匀地涂抹木薯种茎的取样端。取木薯种茎约2 cm小段,先在105 ℃杀青20 min,再80 ℃烘干,测量其中糖分的含量。
每次取样额外取木薯种茎韧皮部,迅速放在液氮中冷冻,随后放在–80 ℃冰箱冷藏,用于提取RNA。
1.2 可溶性糖检测
由上海三黍生物科技有限公司利用色谱法测量可溶性糖的含量。采用Thermo ICS5000(Dionex,Thermo Scientific,Waltham,US)离子色谱系统,采用CarboPac™ PA20(250 mm×3.0 mm)液相色谱柱,流动相为A:H2O,B:200 mmol/L NaOH,检测器为电化学检测器,进样量为25 μL,流速为0.5 mL/min,柱温为30 ℃。使用外标法对糖分含量进行定量,通过不同浓度的标准品来制备拟合曲线,根据仪器导出的数据进行人工数据处理,样品可溶性糖含量(μg/mg)=(C×V×F)/M。其中C为仪器读取的样品浓度,单位μg/mL;V为样品最终定容体积;F为样品稀释倍数;M为样品称量质量。测定烘干后木薯种茎中的海藻糖,蔗糖,葡萄糖,麦芽糖,果糖的含量。
1.3 RNA的提取及qPCR检测
使用TIANGEN多糖多酚植物总RNA提取试剂盒(离心柱型)提取木薯种茎韧皮部总RNA,用Fastking一步法除基因组cDNA第一链合成预混试剂合成第一链cDNA试剂盒做反转录。
qPCR的检测以MeACTIN基因作为内参(表1),采用20 μL反应体系:2× SYBRⅡ 10 μL,Primer(正反向)1.6 μL,ddH2O 7 μL,cDNA 1 μL,SYBR ROXDYe 50× 0.4 μL。反应步骤:第一步,95 ℃预变性30 s,第二步(45个循环),95 ℃:5 s,60 ℃:30 s。
2 结果与分析
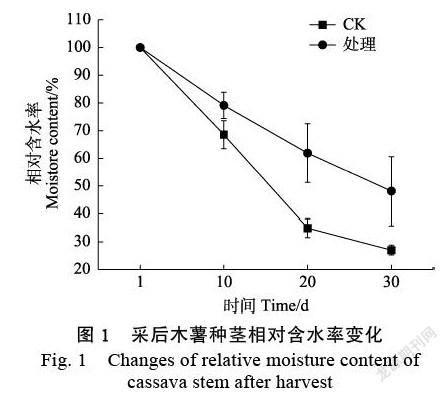
2.1 离体脱水条件下木薯种茎含水量的变化
在离体脱水条件下,木薯种茎前20 d失水速率较快。其中对照组在离体脱水胁迫20 d的平均失水率达到65%,而甘油处理组的木薯种茎在胁迫处理20 d的平均失水率仅为38%。随着处理时间的增长,失水率逐渐减慢。离体脱水胁迫20~30 d,对照组失水变化较小,但对照组的总体失水率达73%,而甘油处理组总失水率仅为52%,表明甘油处理能显著提高木薯种茎的保水率(图1)。
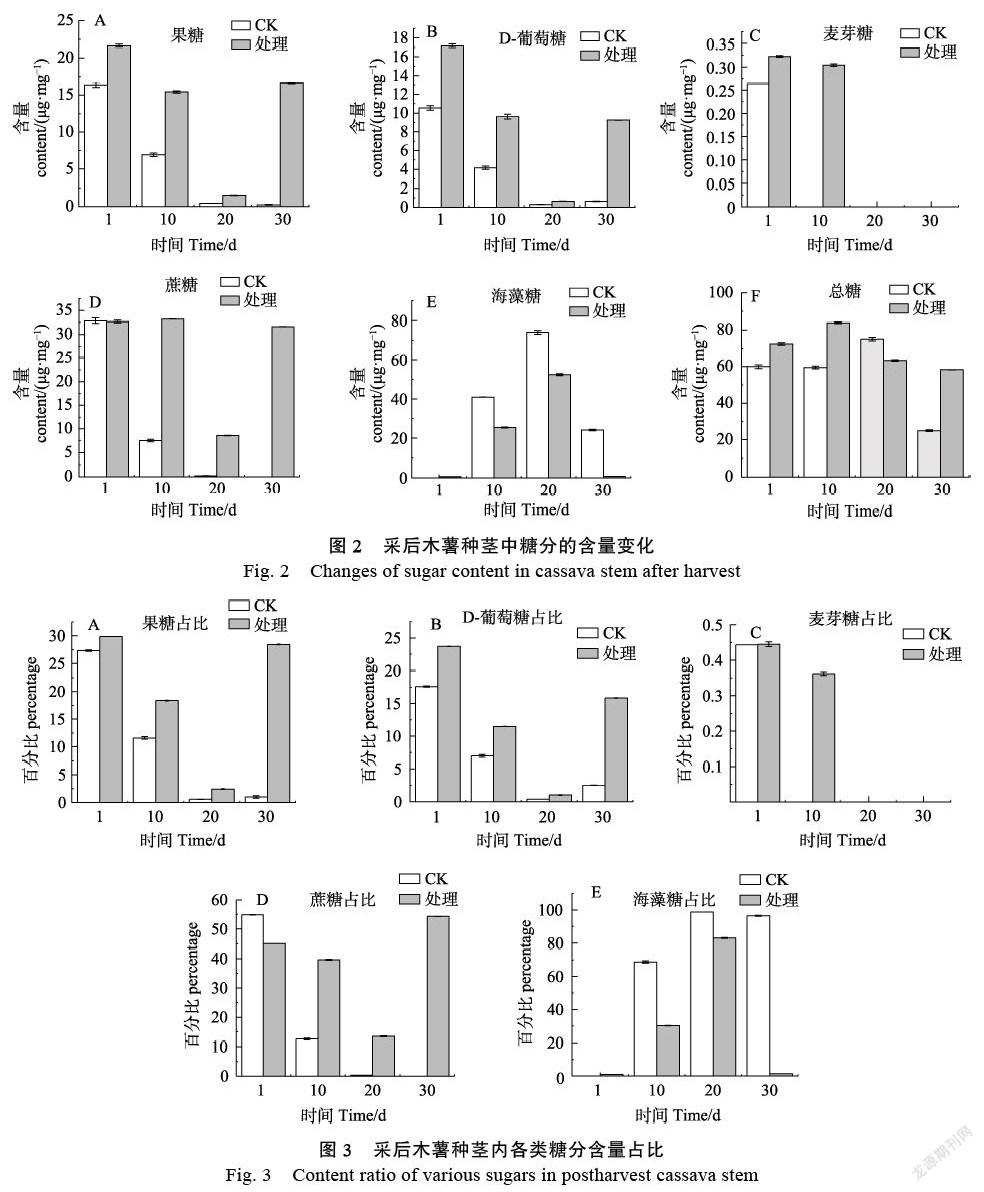
2.2 离体条件下木薯种茎中糖分的含量变化
在对照组中,果糖、D-葡萄糖、蔗糖的含量均随着处理时间的延长含量不断降低,到离体脱水胁迫处理30 d含量几乎为0。在甘油处理组中,果糖、D-葡萄糖的干重含量在前20 d分别降低到1.5 μg/mg和0.65 μg/mg,在20~30 d又逐渐增加,含量分别达到16.6 μg/mg和9.2 μg/mg。在甘油处理组中,麦芽糖和蔗糖的含量在前10 d没有明显的变化,但是,麦芽糖初始含量极低且在处理20 d后低于检测限,而蔗糖含量在10~20 d快速下降后又在实验处理30 d恢复到31.7 μg/mg。对照组和处理组中海藻糖的含量随着时间的变化先升高后急剧降低,但在相同处理天数处理组的海藻糖含量均低于对照组。在离体脱水胁迫下,对照组和处理组中的总糖分呈现相似的变化趋势,均呈先增加后降低的趋势,并在30 d达到最低水平(图2)。
在离体脱水胁迫下,与糖代谢密切相关的果糖和D-葡萄糖的初始占比在25%~30%。随着胁迫程度的加深,果糖和D-葡萄糖的占比逐渐减少,但在胁迫处理30 d,甘油处理组中果糖和蔗糖的占比有大幅度回升,其中果糖占比28%,D-葡萄糖占比16%。在脅迫条件下,木薯种茎内蔗糖的初始含量占比相对较高。对照组中蔗糖的初始含量占比在55%,20 d后木薯种茎内蔗糖几乎消失,而在实验处理组中蔗糖的起始占比在45%,在胁迫处理的前20 d蔗糖占比稳步下调,30 d占比出现较大回升,约占总糖分含量的55%。同为双糖的麦芽糖占比极低并很快被消耗殆尽。在对照组中,与植物抗逆密切相关的海藻糖含量占比呈现急剧上升后稳定在98%左右,而在甘油处理中,海藻糖占比先快速上升,在20 d达到峰值83%后又急剧减少至几乎消失(图3)。
因此,果糖和D-葡萄糖在胁迫条件下主要作为能源不断被消耗从而维持细胞正常的生理代谢,蔗糖作为糖代谢的中间产物同时也具有维持细胞渗透压抵抗脱水胁迫的功能,海藻糖含量的升高能维持细胞渗透压稳定从而抵御脱水胁迫,麦芽糖在脱水胁迫中发挥的作用最小,其含量极低并很快被消耗殆尽。
2.3 离体脱水条件下木薯种茎中糖代谢相关基因的表达
研究发现,在脱水胁迫下,随着处理时间的延长,合成6-磷酸磷酸海藻糖的关键基因6-磷酸海藻糖合成酶(图4A)在甘油处理组中起始表达水平最高,随后平稳表达约与对照组起始水平相同,而在对照组中,仅在实验处理第1天测得该基因的表达。
严重的脱水胁迫促进了糖酵解基因的表达,在对照组中,与糖酵解相关基因6-P葡萄糖糖异构酶(图4C)、己糖激酶(图4D)、6-磷酸果糖激酶(图4E)、丙酮酸激酶(图4G)都表达较为活跃,呈不断上升趋势,但都仅在前20 d表达,而这些基因在甘油处理的木薯种茎中则表达稳定且波动较小,在30 d仍能稳定表达。
与糖异生有关的基因6-P葡萄糖糖异构酶(图4C)在对照组中的表达极为活跃,在10 d的表达量是初始表达量的27倍,但在20 d和30 d未测到该基因表达,而该基因在甘油处理组中的表达呈现先缓慢上升后急剧下降。1,6二磷酸果糖酶(图4H)在对照组中仅在处理第1天测得该基因表达,而在甘油处理组中该基因能在处理组中稳定表达但表达水平不足对照组的一半。磷酸丙酮酸水合酶基因(图4I)在对照组中呈不断下降且仅在离体脱水胁迫前10 d表达,而在处理组中该基因表达较为稳定起伏波动较小。
在脱水胁迫下与蔗糖水解相关的β-呋喃果糖苷酶基因(图4B)在对照组中均有表达且在脱水胁迫20 d表达量急剧增加至初始表达量的9倍左右,其它时间的表达水平和初始表达水平相近。而在甘油处理组中,该基因的表达趋势先下降后缓慢上升,且各阶段的表达水平均低于对照组。
分解麦芽糖的麦芽糖化酶基因(图4F)仅在前10 d测得该基因的表达,在10 d的表达量约为起始表达量的3倍,而在甘油处理组中的表达水平较对照组低,表达趋势呈现先缓慢升高后缓慢降低。
离体脱水胁迫下糖酵解基因在对照组中活跃表达可以为木薯种茎正常的生理代谢提供必要的能量,脱水胁迫下海藻糖含量的增加能提高细胞渗透压。而甘油处理组的含水量较对照组高,糖酵解基因表达稳定,海藻糖含量低于对照组,表明甘油处理可以降低脱水胁迫对木薯种茎的不利影响。因此,用甘油处理木薯种茎是一种有效的方法来提高木薯种茎的活性从而延长木薯种茎的贮藏时间。
3 讨论
对于植物来说,干旱是一种主要的环境胁迫,它阻碍了植物的生长,降低果实产量,严重的干旱胁迫会使植物死亡。而对大豆、水稻、百合花等植物的干旱胁迫的研究主要停留在对植物叶、根、球茎等部位[9, 14-15]。木薯是一种耐热耐干旱耐贫瘠的经济作物,木薯种茎繁殖是木薯目前唯一的繁殖方式,但采后木薯种茎如何应对脱水胁迫仍然未知,本实验对采收后的木薯种茎内生理活性的变化和糖酵解基因表达等进行了系统的分析研究。实验发现在受胁迫较为严重的对照组中糖酵解基因活跃表达,同时发现海藻糖对干旱胁迫的响应最为强烈。
在各类可溶性糖对干旱胁迫的响应的研究中,研究较多的是蔗糖、海藻糖以及可溶性糖总含量在叶片、根茎中怎么响应干旱胁迫[11, 21]。在对木薯叶片的渗透胁迫耐性研究中发现海藻糖是比蔗糖、葡萄糖和果糖更重要的渗透压调节因子或信号转导调节因子[22]。在本实验中,采收后的木薯种茎在胁迫处理的前20 d,葡萄糖、果糖、麦芽糖和蔗糖的含量随着实验处理时间的延长不断减少,仅有海藻糖的含量是在不断增加。因此海藻糖对干旱胁迫中的响应远远大于其它糖类。同时本实验发现,在对照组中,合成T6P的关键基因海藻糖-6-磷酸合成酶基因仅在第1天表达,但离体胁迫前20 d海藻糖含量随着处理时间的增长其含量不断增加,因此推测还有其它更稳定快速的代谢通路在脱水胁迫条件下诱导海藻糖的合成。而在胁迫处理20~30 d海藻糖的含量大量减少,分析推测在脱水胁迫前20 d木薯种茎通过合成海藻糖提升植株本身的抗逆能力,在干旱胁迫后期木薯种茎中营养物质被充分消耗,则海藻糖转化为D-葡萄糖来维持木薯种茎正常的生理代谢。同时推测采收后20~30 d保水处理组中,D-葡萄糖、果糖、蔗糖含量的大幅增加是由于海藻糖的分解和木薯种茎侧芽逐渐失活减少了对糖分的消耗。
海藻糖在响应干旱胁迫中具有维持细胞渗透压稳定和保护细胞的优良特性[23],因此有研究将海藻糖合成基因转入水稻和烟草中,转基因植株没有发生毒副反应并且提高了水稻和烟草的耐旱性[13-14]。因此将海藻糖合成基因通过基因工程转入重要的粮食经济作物中,提高作物的抗旱性从而提升作物产量是一条行之有效的方法。
本实验通过甘油保水处理提高了木薯种茎的贮存时间,是一种有效的提高木薯贮藏时间的方法。但同时甘油处理不能抑制侧芽的生长从而大量消耗木薯种茎内有限的养分,后续试验可以探索能否通过甘油处理木薯种茎两端和控制环境含水量或者喷洒激素抑制侧芽生长相结合的方法来提升木薯种茎的贮藏时间,以及通过基因工程增强木薯合成海藻糖的基因在干旱胁迫下的表达,从而增强木薯植株的抗旱能力,进而延长采收后木薯种茎的保藏时间及在干旱胁迫下增加木薯的产量。同时,木薯内合成海藻糖的相关基因是一种优质的基因资源,筛选和改造这些基因使其可以在其它经济作物内表达从而提升作物的抗旱性,为植物的抗旱研究提供一种新方法。
參考文献
[1] Antonio C. Allem. The origin of Manihot esculenta Crantz (Euphorbiaceae)[J]. Genetic Resources and Crop Evolution, 1994, 41(3): 133-150.
[2] Li S X, Yu X, Lei N, et al. Corrigendum: Genome-wide identification and functional prediction of cold and/or drought-responsive lncRNAs in cassava[J]. Scientific Re-ports, 2017, 7(1): 781-803.
[3] 刘海刚, 黄 洁, 罗会英, 等. 种茎覆膜、浸水和蜡封对木薯抗旱性的影响[J]. 热带作物学报, 2014, 35(4): 668-72.
[4] 杨玉皎, 魏云霞, 韩学琴, 等. 种茎贮藏和浸水时间对木薯种苗抗旱性的影响[J]. 江西农业学报, 2016, 28(11): 10-4.
[5] Xu W, Cui K, Xu A, et al. Drought stress condition in-creases root to shoot ratio via alteration of carbohydrate partitioning and enzymatic activity in rice seedlings[J]. Acta Physiologiae Plantarum, 2015, 37(2): 1-11.
[6] Morgutti S, Negrini N, Pucciariello C, et al. Role of treha-lose and regulation of its levels as a signal molecule to abi-otic stresses in plants[M]. Elsevier ScienceDirect: Plant Sig-naling Molecules, 2019: 235-55.
[7] Yoon J, Cho L H, Tun W, et al. Sucrose signaling in higher plants[J]. Plant Science, 2021, 302: 110703.
[8] Asaf S, Khan A L, Khan M A, et al. Osmoprotective func-tions conferred to soybean plants via inoculation with Sphingomonas sp. LK11 and exogenous trehalose[J]. Microbiological Research, 2017, 205: 135-145.
[9] Du Y L, Zhao Q, Chen L R, et al. Effect of drought stress on sugar metabolism in leaves and roots of soybean seed-lings[J]. Plant Physiology and Biochemistry, 2020, 146: 1-12.
[10] Yuan H, Wu Y, Liu W, et al. Mass spectrometry-based method to investigate the natural selectivity of sucrose as the sugar transport form for plants[J]. Carbohydrate Research, 2015, 407: 5-9.
[11] Li L, Sheen J. Dynamic and diverse sugar signaling[J]. Current Opinion in Plant Biology, 2016, 33: 116-125.
[12] Uchida T, Furukawa M, Kikawada T, et al. Trehalose uptake and dehydration effects on the cryoprotection of CHO-K1 cells expressing TRET1[J]. Cryobiology, 2019, 90(3): 30-40.
[13] Han B, Fu L, Zhang D, et al. Interspecies and intraspecies analysis of trehalose contents and the biosynthesis pathway gene family reveals crucial roles of trehalose in osmot-ic-stress tolerance in cassava[J]. International Journal of Molecular Sciences, 2016, 17(7): 1077.
[14] Garg A K, Kim J K, Owens T G, et al. Trehalose accumula-tion in rice plants confers high tolerance levels to different abiotic stresses[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(25): 15898-15903.
[15] Li W, Wang Y, Zhang Y, et al. Impacts of drought stress on the morphology, physiology, and sugar content of Lanzhou lily (Lilium davidii var. unicolor)[J]. Acta Physiologiae Plantarum, 2020, 42(8): 127.
[16] Elbein A D, Pan Y T, Pastuszak I, et al. New insights on trehalose: a multifunctional molecule[J]. Glycobiology, 2003, 13(4): 17R-27R.
[17] Pan B , Xu K K, Luo Y J, et al. The sequence charac-teristics and functions on regulating trehalose metabolism of two PTP genes in Tribolium castaneum (Herbst) (Coleoptera: Tenebrionidae)[J]. Journal of Stored Products Research, 2020, 89(6):101692.
[18] Yoshida K, Ono F, Chouno T, et al. Cryoprotective enhanc-ing effect of very low concentration of trehalose on the functions of primary rat hepatocytes[J]. Regenerative Therapy, 2020, 15: 173-179.
[19] Batnini M, Lopez-Gomez M, Palma F, et al. Sinorhizobium spp inoculation alleviates the effect of Fusarium oxysporum on Medicago truncatula plants by increasing antioxidant capacity and sucrose accumulation[J]. Applied Soil Ecology, 2020, 150: 103458
[20] Tong R, Zhou B, Cao Y, et al. Metabolic profiles of moso bamboo in response to drought stress in a field investiga-tion[J]. Science of The Total Environment, 2020, 720: 137722.
[21] Chary S N, Hicks G R, Choi Y G, et al. Treha-lose-6-phosphate synthase/phosphatase regulates cell shape and plant architecture in Arabidopsis[J]. Plant Physiol, 2008, 146(1): 97-107.
[22] Vaessen E M J, Kemme H A, Timmermans R A H, et al. Temperature and presence of ethanol affect accumulation of intracellular trehalose in Lactobacillus plantarum WCFS1 upon pulsed electric field treatment[J]. Bioelectrochemistry, 2021, 137: 107680.
[23] Schluepmann H, Pellny T, Dijken A V, et al. Trehalose 6-phosphate is indispensable for carbohydrate utilization and growth in Arabidopsis thaliana[J]. PNAS, 2003, 100: 6849-6854.
責任编辑:白 净
