甘遂辅助NIPPV对重症急性胰腺炎所致急性肺损伤的疗效观察
2021-12-22马亚军
马亚军
(许昌市中医院急诊科,河南 许昌461000)
据权威数据调查显示,重症急性胰腺炎的致死率已高达20%[1]。急性肺损伤就是重症急性胰腺炎的严重并发症之一,约有65%重症急性胰腺炎患者死于急性肺损伤[2]。然而由于重症急性胰腺炎所致急性肺损伤的发病机制极为复杂,临床上对其的治疗手段有限,主要通过纠正水电解质紊乱、呼吸支持等对症措施来缓解患者症状,所以,研发新的治疗手段是医疗工作人员仍需努力的方向。
甘遂,又名苦泽,为大戟科多年生肉质草本植物甘遂的干燥块根,具有泻水逐饮、破积通便之功效,据相关文献报道[3],甘遂治疗重症急性胰腺炎所致急性肺损伤的疗效显著,运用其做辅助治疗,可以改善患者的肺功能,控制患者机体中的炎性因子发展。无创正压机械通气(Non Invasive Positive Pressure Ventilation,NIPPV)是早期治疗重症急性胰腺炎所致急性肺损伤的主要手段,用以维持患者生命体征,改善患者肺部氧合功能。目前,对于两者联合应用的相关报道较少,基于此,本研究主要针对甘遂辅助NIPPV治疗对重症急性胰腺炎所致急性肺损伤患者临床疗效、肺功能及炎性因子的影响进行分析,旨在为临床诊疗工作提供参考依据。现将研究结果报告如下。
1 资料与方法
1.1 一般资料
选取2015年6月至2020年9月期间于我院诊治的重症急性胰腺炎所致急性肺损伤患者82例为本次研究对象,按照随机分为研究组(n=41)和对照组(n=41)。对照组男22例,女19例,平均年龄为41.63S10.33岁;研究组男23例,女18例,平均年龄为41.72S10.58岁。
纳入标准:(1)临床资料完整;(2)均符合2014年中国重症急性膜腺炎中西医结合诊治指南中关于重症急性胰腺炎的诊断标准[4];(3)均伴有急性肺损伤;(4)已通过医院伦理委员会批准;(5)患者及家属均知晓本研究,已签署知情同意书。
排除标准:(1)存在心脑血管等严重疾病者;(2)存在恶性肿瘤者;(3)存在自身免疫系统疾病或血液系统疾病者;(4)存在消化道出血、穿孔或肠梗阻者;(5)存在精神障碍,无法配合完成治疗者。两组患者一般资料,有可比性(P>0.05)。
1.2 方法
所有患者均在入院后完善相关检查,予以禁食、胃肠减压、抗休克、维持水电解质平衡等常规治疗。
对照组在上述基础上予以NIPPV治疗,方法如下:患者高流量吸氧6 h,动脉血氧分压<60 mmHg时予以无创呼吸机进行辅助通气治疗,将呼吸机频率设置为14~18次•min-1,患者吸入氧浓度为40~100%,最初吸气压为5~15 cm H2O,呼气压为5~12 cm H2O。研究组在对照组的基础上联合甘遂治疗,方法如下:甘遂粉1.5g+50 mL生理盐水,胃管内注入后夹闭胃管30~60 min,每间隔6~8 h 1次,2~3次•d-1。
1.3 观察指标
1.3.1 临床疗效[5]
患者自主呼吸恢复,临床症状消失并成功撤机为显效;患者临床症状好转,但仍需要NIPPV治疗为有效;患者症状未见好转,甚至加重为无效。总有效率=(显效+有效)/总例数×100%。
1.3.2 肺功能
比较患者治疗前及治疗1个月后的肺功能指标,包括用力肺活量(Fast vital capacity,FVC)、第1秒钟用力呼气容积(Forced expiratory volume in 1 second,FEV1)、最大肺活量(Maximum vital capacity,MVC)、最大通气量(maximum minute ventilation,MMV)。
采用产自意大利科时迈公司的肺功能测试仪,检测由专业人员进行。
1.3.3 炎性因子
比较患者治疗前及治疗1个月后的炎性因子指标,包括白介素-6(Interleukin 6,IL-6)、白介素-8(Interleukin 8,IL-8)、肿瘤坏死因子(tumor necrosis factor-ɑ,TNF-ɑ)。
采集患者清晨空腹静脉血4 mL,以3000 rpm的速率离心处理10 min,取出上层血清保存至-80℃的冰箱内,采用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)检测,试剂盒均由上海酶联生物技术有限公司提供。
1.4 统计学方法
本研究数据均采用SPSS22.0软件进行统计分析,计量资料通过平均数±标准差(SSD)描述,组间比较采用t检验;计数资料通过率或构成比描述,组间比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 临床疗效
研究组临床疗效为95.12%,明显高于对照组80.49%,差异具有统计学意义(P<0.05)。详见表1。

表1 两组临床疗效比较(n(%),n=41)
2.2 肺功能
治疗前,两组FVC、FEV1、MVC、MMV水平比较无差异(P>0.05);治疗后,两组FVC、FEV1、MVC、MMV水平均较治疗前升高,且以研究组升高更为明显(P<0.05)。详见表2。
表2 两组治疗前后的肺功能的比较(±SD,n=41)
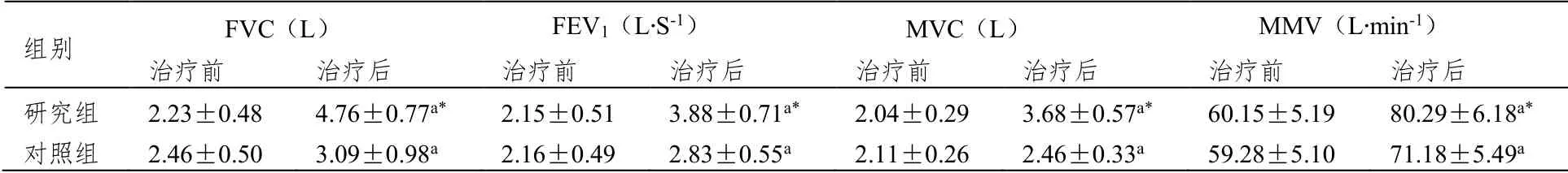
表2 两组治疗前后的肺功能的比较(±SD,n=41)
注:与同组治疗前对比,aP<0.05;与对照组相比,*P<0.05。
组别 FVC(L) FEV1(L∙S-1) MVC(L) MMV(L∙min-1) 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 研究组 2.23±0.48 4.76±0.77a* 2.15±0.51 3.88±0.71a* 2.04±0.29 3.68±0.57a* 60.15±5.19 80.29±6.18a* 对照组 2.46±0.50 3.09±0.98a 2.16±0.49 2.83±0.55a 2.11±0.26 2.46±0.33a 59.28±5.10 71.18±5.49a
2.3 炎性因子
治疗前,两组IL-6、IL-8及TNF-α水平比较无差异(P>0.05);治疗后,两组IL-6、IL-8及TNFα水平均较治疗前下降,且以研究组下降更为明显(P<0.05)。见表3。
表3 两组治疗前后炎性因子水平比较(±SD,n=41)
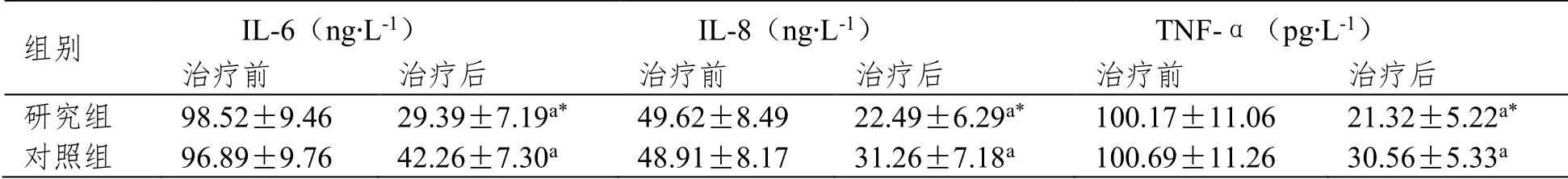
表3 两组治疗前后炎性因子水平比较(±SD,n=41)
注:与同组治疗前相比,aP<0.05;与对照组相比,*P<0.05。
组别 IL-6(ng∙L-1) IL-8(ng∙L-1) TNF-α(pg∙L-1) 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 研究组 98.52±9.46 29.39±7.19a* 49.62±8.49 22.49±6.29a* 100.17±11.06 21.32±5.22a* 对照组 96.89±9.76 42.26±7.30a 48.91±8.17 31.26±7.18a 100.69±11.26 30.56±5.33a
3 讨论
重症急性胰腺炎起病急、发展快,患者未及时治疗,会造成多器官损害,甚至危及生命,其中急性肺损伤在器官损害中最为显眼,其死亡率超过其他脏器损害。
既往学术报道中可知,患者的全身炎症反应及肺功能下降是病情发展至肺损伤的主要原因[6]。所以在治疗上以控制炎症进展和帮助患者恢复肺功能为主。
本研究发现甘遂辅助NIPPV治疗重症急性胰腺炎所致急性肺损伤患者组的临床疗效不仅优于常规治疗NIPPV治疗组,并且在改善炎症因子水平及恢复肺功能方面的效果也要较优。考虑其原因可能是中药甘遂作为峻下遂水之代表药,抑制了炎症细胞的活性,从而减少了炎性因子分泌白细胞,改善了炎症水平。而据相关实验表明[7],TNF-α水平增高会引起肺组织的微血管破坏,损害肺功能,所以通过甘遂治疗还能恢复患者肺部的换气功能,临床疗效更为显著。
综上所述,甘遂联合NIPPV治疗重症急性胰腺炎所致急性肺损伤能够帮助患者改善炎症因子水平、恢复肺功能,临床疗效显著。
Efficacy and safety of maralixibat treatment in patients with Alagille syndrome and cholestatic pruritus (ICONIC): a randomised phase 2 study
Emmanuel Gonzales, et al.
Background: Alagille syndrome is a rare genetic disease that often presents with severe cholestasis and pruritus. There are no approved drugs for management. Maralixibat, an apical, sodium-dependent, bile acid transport inhibitor, prevents enterohepatic bile acid recirculation. We evaluated the safety and efficacy of maralixibat for children with cholestasis in Alagille syndrome.
Methods: ICONIC was a placebo-controlled, randomised withdrawal period (RWD), phase 2b study with open-label extension in children (aged 1-18 years) with Alagille syndrome (NCT02160782). Eligible participants had more than three times the normal serum bile acid (sBA) levels and intractable pruritus. After 18 weeks of maralixibat 380 μg/kg once per day, participants were randomly assigned (1:1) to continue maralixibat or receive placebo for 4 weeks. Subsequently, all participants received openlabel maralixibat until week 48. During the long-term extension (204 weeks reported), doses were increased up to 380 μg/kg twice per day. The primary endpoint was the mean sBA change during the RWD in participants with at least 50% sBA reduction by week 18. Cholestastic pruritus was assessed using observer-rated, patient-rated, and clinician-rated 0-4 scales. The safety population was defined as all participants who had received at least one dose of maralixibat. This trial was registered with ClinicalTrials.gov, NCT02160782, and is closed to recruitment.
Findings: Between Oct 28, 2014, and Aug 14, 2015, 31 participants (mean age 5·4 years [SD 4·25]) were enrolled and 28 analysed at week 48. Of the 29 participants who entered the randomised drug withdrawal period, ten (34%) were female and 19 (66%) were male. In the RWD, participants switched to placebo had significant increases in sBA (94 μmol/L, 95% CI 23 to 164) and pruritus (1·7 points, 95% CI 1·2 to 2·2), whereas participants who continued maralixibat maintained treatment effect. This study met the primary endpoint (least square mean difference -117 μmol/L, 95% CI -232 to -2). From baseline to week 48, sBA (-96 μmol/L, -162 to -31) and pruritus (-1·6 pts, -2·1 to -1·1) improved. In participants who continued to week 204 (n=15) all improvements were maintained. Maralixibat was generally safe and well tolerated throughout. The most frequent adverse events were gastrointestinal related. Most adverse events were self-limiting in nature and mild-to-moderate in severity.
Interpretation: In children with Alagille syndrome, maralixibat is, to our knowledge, the first agent to show durable and clinically meaningful improvements in cholestasis. Maralixibat might represent a new treatment paradigm for chronic cholestasis in Alagille syndrome.
Funding: Mirum Pharmaceuticals.
Lancet. 2021 Oct 30;398(10311):1581-1592. doi: 10.1016/S0140-6736(21)01256-3.
