高尿酸血症对小鼠短期牙周感染牙槽骨破坏的micro-CT分析
2021-12-22罗咏熙黄雪莹冼若婷余皖鑫梁莉欣梁兆佳陈紫韵侯丹余挺
罗咏熙, 黄雪莹, 冼若婷, 余皖鑫, 梁莉欣, 梁兆佳, 陈紫韵, 侯丹, 余挺
广州医科大学附属口腔医院·口腔医学重点实验室·广州口腔疾病研究所,广东广州(510182)
慢性牙周炎是口腔菌群失调引起的可导致牙周组织破坏的慢性感染性疾病。重度牙周炎的全球患病率达11.2%,是失牙的主要原因[1]。牙周组织破坏的程度主要取决于宿主易感性,牙周炎易感性可受到多种全身代谢病的影响,如心血管疾病、糖尿病、肥胖、代谢综合征等[2]。宿主代谢免疫失调是重大代谢病加重牙周炎的重要机制[3]。高尿酸血症(hyperuricemia,HU)是继“三高”(高血压、高血糖、高血脂)后的第四高,全球患病率约15%,中国患病率约13.3%[4]。嘌呤分解代谢过程中,尿酸(uric acid,UA)生成增多或排出减少均可引起HU。UA 结晶在关节中沉积可引起痛风性关节炎,在关节外组织沉积可引起肾结石、慢性肾病。而且,HU 是多种重大代谢病包括肥胖、糖尿病、心血管疾病、骨质疏松症的危险因素[5]。HU 主要通过上调系统性炎症导致多器官(包括骨组织)损害[6]。
近年研究显示,血液、唾液UA 水平变化与多种口腔硬组织疾病相关,包括根尖周炎[7]、牙周炎[8]、植体周病[9]、牙根吸收[10]。牙周炎患者的血浆UA 水平较健康对照组更高[11]。在IgA 肾病患者中,伴重度牙周炎者比伴轻中度牙周炎者的血清UA 水平更高[12]。牙周基础治疗后的血清UA 水平较治疗前降低[13]。然而,以往研究关注的血液尿酸水平变化均处于正常生理范围,尚缺乏HU 与牙周炎关联的直接证据[14]。鉴于HU 与牙周炎的动物模型均已成熟化,利用复合模型探索两种疾病的相关性具备可行性。本研究拟建立HU 与牙周炎的复合动物模型,并探索HU 与牙周炎是否具有相关性。
1 材料和方法
1.1 实验动物
实验动物由广东省医学实验动物中心提供。14只SPF级KM小鼠(雄性,5周龄,体质量28~32 g)购入后适应性喂养3 d。实验通过广州医科大学动物实验中心伦理委员会批准(批号GY2019-028)。
1.2 模型建立
1.2.1 HU 模型建立 将小鼠随机分为两组,即高尿酸(HU)饲料组和正常对照(NC)饲料组(n=7)。HU 组喂以诱导饲料(博泰宏达生物,北京),配方为标准饲料+添加成分(表1)。添加成分为5%氧嗪酸钾、2.5%尿酸,添加比例参照以往研究[15]。NC 组喂以无特殊添加成分的标准饲料(广东省医学实验动物中心)作为对照。HU 模型通过血清检测UA 浓度进行验证。以往研究中,小鼠尿酸浓度升高,与对照组有统计学差异,则可认为HU 动物模型构建成功[16]。饲养环境为SPF 级,温度(20~26)℃,3~4 只一笼饲养,自由饮食。诱导期设为35 d[15]。记录基线体质量和诱导35 d 体质量。
1.2.2 牙周炎模型建立 饲料诱导25 d,进入牙周炎诱导期。参照以往研究[17],腹腔注射4%水合氯醛溶液麻醉(0.1 mL/10 g 体质量)下,5-0 丝线(爱惜康,上海强生)结扎右侧上颌第二磨牙,诱导牙周炎(P 侧),左侧不结扎作为对照(C 侧)。结扎5 d时,异氟烷气麻下检查丝线稳定性,若脱落则进行二次结扎。结扎10 d 后处死,结扎期间饲料不变。
1.2.3 模型建立的时间轴 5 周龄的雄性KM 小鼠适应性喂养后,随机分为两个饲料组,分别用诱导饲料和标准饲料喂养,饲料诱导期为35 d,第25 d结扎右侧上颌第二磨牙,结扎期间饲料不变,25 d至35 d 为牙周炎诱导期,35 d 处死小鼠,组织取材。
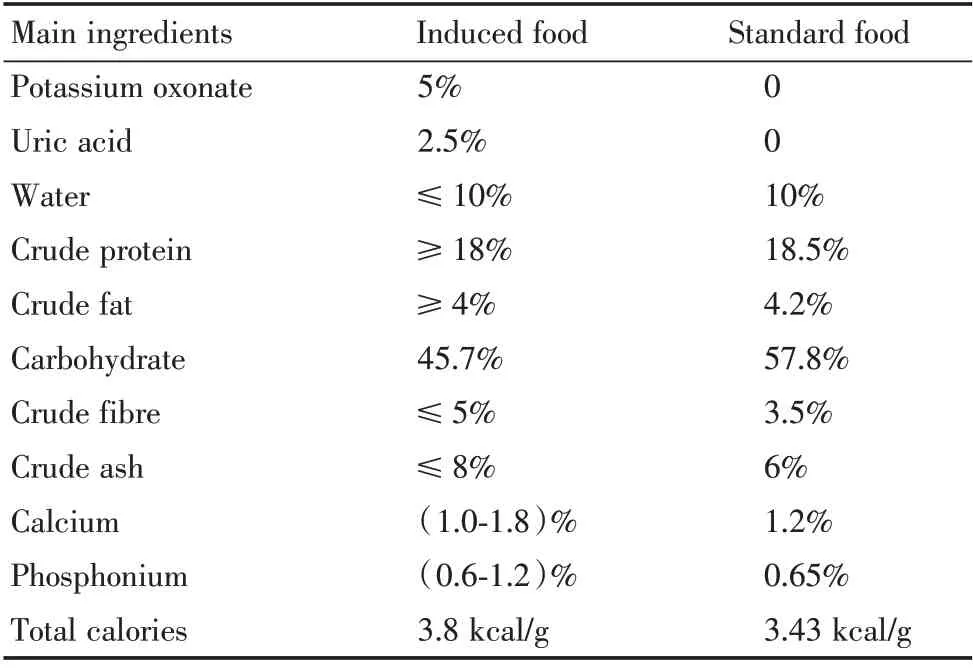
表1 诱导饲料和标准饲料的各成分质量分数Table 1 Ingredients′mass fractions in induced food and standard food
1.3 组织取材
饲料诱导前,尾静脉采空腹全血80 μL,分离血清,冻存(-20 ℃),用于基线UA 检测。诱导期结束后,心脏穿刺采血用于终点UA 检测。35 d 颈椎脱臼处死,分离双侧上颌骨,用以micro-CT 分析。
1.4 血清UA 浓度检测
血清置于室温解冻,按照尿酸试剂盒(建成生物,南京)说明操作。检测原理为尿酸酶法,产物检测采用酶比色法,酶标仪测定产物水平并换算成尿酸浓度。
1.5 颌骨micro-CT 分析
颌骨使用micro-CT(SkyScan1172,Bruker 公司,比利时)扫描,扫描参数为80 kV,100 μA,扫描层厚8 μm,扫描结束后利用配套软件进行三维图像重建。用于分析的感兴趣区域(region of interest,ROI),下界为第二磨牙的根分叉顶,上界为其根尖,近中界为右上第一磨牙近中根的近中,远中界为右上第三磨牙远中根的远中。每5 层划定一次ROI,直至完成。分析得出ROI 区的总体积、扣除牙根后的骨体积以及骨矿物质密度。骨体积分数=扣除牙根后的骨体积/总体积[18]。
1.6 组织学分析
颌骨扫描结束后,于常温下用10%EDTA 脱钙2 周,冲水过夜,组织修整,脱水,石蜡包埋,冠状面朝下。切片,厚度为5 μm,调整角度使三颗磨牙冠根在一个平面上,后行苏木素-伊红染色,染色后拍照。定性分析牙周炎症和牙槽骨吸收。具体可参照以往研究[19]。
1.7 统计学分析
采用SPSS 22.0 进行统计学分析,数据均符合正态分布,用均数± 标准差表示,用t 检验进行比较。对UA 浓度与牙槽骨吸收指标、体质量进行Pearson 相关性分析。P < 0.05 为差异有统计学意义。
2 结 果
2.1 HU 模型验证
饲料诱导前,NC组体质量(30.66±0.78)g,HU组体质量(30.92±0.99)g,差异无统计学意义(t=-0.538,P=0.601);饲料诱导35 d 后,NC 组体质量(48.96± 3.46)g,HU 组体质量(42.35 ± 4.11)g,差异有统计学意义(t=3.106,P=0.010)。
饲料诱导前,NC 组血清UA(33.33 ± 5.97)μmol/L,HU 组血清UA(29.40 ± 11.03)μmol/L,差异无统计学意义(t=0.828,P=0.424)。饲料诱导35 d 后,HU 组血清UA(112.94±26.82)μmol/L,NC组血清UA(72.21 ± 19.95)μmol/L,差异有统计学意义(t=-3.058,P=0.011)。
2.2 牙周炎模型验证
HU 小鼠中,C 侧、P 侧骨体积分数为(42.41 ±7.81)%、(29.01 ± 11.09)%,差异有统计学意义(t=-2.421,P=0.036);C 侧、P 侧骨矿物质密度为(0.74 ± 0.08)g/cm3、(0.53 ± 0.16)g/cm3,差异有统计学意义(t=-2.896,P=0.016)。NC 小鼠获得的结果与HU 小鼠类似,C 侧、P 侧骨体积分数为(50.27 ±10.84)%、(29.56 ± 15.27)%,差异有统计学意义(t=-2.709,P=0.022);C 侧、P 侧骨矿物质密度为(0.73 ± 0.05)g/cm3、(0.52 ± 0.14)g/cm3,差异有统计学意义(t=-3.409,P=0.007)。两饲料组牙周炎侧相对于对照侧的牙龈乳头消失,附着丧失明显,结缔组织大量炎症细胞浸润,骨吸收明显(图1、图2)。
2.3 HU 对牙槽骨吸收的影响
HU 组、NC 组P 侧骨体积分数为(29.01 ±11.09)%、(29.56 ± 15.27)%,差异无统计学意义(t=-0.072,P=0.944);HU 组、NC 组P 侧骨矿物质密度为(0.53±0.16)g/cm3、(0.52±0.14)g/cm3,差异无统计学意义(t=0.038,P=0.970)。
2.4 血清UA 浓度与牙槽骨吸收的相关性

Figure 1 micro-CT topograph of the periodontitis side and control side in the HU group and NC group图1 HU 组与NC 组中牙周炎侧与对照侧的micro-CT 形貌图

Figure 2 HE staining of pathology slides on the periodontitis side and control side in the HU group and NC group ×100图2 HU 组与NC 组中牙周炎侧与对照侧的HE 染色组织病理图 ×100
在进行UA 浓度与牙槽骨吸收指标的相关性分析之前,先进行了UA 浓度与体质量的相关性分析。结果显示,UA 浓度与体质量无相关性(r=-0.493,P=0.103)。HU 组P 侧中,UA 浓度与总体积(r=0.043,P=0.935)、扣除牙根后的骨体积(r=0.098,P=0.854)、骨体积分数(r=0.097,P=0.855)及骨矿物质密度(r=0.299,P=0.565)均无相关性;NC 组P 侧中亦发现类似结果,UA 浓度与总体积(r=-0.188,P=0.721)、扣除牙根后的骨体积(r=0.08,P=0.880)、骨体积分数(r=0.003,P=0.996)及骨矿物质密度(r=-0.003,P=0.996)均无相关性。
3 讨 论
本研究首次建立HU 与牙周炎的联合动物模型,结果显示两种模型均建立成功。然而,基于micro-CT 的颌骨大体形态分析未发现HU 或UA 水平与牙槽骨吸收有直接关系。micro-CT 的颌骨形态分析结果暂不支持HU 与牙周炎相关。
建立HU 动物模型的方法有敲除尿酸氧化酶基因、补充外源性尿酸、补充尿酸前体物质、利用尿酸酶抑制剂(如氧嗪酸钾)抑制尿酸酶活性以及利用抗尿酸排泄药物(如乙胺丁醇)抑制肾脏排除尿酸[15]。诱导饲料中含有氧嗪酸钾和尿酸,不仅抑制尿酸酶的活性,而且外源性补充尿酸,从而使血尿酸升高。临床上,男性血尿酸浓度高于420 μmol/L,女性高于360 μmol/L,即称为高尿酸血症。动物方面无具体标准,UA 升高即可认为建模成功。丝线结扎法是使用广泛的牙周炎造模方法。丝线结扎可能会因为牙周创伤、牙齿松动、麻醉并发症等系列后果造成小鼠进食受到影响,从而造成代谢状态的偏移[20]。本研究基于前期大量的牙周炎与肥胖复合造模经验[19],将饲料诱导的HU 模型与结扎法诱导的牙周炎模型合并,未观察到模型合并对两种成模结果的明显干扰。而且,HU 组的体质量增长情况亦符合KM 小鼠在标准饲料下的正常生长曲线。
饲料诱导不同于注射法与灌胃法,无法控制小鼠摄入等热量饲料。高尿酸饲料与基础饲料尽管存在成分、热量的轻微差异,但均属于国标饲料,这并非造成两饲料组体质量差别的原因。相反,标准饲料的单位热量稍低,但该组小鼠的体质量反而更高,可能因为诱导饲料中的特殊添加成分氧嗪酸钾和尿酸造成小鼠食物摄入量减少[21]。本研究结果显示,体质量与血清UA 或牙槽骨吸收并无相关性,故未参与混杂HU 与牙周炎之间的关系。可能因为两饲料组的体质量差异(15.6%)在正常范围,并未达到超重或肥胖(> 25%体质量增长[22])。
基于micro-CT 的颌骨大体形态分析,本研究尚未发现HU 或UA 水平与牙周炎的相关性。Narendra 等[23]也发现牙周炎及其严重程度不影响UA 水平。但也有一些研究表明,血UA 水平与牙周炎及其严重程度呈正向关系;例如,牙周炎患者的UA水平较牙周健康高[11];牙周基础治疗降低牙周炎患者的血清UA 水平[13]。但临床上UA 水平的升高尚在正常生理范围内,并未达到HU 的标准。动物实验显示,肥胖状态的牙周炎大鼠的UA 水平较牙周健康组高[8]。在牙周炎大鼠中,高脂饮食组的UA 水平较正常饮食组更高[24]。本研究与上述研究存在差异的原因可能有两点:①两饲料组的体质量差异在正常范围,未达到超重;②UA 浓度变化的程度存在差异。尚有研究显示,牙周炎患者的唾液UA 水平较牙周健康者更低[25],可能因为唾液与血液的UA 代谢存在差异。
基于该复合模型,通过micro-CT 的颌骨大体形态分析,未发现HU 对牙槽骨吸收的不利效应,也未发现尿酸浓度与牙槽骨吸收的相关性,可能有几点原因:①牙周炎模型虽然构建成功但观察时间不够长,在短期内HU 对牙槽骨吸收的潜在不利影响未显现;②样本量偏小,个体差异造成的误差掩盖了HU 可能存在的不利作用;③系统和牙周组织免疫的全面评估可能有利于发现HU 的细微影响;④不排除HU 可能无法直接影响但可通过共发病如肥胖对牙周炎间接施加影响[8]。
综上所述,本研究成功建立HU 与牙周炎的复合动物模型,为HU 与牙周炎的关系研究打下基础。micro-CT 的颌骨大体形态分析暂不支持HU 与牙周炎的直接关联,未来尚需更大样本的动态实验、多时间点纵向比较以及多水平指标分析(组织学分析和分子生物学分析)进一步探究HU 与牙周炎的关系。
【Author contributions】Luo YX processed and analyzed the data and wrote the article. Huang XY, Xian RT, Yu WX, Liang LX, and Chen ZY performed the experiments. Liang ZJ directed the data collection and analysis. Hou D guided the writing of the article. Yu T designed the study. All authors read and approved the final manuscript as submitted.
