不同加工覆盆子多元指标成分测定及TOPSIS综合评价
2021-12-21陈梦婷杨欣谕李翱翔潘萍陈宏降陶倩罗益远
陈梦婷,杨欣谕,李翱翔,潘萍,陈宏降,陶倩,罗益远*
(1.浙江医药高等专科学校,宁波315100;2.浙江中医药大学,杭州310053)
覆盆子,蔷薇科悬钩子属华东覆盆子(Rubus chingii Hu)的干燥果实,其在我国已有悠久的药用历史,具有益肾固精缩尿,养肝明目的作用,具有研究前景[1]。市场上诸多覆盆子药材难以达到药典质量标准,除品种原因以外,很大程度上由加工方式造成[2]。《中国药典》2020版规定覆盆子的加工方法为:沸水中略烫或略蒸,取出,干燥[3]。因此,需要一种能提高覆盆子有效成分含量的加工方法,从而提高覆盆子的质量。
覆盆子化学成分主要含有黄酮类、酚酸类、萜类、多糖类等[4-5]。2020版《中国药典》中仅以鞣花酸和山柰酚-3-O-芸香糖苷的含量评价覆盆子药材质量[3],单一的化学成分对药材质量的优劣反映往往不够全面,也不符合中医药的“整体观”。多指标综合评价法是将多个统计指标经过数据归一化处理,根据权重转化成相对评价值,将中药成分的复杂性及交互性完整体现[6]。因此,为判断覆盆子加工工艺对药材品质的影响,本研究通过测定不同加工工艺的覆盆子的总黄酮、多酚、多糖、三萜,采用TOPSIS综合评价[7],以筛选覆盆子的最优加工方法,保证覆盆子药材质量,为覆盆子药材质量的综合评价提供参考。
1 仪器与试药
MULTISKAN Sky酶标仪(Thermo Fisher公司);SB-5200DT超声波清洗机(宁波新芝生物科技股份有限公司,300W、50kHz);数显电热恒温水浴锅(常州朗越仪器制造有限公司);TC-15恒温电热套(海宁市华星仪器厂);EX125DZH电子天平(奥豪斯仪器常州有限公司);Spring-R10纯水仪(RO-DI)。
芦丁(批号:B20771,购于上海源叶生物科技有限公司);齐墩果酸(批号:B20954,购于上海源叶生物科技有限公司);香草醛(批号:V820371,购于麦克林);没食子酸(批号:B20851,购于上海源叶生物科技有限公司);甲醇、乙酸、高氯酸、乙酸乙酯、乙醇、碳酸钠、钼酸钠(二水)、钨酸钠(二水)、蒽酮、浓硫酸、氯化铝为分析纯。
覆盆子样品为2020年5月浙江磐安实地采集,按照如下方法加工:S1沸水中略烫,晒干;S2略蒸后,晒干;S3微波杀青后40℃烘干;S4为样品发酵24小时后,40℃烘干;S5晒干品;S6沸水中略烫-40℃干燥-回潮-发酵12小时-40℃二次干燥。S7-S10为沸水中略烫后分别采用40、50、60、70℃烘干。
2 方法
2.1 总黄酮含量测定[8-10]
2.1.1 对照品溶液制备
精密称取芦丁对照品4.0 mg,加入甲醇溶解并定容于10 mL容量瓶中,得到浓度为0.40 mg/mL的芦丁对照品溶液。
2.1.2 供试品溶液制备
精密称取干燥至恒重的样品1.0 g,置于100 mL具塞锥形瓶,加20 mL甲醇,摇匀,称重,超声波提取60分钟后取出,冷却,称重,补足损失,过滤、取续滤液即得。
2.1.3 标准曲线制备
分别精确吸取芦丁标准品溶液0.5、1.0、1.5、2.0、3.0 mL于具塞试管中,分别加入0.01mol/L的三氯化铝-甲醇至5mL,混匀后放置10分钟,置酶标仪中,于360 nm波长处,照UV-AIS法[11],测得吸光度值,以吸光度(A)为纵坐标、样品浓度(mg/mL)为横坐标,绘制其标准曲线。
2.1.4 样品测定取2.0 mL供试品溶液,加入0.01 mol/L的三氯化铝-甲醇3.0 mL,混合均匀后放置10分钟,置酶标仪中,在360 nm波长处,照UV-AIS法[11],测得吸光度值,根据线性关系,计算样品中的总黄酮含量。
2.2 总多酚含量测定
参考《中国药典》2020年版(四部)通则2202中“鞣质含量测定方法”[12]。
2.2.1 对照品溶液制备精密称定适量干燥至恒重的没食子酸对照品,加入甲醇,制成0.2 mg/mL的对照品溶液。
2.2.2 标准曲线制备
精密吸取对照品溶液0.05、0.2、0.25、0.3、0.4 mL,置于25 mL具塞锥形瓶中,加水至5 mL,精密加入磷钼钨酸试液1 mL,摇匀,静置6~8分钟,加入15%碳酸钠溶液1 mL,摇匀,置于室温、避光环境下充分反应2小时后,置酶标仪中,于765 nm波长处,UA-AIS法[11],测得吸光度值,以吸光度(A)为纵坐标、样品浓度(μg/mL)为横坐标,绘制其标准曲线。
2.2.3 供试品溶液制备
精密称取覆盆子样品粉末1.0 g,置于具塞锥形瓶中,加入甲醇25 mL,称定重量,超声处理30分钟(300 W、50 kHz),放冷,再次称定重量,补足重量,摇匀,滤过,取续滤液作为供试品溶液。
2.2.4 样品测定
精密吸取1.0 mL供试品溶液,置于25 mL容量瓶中,照标准曲线制备方法。自“加水至5 mL”起同上述步骤,测吸光度值,计算得出供试品溶液中没食子酸的含量。
2.3 三萜含量测定[13-14]
2.3.1 对照品溶液制备精密称取适量齐墩果酸对照品,加入甲醇,制成0.2 mg/mL的对照品溶液。
2.3.2 标准曲线制备
精密量取对照品溶液0.05、0.1、0.15、0.2、0.25 mL,分别置于15 mL具塞试管中,挥干,放冷,精密加入新配制的香草醛冰醋酸溶液0.1 mL和高氯酸0.4 mL,摇匀,在70℃水浴中加热15分钟,立即置冰水浴中冷却5分钟,取出,精密加入乙酸乙酯2 mL,摇匀,以相应试剂为空白,置酶标仪中,于546 nm波长处,照UV-AIS法[11],测得吸光度值,以吸光度(A)为纵坐标、样品浓度(mg/mL)为横坐标,绘制其标准曲线。
2.3.3 供试品溶液制备[15]
精密称取样品粉末1 g,置具塞锥形瓶中,加乙醇25 mL,超声45分钟,滤过,取滤液于100 mL容量瓶中,用适量乙醇分次洗涤滤器、滤渣,将洗液并入容量瓶,加乙醇定容,摇匀,即得。
2.3.4 样品测定
精密量取0.1 mL供试品溶液,置具塞试管中,照“2.3.2”项,自“挥干”起制备,测吸光度值,计算供试品溶液中齐墩果酸的含量。
2.4 多糖含量测定[14]
2.4.1.对照品溶液制备
精密称取的10 mg干燥至恒重的无水葡萄糖,加蒸馏水溶解,置于100 mL容量瓶中,定容,得到葡萄糖浓度为0.1 mg/mL的标准溶液。
2.4.2 标准曲线制备
分别精密吸取对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL于10 mL具塞试管,分别加水至2.0 mL,精密加入蒽酮-硫酸溶液6 mL。水浴加热15分钟后取出后,于冷水中冷却15分钟。以相应试剂为空白,于625 nm波长处,照UV-AIS法[11],测得吸光度值,以吸光度(A)为纵坐标、样品浓度(mg/mL)为横坐标,绘制标准曲线。
2.4.3 供试品溶液制备
精密称取覆盆子样品粉末1 g,置于具塞锥形瓶中,精密加入25 mL纯水,称定重量,超声提取45分钟,冷却后,称定重量,补足溶液,滤过,取续滤液即得供试品溶液。
2.4.4 样品测定
精密吸取2 mL供试品溶液置10 mL容量瓶中,置于具塞试管中,照“2.4.2”项下的方法,自“精密加入蒽酮-硫酸溶液”起,测定吸光度,计算即得供试品溶液中多糖的含量。
2 .5 TOPSIS分析
采用TOPSIS法,将各个成分的含量作为综合评价的标准,对不同加工工艺覆盆子药材的质量进行分析与评价,依据结果排序,判断覆盆子的质量优劣。
3 结果与分析[7 ,1 6 -2 0 ]
3.1 多指标成分的测定结果及分析
不同加工工艺覆盆子中各指标成分含量测定结果见表1。
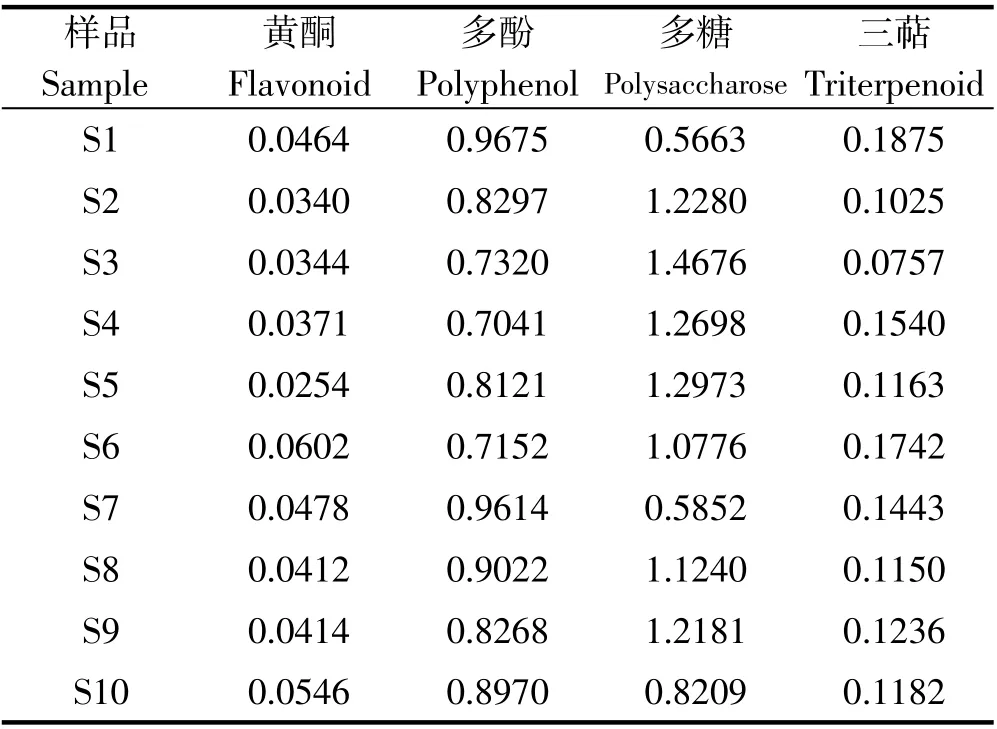
表1 不同加工工艺覆盆子中各指标测定结果(%)Table 1 Determination results of multiple indexes in R.chingii with different processing techniques(%)
3.2 TOPSIS分析[17-18]
3.2.1 原始数据归一化处理
不同加工覆盆子药材的多指标含量数据存在量纲不一致的问题,因此需要将矩阵按公式进行归一化处理,建立规范化矩阵见表2。
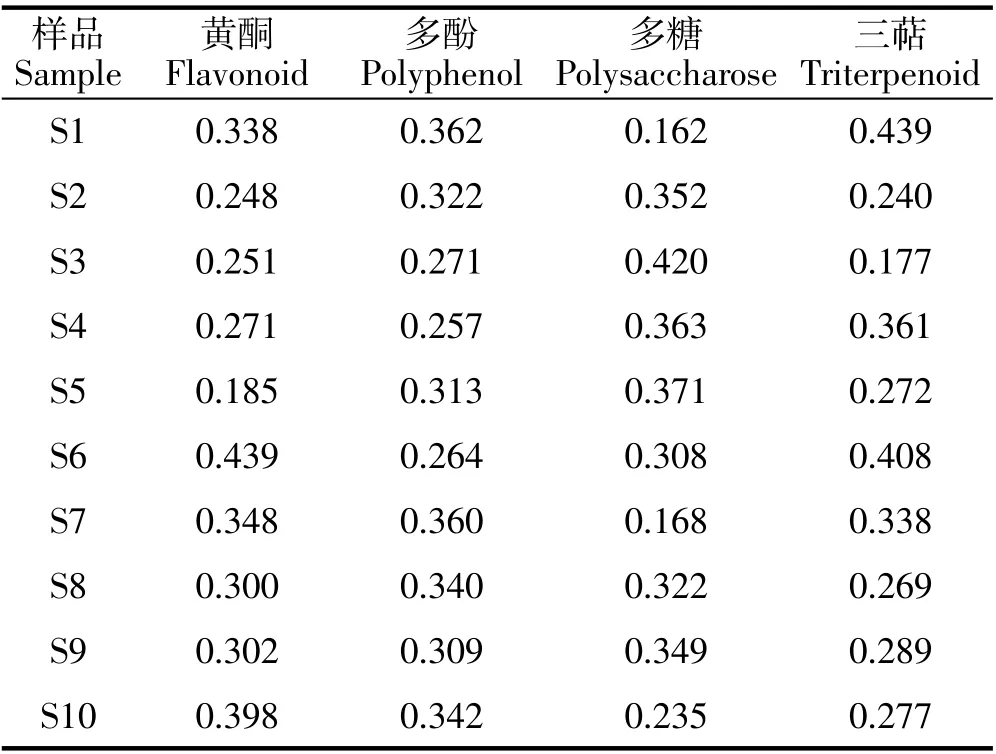
表2 归一化处理后矩阵Table 2 Normalized matrix

如公式所示,αij为第i个评价对象在第j个评价指标上归一化处理后的取值,Xij为第i个评价对象在第j个指标上的取值,X'ij为经倒数转换后的第i个评价对象在第j个指标上的取值。
3.2.2 Ci值的计算
按照下列公式,得出各评价指标与最优方案的接近程度(Ci)。将各评价指标与最优方案的接近程度Ci进行排序,Ci越大,综合质量越好。覆盆子药材的TOPSIS分析结果见表3。
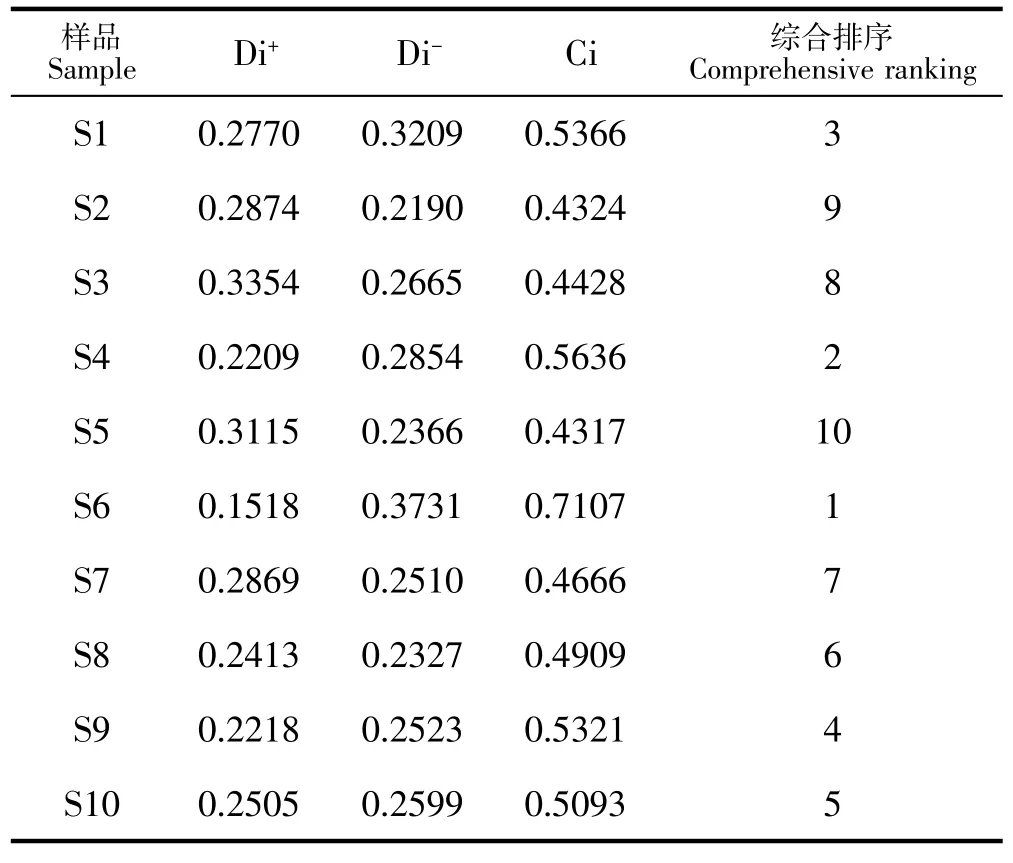
表3 不同加工覆盆子中多元指标成分TOPSIS评价结果Table 3 Topsis evaluation results of multiple index components in different processed Rubus chingii Hu
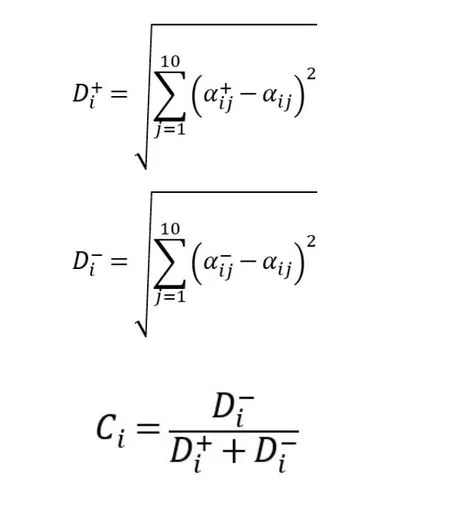
如公式所示,Di+与Di-分别为第i个评价指标至最优方案、最劣方案的距离;αij为某个评价对象i在第j个指标的取值。
3.2.3 TOPSIS结果分析
3.3 小结
查阅文献可知,覆盆子的黄酮具有抗补体活性、抗氧化活性、抗炎、抗血栓作用[4,20],多酚具有抗肿瘤、降血糖降血脂、抗氧化活性作用,多糖具有明显的抗氧化作用以及清除自由基作用[21],三萜类具有抗炎作用等[5]。
不同加工工艺的覆盆子药材中总黄酮、多酚、多糖、三萜测定结果如下:总黄酮的含量在0.025%~0.06%,样品S6的黄酮含量较高,质量分数为0.0602%,其次是S10含量为0.0546%。多酚的含量在0.70%~0.97%,三萜的含量在0.08%~0.19%,其中S1沸水中略烫-晒干加工的样品多酚含量和三萜含量均较高,质量分数分别为0.9675%,0.1875%。多糖的含量在0.55%~1.47%,样品S3多糖含量较高,质量分数为1.4676%,其次是晒干品1.2973%。表明不同加工工艺的覆盆子药材中各指标性成分的含量差异明显,但单一的化学成分难以对中药进行整体性的质量评价。
通过TOPSIS分析可知:沸水中略烫-40℃干燥-回潮-发酵12小时-40℃二次干燥的覆盆子综合质量较好,其次为样品发酵24小时后,40℃烘干。对比可知,综合质量较好的样品S4、S6均采用过一段时间发酵的加工手段,可见将微生物运用到工艺中可提高药物的综合质量[22]。而同样是晒干的加工工艺,单一的晒干法得到的覆盆子质量较差,蒸后晒干法没有沸水中略烫后晒干法的质量优。沸水中略烫后晒干与烘干法比较,晒干的样品质量更优,建议采用沸水中略烫后-晒干或60℃烘干法加工。微波杀青后烘干的方法对覆盆子质量提升帮助较小。可见耗时短、生产效率高的方法均能对有效成分产生一定的影响[23]。因此就化学成分而言,建议选用沸水中略烫-40℃干燥-回潮-发酵12小时-40℃二次干燥。
本实验通过测定不同加工的覆盆子药材中总黄酮、多糖、多酚、三萜含量,并对各指标进行TOPSIS综合评价,更能够反映其整体质量。筛选覆盆子的最优加工方法,为覆盆子药材的加工和质量综合评价提供参考。
