纳洛酮对过氧化氢诱导的海马神经元JNK/p38MAPK通路及凋亡的影响
2021-12-20郭志强李钰艳许斌兵
郭志强,李钰艳,许斌兵△
(四川省遂宁市中心医院 1.麻醉科 2.内分泌科,遂宁 629000)
氧化应激是一种体内抗氧化与氧化作用失调的状态,其所致的神经元凋亡是阿尔茨海默症和帕金森病等中枢神经系统疾病发病的重要机制[1-2]。纳洛酮(naloxone,NA)是一种人工合成的阿片受体拮抗剂,在临床用于麻醉镇痛过量挽救和急性呼吸抑制、急性酒精中毒等的治疗[3-4]。既往研究表明,NA可通过抑制或阻断病理损伤的最后途径发挥神经保护作用[5],但其是否通过抗氧化应激损伤减轻神经元凋亡而发挥神经保护作用并不清楚。过氧化氢(H2O2)是一种强氧化剂,常被用作构建氧化应激损伤模型的诱导剂[6-8]。本研究以小鼠海马神经元为研究对象,旨在探讨NA 对H2O2诱导的海马神经元的保护作用机制是否与其抑制氧化应激所介导的细胞凋亡有关。
1 材料与方法
1.1 主要材料 小鼠海马神经元HT22购于上海赛百慷生物技术股份有限公司,货号:MNCL-010;NA购于上海熹垣生物,货号:XY-USP-1 453005;H2O2购于上海联硕生物科技有限公司,货号:H1009;DMEM 培养基、放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解液、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体、丙二醛(malondialdehyde,MDA)、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购于上海生工生物工程有限公司,货号:E600010-0500、C500005、D110016-0100、D751027-0048,胎牛血清、细胞计数试剂盒-8(cell counting kit-8,CCK-8)、超氧化物歧化酶(superoxide dismutase,SOD)测试盒、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(propidium iodide,PI)试剂盒、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒、十二烷基硫酸—钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒和含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,Caspase-3)活性检测试剂盒购于上海索莱宝生物公司,货 号:F8245-100、ck04、QS1500、CA1020、QS1001、P1320、K106-100;c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)、磷酸化(phospho,p)-JNK抗体购于美国Cell Signaling Technology,货号:9252S、9255S;p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK) 和 pp38MAPK 抗体购于英国Abcam,货号:ab31828、ab178867。
1.2 神经元培养 采用含10%胎牛血清的DMEM培养基在湿度为80%、温度为37 ℃、二氧化碳体积分数为5%的细胞培养箱内常规培养小鼠海马神经元HT22细胞,待细胞密度达80%~90%时,以0.25%胰蛋白酶消化传代。实验选取长势良好的第3~5代指数期细胞进行实验。
1.3 CCK-8法检测神经元活力(1)H2O2最佳诱导浓度的选取:实验分为①对照(0 μmol/L)组:正常培养HT22细胞;②空白组:不接种HT22细胞,只加入等量培养基;③5 个H2O2处理组:加入终浓度为25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L 和400 μmol/L H2O2处理24 h;其中每组设3 个复孔。(2)NA 最佳作用浓度的选取:实验分为①对照(0 μmol/L)组:同(1);②空白组:同(1);③5个NA处理组:加入终浓度为0.01 μmol/L、0.1 μmol/L、1 μmol/L、10 μmol/L 和100 μmol/L NA 处理24 h;其中每组设3 个复孔。(3)NA 对H2O2诱导的细胞活力检测:实验分为①正常组:正常培养HT22 细胞;②空白组:同(1);③H2O2组:以200 μmol/L H2O2处理24 h;④H2O2+低、高NA 2 个处理组:以200 μmol/L H2O2和0.1 μmol/L、1 μmol/L NA 共同处理24 h;其中每组设3 个复孔。将指数期HT22 细胞接种至96 孔细胞板上,于细胞培养箱内常规培养;根据上述分组对HT22 细胞处理结束后,弃培养液,加入CCK-8 工作液10 μL;室温孵育2 h 后,采用酶标仪在490 nm 波长处检测HT22 细胞光密度(optic density,OD)值,并以(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%表示神经元活力。实验重复3次。
1.4 神经元上清液中LDH释放量和SOD、MDA水平检测 按照“1.3项”中实验(3)处理HT22细胞后,收集正常组、H2O2组和H2O2+低、高NA 组细胞上清液,参照LDH试剂盒和SOD、MDA试剂盒说明书检测各组神经元上清液中LDH 释放量和SOD、MDA水平。实验重复3次。
1.5 流式细胞术检测神经元凋亡 收集处理结束后的正常组、H2O2组和H2O2+低、高NA组细胞,使用磷酸缓冲液对细胞进行漂洗;300 μL 1×binding buffer调整细胞浓度后,取含有105个细胞悬液于上样管中,加入5 μL Annexin V-FITC 和5 μL PI;避光双染15 min后,上机检测各组神经元凋亡情况。实验重复3次。
1.6 神经元Caspase-3活性检测 处理结束后的正常组、H2O2组和H2O2+低、高NA 组细胞,以1 000 r/min离心15 min后,吸去上清液;经磷酸缓冲液洗涤后,加入细胞裂解液30 μL裂解10 min后,再次离心弃上清;严格参照Caspase-3活性检测试剂盒说明书检测各组神经元Caspase-3活性。实验重复3次。
1.7 免疫印迹法检测神经元中JNK、p-JNK、p38MAPK 和p-p38MAPK 蛋白表达 收集处理结束后的正常组、H2O2组和H2O2+低、高NA组细胞,加入RIPA裂解液抽提细胞总蛋白;采用考马斯亮蓝法检测总蛋白浓度与纯度。将蛋白样品与等体积上样缓冲液充分混匀后,置于沸水浴中煮沸5 min;将变性后的蛋白样品行SDS-PAGE 分离后,湿转法转膜;采用含5%脱脂奶粉封闭液封闭聚偏氟乙烯膜2 h 后,以1∶2 000 比例稀释的GAPDH、JNK、p-JNK、p38MAPK 和p-p38MAPK 一抗于4 ℃冰箱孵育过夜;次日,以1∶5 000 比例稀释的GAPDH、JNK、p-JNK、p38MAPK 和p-p38MAPK 二抗室温孵育2 h 后,滴加化学发光剂暗室内显影曝光;以GAPDH 为内参,采用凝胶成像分析系统扫描分析神经元中JNK、p-JNK、p38MAPK 和p-p38MAPK 蛋白表达水平。实验重复3次。
1.8 统计学方法 采用SPSS 24.0 进行统计学分析。计量资料以均数±标准差()表示,多组间比较行单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 H2O2最佳诱导浓度的选取25 μmol/L、50 μmol/L H2O2作用后神经元活力虽有所降低,但与0 μmol/L 比较,差异无统计学意义(P>0.05);而100 μmol/L、200 μmol/L 和400 μmol/L H2O2作用后神经元活力较0 μmol/L 明显降低(均P<0.05),且200 μmol/L H2O2作用后神经元活力为62.65%,故后续以200 μmol/L H2O2进行实验,见表1。
表1 不同浓度H2O2作用后神经元活力变化n=9,
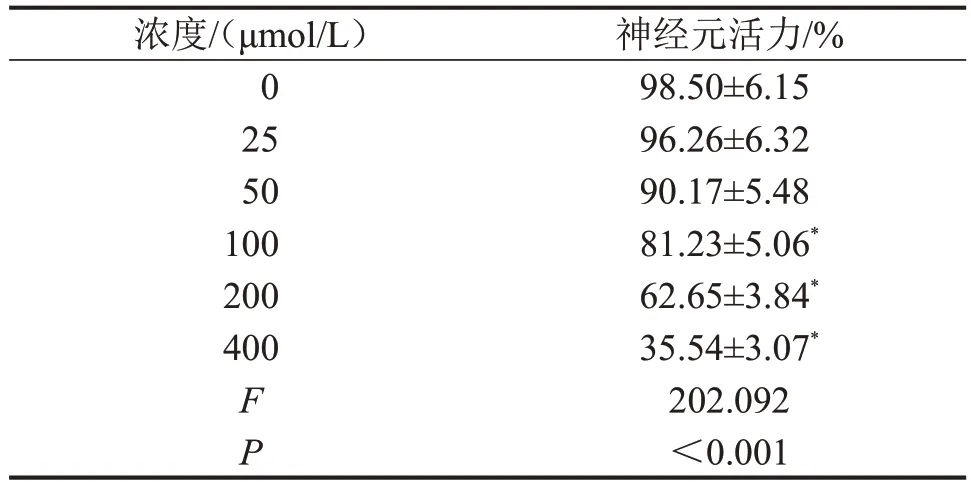
表1 不同浓度H2O2作用后神经元活力变化n=9,
与0 μmol/L比较,*P<0.05。
2.2 NA 最佳作用浓度的选取 与0 μmol/L 比较,0.1 μmol/L 和1 μmol/L NA 作用下神经元活力明显增强(均P<0.05);而10 μmol/L 和100 μmol/L NA作用后神经元活力较0 μmol/L 明显降低(均P<0.05),对神经元产生明显毒性作用。故后续以0.1 μmol/L和1 μmol/L NA进行实验,见表2。
表2 不同浓度NA作用后神经元活力变化n=9,
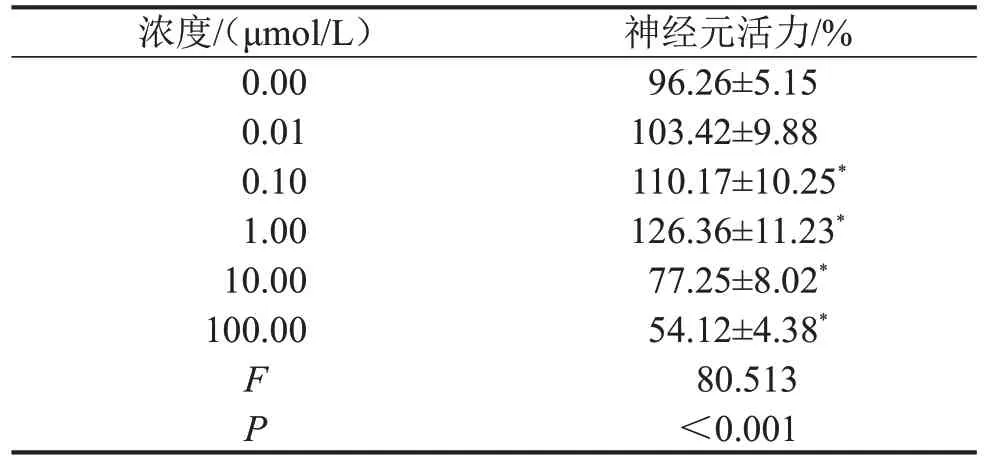
表2 不同浓度NA作用后神经元活力变化n=9,
与0 μmol/L比较,*P<0.05。
2.3 NA 对H2O2诱导的海马神经元活力及LDH 释放量的影响 与正常组比较,H2O2组神经元活力明显降低,而LDH释放量明显升高(P<0.05);与H2O2组比较,H2O2+低NA 组和H2O2+高NA 组神经元活力明显升高,而LDH释放量明显降低(均P<0.05);与H2O2+低NA 组比较,H2O2+高NA 组神经元活力明显升高,而LDH释放量明显降低(均P<0.05),见表3。
表3 各组神经元活力和LDH释放量比较n=9,
与正常组比较,*P<0.05;与H2O2组比较,#P<0.05;与H2O2+低NA组比较,&P<0.05。
2.4 NA对H2O2诱导的海马神经元MDA和SOD水平的影响 与正常组比较,H2O2组神经元上清液中MDA 水平明显升高,而SOD 水平明显降低(P<0.05);与H2O2组比较,H2O2+低NA组和H2O2+高NA组细胞上清液中MDA 水平明显降低,而SOD 水平明显升高(P<0.05);与H2O2+低NA 组比较,H2O2+高NA组细胞上清液中MDA水平明显降低,而SOD水平明显升高(P<0.05),见表4。
表4 各组神经元上清液中MDA和SOD水平比较n=9,
与正常组比较,*P<0.05;与H2O2组比较,#P<0.05;与H2O2+低NA组比较,&P<0.05。
2.5 NA对H2O2诱导的海马神经元凋亡的影响
与正常组比较,H2O2组细胞凋亡率和Caspase-3活性明显升高(P<0.05);而H2O2+低NA组和H2O2+高NA 组细胞凋亡率和Caspase-3 活性较H2O2组明显降低(P<0.05);H2O2+高NA组凋亡率和Caspase-3 活性较H2O2+低NA 组明显降低(P<0.05),见图1和表5。
表5 各组神经元凋亡率和Caspase-3活性比较n=9,
与正常组比较,*P<0.05;与H2O2组比较,#P<0.05;与H2O2+低NA组比较,&P<0.05。
2.6 NA 对H2O2诱导的海马神经元JNK/p38MAPK通路的影响 与正常组比较,H2O2组神经元中JNK/p38MAPK 通路关键因子JNK 和p38MAPK 磷酸化水平明显升高(P<0.05);而H2O2+低NA组和H2O2+高NA 组细胞中JNK 和p38MAPK 磷酸化水平较H2O2组明显降低(P<0.05);H2O2+高NA 组细胞中JNK和p38MAPK磷酸化水平较H2O2+低NA组明显降低(P<0.05),见图2和表6。
表6 各组中JNK和p38MAPK磷酸化水平比较n=9,
与正常组比较,*P<0.05;与H2O2组比较,#P<0.05;与H2O2+低NA组比较,&P<0.05。
3 讨论
大脑是神经系统最高级部分,相对其他组织而言,脑组织耗氧量多、能量代谢旺盛、抗氧化能力差,更易因氧自由基攻击而发生氧化应激损伤;大量氧自由基的产生不仅可引起神经细胞蛋白质、核酸和脂质等功能的改变,还可激活凋亡执行因子Caspase-3 活化;而Caspase-3 活化后可引起一系列的酶级联反应,促进神经细胞凋亡[9]。海马是大脑边缘系统的一部分,在记忆和空间定位等过程中发挥着重要作用;在阿尔茨海默病和帕金森等神经退行性疾病中海马组织中伴随着大量海马神经元凋亡[2,10-11],因此,抗海马神经元凋亡是治疗神经退行性疾病的重要策略。
作为一种强氧化剂,H2O2极易进入细胞产生氧自由基或羟基自由基,促进活性氧的产生,进而引起氧化应激损伤。LDH是一种糖酵解酶,在细胞受损时可从细胞内释放到细胞外,常被作为反映细胞损伤的重要指标[12-13]。SOD是生物体内一种重要的抗氧化酶,可通过病理歧化作用清除过多的氧自由基,减轻细胞损伤;MDA是一种生物体脂质氧化产物,可导致细胞功能损伤;SOD和MDA常被作为反映细胞氧化应激损伤的重要指标[14]。本研究以不同浓度的H2O2诱导小鼠海马神经元发现,200 μmol/L H2O2作用后神经元活力为62.65%,死亡较少;此外,200 μmol/L H2O2还可诱导神经元LDH释放量、MDA水平、神经元凋亡率和Caspase-3活性升高,而SOD水平减少(P<0.05)。表明H2O2可通过诱导氧化应激损伤引起海马神经元凋亡,H2O2氧化应激损伤模型构建成功。
NA是一种对神经细胞有保护作用的阿片受体拮抗剂,可通过调控HSP60-TLR4 途径介导炎症反应而抑制小胶质细胞活化[2],也可抑制神经细胞凋亡减轻脑缺血再灌注损伤[15]。研究显示,NA可通过下调MDA 和上调SOD 水平发挥抗氧化作用[16],但其是否通过抗氧化应激途径减弱神经细胞凋亡而发挥神经保护作用并不明确。本研究首先以不同浓度NA作用小鼠海马神经元,结果发现0.1 μmol/L和1 μmol/L NA 作用下神经元活力增强,无明显毒性产生;以0.1 μmol/L 和1 μmol/L NA 与H2O2联合作用后发现,H2O2引起的LDH 释放量、MDA 水平、神经元凋亡率和Caspase-3活性升高以及SOD水平减少均明显逆转(P<0.05)。结果表明,NA 可能通过抑制氧化应激损伤减轻海马神经元凋亡。提示NA的神经保护作用与其抑制氧化应激损伤所介导的神经元凋亡有关。
MAPK 通路是细胞内重要的信号转导途径,其中JNK 和p38MAPK 是该途径的重要组成部分;当受到外界应激刺激时,JNK 和p38MAPK 可通过磷酸化被激活,而激活的JNK/p38MAPK 具有促进细胞凋亡的作用,与神经损伤密切相关[17]。研究显示,氧化应激诱导剂H2O2可通过激活JNK和p38MAPK通路诱导神经细胞凋亡[18];而NA 具有抑制JNK 和p38MAPK 通路活化的作用[19-20]。本研究发现,200 μmol/L H2O2可诱导神经元JNK和p38MAPK磷酸化水平明显升高,而给予NA作用后,H2O2诱导引起的上述变化明显受到抑制(P<0.05)。结果表明,NA 可抑制H2O2诱导的神经元JNK/p38MAPK 通路活化。提示NA抑制氧化应激损伤所介导的神经元凋亡可能与其抑制JNK/p38MAPK通路活化有关。
综上所述,NA可能通过抑制JNK/p38MAPK通路活化减轻H2O2诱导的海马神经元损伤,进而抑制海马神经元凋亡,发挥神经保护作用。然而,NA抑制JNK/p38MAPK 通路活化的详细机制,还有待后续进一步深入探讨。
