苯并芘对猪卵母细胞SHH信号通路影响的研究
2021-12-19金壬顺张贞洪侯少辉李井春
金壬顺,张贞洪,靳 鑫,侯少辉,李井春 ,郭 庆
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
1 前言
近年来,世界范围内环境污染问题仍备受关注,其中较为常见的空气污染物苯并芘(Benzo(a)pyrene,BaP),对人和动物具有致癌性,同时对生殖健康也具有严重的影响[1-2]。在生殖上研究表明,BaP可以通过产生过量活性氧(Reactive oxyeng,ROS)降低卵母细胞减数分裂能力[3]。因此,长时间的雾霾天气对人和动物生殖造成的严重影响不可忽视,明确BaP对卵母细胞损伤的潜在机制,将为解决这一问题提供理论参考依据。
对BaP在生殖上影响的研究越来越多,高浓度BaP对雄性和雌性小鼠的性腺都具有严重的影响。雄性小鼠体内实验研究表明,长时间且高浓度的BaP环境下的雄性小鼠雄激素含量显著下降,并引起生殖细胞损伤[4]。同时,体外实验研究也表明BaP会增加睾丸支持细胞凋亡率[5]。而BaP对雌性动物的损伤上主要表现为降低卵巢功能,引起早期卵巢衰竭[6]、抑制卵泡生长、使卵泡闭锁[7]、排卵失败和抑制孕酮分泌等降低妊娠率[8]。在妊娠期间BaP通过破坏雌激素和孕激素的分泌引起小鼠胚胎附植的失败[9]。在对卵母细胞的影响上,BaP主要通过损伤DNA、破坏纺锤体形态和功能等抑制卵母细胞成熟[2]。此外,研究表明,BaP可以通过破坏Sonic hedgehog(SHH)信号通路相关基因和蛋白的表达破坏骨骼肌细胞的生长[10]。同时,SHH信号通路活性对卵母细胞成熟至关重要[11-13]。SHH信号通路主要功能是调控细胞生长、增殖和分化[14]。研究报道表明,SHH信号通路关键组成部分(SHH配体、PTCH1受体、SMO受体、GLI1转录因子)在猪卵母细胞中有其mRNA和蛋白的表达[11-12]。而且,在猪卵母细胞IVM和胚胎体外发育培养液中添加SHH重组(rSHH)蛋白可显著促进体外授精(IVF)胚胎的发育能力[13]。
因此,基于骨骼肌细胞中研究表明BaP对SHH信号通路的破坏作用,同时,在猪卵母细胞IVM过程中SHH信号通路起到至关重要的作用。因此,本研究检测BaP在猪卵母细胞IVM过程中对SHH信号通路的影响,从而初步判断BaP损伤卵母细胞的潜在机制。
2 材料与方法
2.1 实验材料
本实验应用的猪卵巢取自大庆市屠宰场。分离屠宰后的母猪卵巢放置于含有预热的生理盐水的保温瓶中,在2 h内运输到实验室。
2.2 实验方法
2.2.1 猪卵母细胞采集及IVM培养
将使用保温瓶运输到实验室的卵巢用预热的生理盐水清洗3遍,并清除多余的组织,使用搭配18号针头的注射器抽取直径为2~6 mm卵泡中的卵母细胞。选取胞质致密均匀,且含有3层以上卵丘细胞的卵丘细胞-卵母细胞复合体(COCs),用含有Hepes(4-羟乙基哌嗪乙磺酸生物缓冲液)的卵母细胞洗液洗涤3遍后放置于含有10%pFF(猪卵泡液)、10 IU/mL hCG(绒毛膜促性腺激素)、10 IU/mL PMSG(孕马血清促性腺激素)的NCSU-37培养液中,并在CO2培养箱中培养44 h。
2.2.2 检测卵母细胞减数分裂进程
利用透明质酸酶脱去成熟时期COCs上的卵丘细胞,置于含有蔗糖的胚胎体外发育培养液中,显微镜下挑出含有第一极体的成熟卵母细胞,并计算IVM效率。
2.2.3 qPCR
收集猪卵母细胞,利用Dynabeads mRNA DIRECTTM试剂盒提取其总RNA,并使用SuperScript®III First-Strand合成试剂盒反转录成cDNA。使用Agilent Mx3005P系统对合成的cDNA进行实时定量PCR反应。反应结果使用经典的2-△△Ct法统计分析。
2.2.4 免疫荧光染色
分别收集对照组和BaP处理组MII期猪卵母细胞,并按如下步骤进行,在含有1%PVA的PBS(PBSPVA)溶液中洗涤3~5次,4%多聚甲醛中固定1 h,PBS-PVA中洗涤3~5次,1%Triton X-100的96孔板中通透30 min,2%BSA的PBS中封闭1 h,4℃且避光的条件下与一抗共孵育过夜,与二抗共同避光的条件下孵育1 h,PBS-PVA中洗涤3次,Hoechst33342染色细胞核,显微镜下照相。
2.3 实验设计
2.3.1 不同浓度BaP处理对猪卵母细胞IVM能力的影响
收集猪卵母细胞进行IVM培养,并分别在IVM培养液中添加不同浓度BaP(0 µM BaP、100 µM BaP、200 µM BaP)处理42 h。使用透明质酸酶去除卵丘细胞后挑选出含有第一极体的成熟卵母细胞,并计算IVM效率。
2.3.2 BaP处理对猪卵母细胞SHH信号通路关键基因mRNA表达量的影响
为了进一步验证BaP破坏猪卵母细胞IVM能力的因素,在实验一的基础上,收集对照组和抑制卵母细胞成熟的低浓度BaP处理组卵母细胞。使用qPCR技术检测SHH信号通路关键基因(SHH、PTCH1、SMO、GLI1)mRNA表达量。
2.3.3 BaP处理对猪卵母细胞SHH信号通路关键蛋白表达量的影响
为了进一步确认BaP处理对猪卵母细胞IVM影响的因素,分别收集对照组和抑制卵母细胞成熟的低浓度BaP处理组卵母细胞,使用免疫荧光染色技术检测SHH信号通路起始蛋白(SHH)和作用蛋白(GLI1)表达情况。
3 结果与分析
3.1 不同浓度BaP处理对猪卵母细胞IVM能力的影响
实验结果显示,相比于对照组,各BaP浓度处理组卵母细胞IVM效率均显著降低(76.5% vs 68.1%、50.6%、38.2%,P<0.05,表1)。
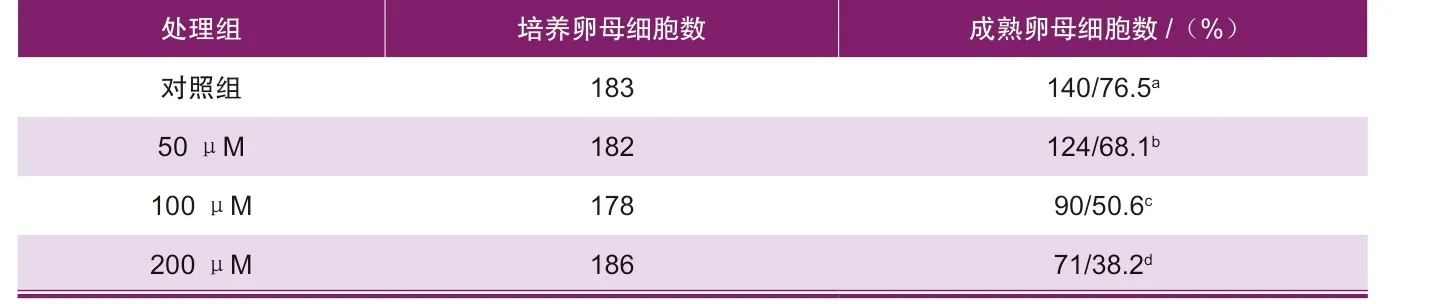
表1 不同浓度BaP处理对猪卵母细胞IVM能力的影响
3.2 BaP处理对猪卵母细胞SHH信号通路关键基因mRNA表达量的影响
实验一结果显示50 μM的BaP处理可以显著地降低猪卵母细胞IVM能力,因此本实验分别收集对照组和50 μM BaP处理组的卵母细胞,通过qPCR分析SHH信号通路关键基因的表达。结果显示,相比于对照组,BaP处理组中SHH、PTCH1、SMO、GLI1基因mRNA表达量均显著下降(P<0.05,图1)。
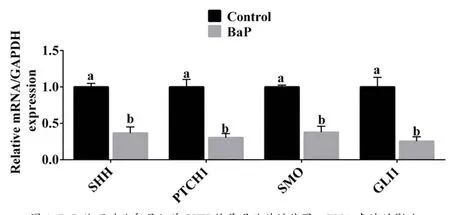
图1 BaP处理对猪卵母细胞SHH信号通路关键基因mRNA表达的影响
3.3 BaP处理对猪卵母细胞SHH信号通路关键蛋白表达量的影响
为进一步检测BaP对猪卵母细胞SHH信号通路的影响,收集对照组和50 µM BaP处理组成熟卵母细胞进行免疫荧光染色,检测SHH信号通路起始蛋白(SHH)和作用蛋白(GLI1)表达情况。结果显示,相比于对照组,BaP处理组中GLI1和SHH蛋白表达量均显著降低(P<0.05,图2)。
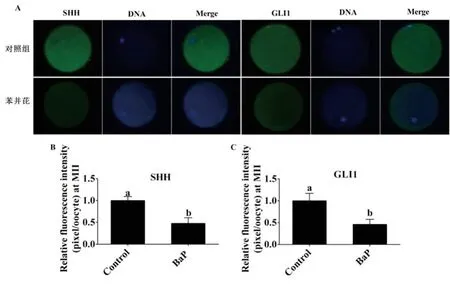
图2 BaP处理对猪卵母细胞SHH信号通路关键蛋白表达量的影响
4 讨论与结论
BaP是空气污染的主要来源之一,BaP对多种细胞具有致癌性,其机制主要是和细胞内 DNA形成共价加合物[15]。而在对卵母细胞的研究上,BaP会导致卵母细胞内ROS含量增加、破坏线粒体功能从而降低卵母细胞IVM 效率和成熟质量及后期胚胎发育能力,但具体机制尚不清楚。在骨骼肌细胞的研究中进一步发现,BaP 通过抑制SHH信号通路破坏细胞的生长,因此本研究主要探讨BaP破坏猪卵母细胞IVM的潜在机制是否通过破坏SHH信号通路实现的。
本研究在猪卵母细胞IVM培养液中添加不同浓度BaP检测其对IVM能力的影响。结果显示,相比于对照组,各BaP处理组卵母细胞IVM效率均显著的低于对照组,并随着BaP浓度的增加IVM效率进一步下降, 这与之前研究报道BaP对卵母细胞的损伤相一致[2]。此外,为了进一步检测BaP破坏猪卵母细胞IVM效率的机制,本研究检测出50 µM BaP处理后猪卵母细胞SHH信号通路相关基因mRNA和蛋白的表达量均显著地低于对照组。这与BaP可以通过破坏SHH信号通路降低骨骼肌细胞生长相似[10]。因此,本研究初步证明了空气污染物BaP可能通过破坏SHH信号通路降低猪卵母细胞IVM。为进一步理解 BaP 损伤卵母细胞提供理论基础,为寻找降低BaP对动物和人类生殖损伤方法提供理论依据。
